Важной частью механизма, обеспечивающего качество представленных на рынке лекарственных средств (ЛС) является система клинических испытаний (КИ). КИ – один из наиболее значимых этапов создания ЛС, поскольку только таким образом можно получить достоверные данные об эффективности, безопасности (показателе риск/польза), а также отдаленных последствиях применения ЛС.
Внедрение нового ЛС на рынок – процесс длительный и дорогостоящий. При этом наибольших затрат требуют КИ: продолжительность около 6 лет; затраты в среднем составляют 90% от стоимости разработки ЛС.
Значение КИ трудно переоценить: во-первых, именно их проведение дает возможность в некоторой степени гарантировать безопасность использования ЛС; во-вторых, — обеспечить качество лечения, поскольку врач может ориентироваться на подтвержденную эффективность используемых ЛС при определенной патологии.
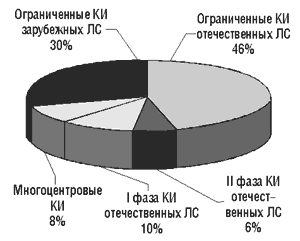 |
Рисунок.
Клинические испытания ЛС, проведенные в 1996–2001 гг. (всего — 1088)
В последнее время многие авторитетные международные организации прилагают значительные усилия для разработки и внедрения единых стандартов изучения и лицензирования ЛС. Результатом такой работы стало принятие в ходе Международной конференции по гармонизации технических требований к регистрации лекарственных препаратов для человека ICH в странах ЕС, США, Канаде и Японии унифицированных требований к проведению КИ (GCP ICH). Это также повлияло на процедуру регистрации и клинической апробации ЛС в Украине.
Клинические испытания — КИ (Clinical Trial / Study)
— это любое клиническое исследование с участием человека в качестве испытуемого, проводимое для подтверждения клинических, фармакологических и/или других фармакодинамических эффектов исследуемого лекарственного средства, и/или для выявления всех побочных реакций, возникающих вследствие его применения, и/или для изучения его всасывания, распределения, биотрансформации и выведения в целях установления его безопасности и эффективности. Термины «Клинические испытания» и «Клинические исследования» — синонимы [3].
КИ ЛС отечественного или зарубежного производства в Украине могут быть проведены по полной, сокращенной (ограниченные КИ) программе или в виде многоцентровых международных испытаний (см. рисунок).
В соответствии с международной классификацией различают следующие фазы КИ.
I фаза КИ (Phase I Study)
— это первые испытания нового ЛC на людях, (обычно с участием 20–80 здоровых добровольцев), при проведении которых исследователи стараются установить диапазон доз, в пределах которого препарат достаточно хорошо переносится при однократном или повторном применении. I фазу КИ иногда проводят с участием пациентов с тяжелыми заболеваниями, например со злокачественными опухолями, СПИДом и др. Если фармакокинетические исследования направлены на изучение какого-либо специального вопроса (например, особенности метаболизма нового противосудорожного препарата у пациентов с эпилепсией, у которых другие препараты этой группы оказывали гепатотоксическое действие), то в КИ могут принять участие пациенты с менее тяжелыми проявлениями заболевания. Как правило, фармакокинетические исследования независимо от того, на каком этапе клинической разработки препарата они проводятся, относят к I фазе КИ.
II фаза КИ (Phase II Study)
— это первый опыт применения ЛС у пациентов с заболеванием, для лечения которого предполагается его использовать. Ранние КИ во II фазе часто называют пилотными, так как полученные результаты обеспечивают оптимальное планирование более дорогостоящих и обширных исследований. Главной целью II фазы КИ является доказательство клинической эффективности ЛС у определенной группы пациентов. Дополнительно задачей является определение терапевтической дозы ЛС. Иногда II фаза КИ подразделяется на фазы IIа и IIб.
III фаза КИ (Phase III Study)
— это тщательно контролируемые исследования, спланированные в целях определения безопасности и эффективности ЛС в условиях, приближенных к тем, в которых оно будет использовано в случае его разрешения для медицинского применения. III фаза иногда подразделяется на фазы IIIа и IIIб. Исследования IIIа фазы проводят до подачи заявки на регистрацию в регуляторные органы. Исследования, относящиеся к IIIб фазе — проводят после подачи заявки на регистрацию, но перед получением лицензии (регистрации) на лекарственный препарат и его запуском в серийное производство.
IV фазу КИ (Phase IV Study)
проводят после лицензирования (регистрации) лекарственного препарата, ее часто называют постмаркетинговыми исследованиями. Данная фаза КИ включает исследования, проводимые в целях получения более подробной информации о безопасности и эффективности препарата. Фаза IV может быть использована для оценки данных относительно:
-
усовершенствования схем дозирования ЛС;
-
различных сроков применения ЛС;
-
взаимодействия препарата с пищей и/или другими ЛС;
-
сравнительного анализа с другими стандартными курсами лечения;
-
применения ЛС у пациентов разных возрастных групп или категорий;
-
влияния отдаленных эффектов применения препарата на выживаемость (снижение или повышение уровня смертности);
-
результатов длительного применения ЛС у пациентов различных групп.
КИ новых отечественных ЛС проводят по полной программе, включающей две последовательные фазы. Данные, полученные в ходе предыдущей фазы испытаний, служат основанием для планирования и разработки последующей фазы или прекращения клинической разработки ЛС.
КИ препаратов-генериков, как правило, проводят по сокращенной программе (ограниченные КИ). Это испытания, целью которых является сравнительная оценка эффективности и безопасности двух ЛС, применяемых в одинаковых условиях у ограниченного количества пациентов [3].
Внедрение международных стандартов надлежащей клинической практики (GCP) проведения КИ ЛС в Украине
Государственная политика Украины в сфере фармацевтического производства направлена на внедрение современных международных и европейских стандартов по созданию и производству современных высокоэффективных лекарственных препаратов.
Клиническому этапу разработки ЛС во всем мире уделяется большое внимание. При проведении КИ особое значение имеет защита прав пациента и его здоровья. С точки зрения доверия к результатам КИ и этичности получения этих результатов наиболее репрезентативными являются испытания, проведенные в соответствии с требованиями международного стандарта GCP.
GCP — это международные стандарты надлежащей клинической практики для проведения КИ, охватывающие планирование, проведение, мониторинг, аудит, анализ, отчетность и документацию, и гарантирующие, что КИ обосновано с этической и научной точек зрения, а также тщательно документировано [1].
Для внедрения стандартов GCP в Украине в 1995 г. в структуре Фармакологического комитета МЗ Украины был создан Отдел координации КИ ЛС (далее — Отдел), который начиная с 1996 г. проводит активную работу по экспертизе материалов КИ. В 2000 г. Отдел был реорганизован в Сектор организации и контроля КИ ГП «Государственного фармакологического центра» (ГФЦ) МЗ Украины (далее — Сектор).
В состав Сектора входят:
-
Отдел координации КИ
-
Отдел клинической апробации
-
Группа аттестации и контроля клинических баз
-
Отдел фармакологического надзора.
Основное направление деятельности Сектора — внедрение международных стандартов GCP в Украине. Прежде всего — это постоянная консультативная работа с разработчиками и производителями ЛС и врачами, проводившими КИ. На первом этапе внедрения стандартов GCP основное внимание уделялось протоколам КИ, индивидуальной регистрационной форме пациента. Большинство представляемых протоколов КИ по своей структуре и заложенной информации приближаются к международным требованиям.
Немаловажен тот факт, что Сектор совместно со специализированными экспертными комиссиями ГФЦ участвует в рецензировании материалов КИ, что позволяет еще на этапе их планирования избежать ошибочных и недостоверных результатов. В процессе рецензирования в первую очередь обращают внимание на качество оформления протокола КИ. Требования к оформлению подаваемых на экспертизу материалов значительно повысились, что способствует не только более тщательному контролю за проведением КИ, но и более эффективному внедрению международных стандартов GCP в практику проведения КИ в Украине.
Следующим этапом внедрения стандартов GCP в Украине является более тщательный контроль и информирование о побочных эффектах ЛС, улучшение дизайна, проведение рандомизированных, слепых исследований. Проведение мониторинга, аудита и инспекций КИ позволит дополнительно усовершенствовать систему контроля за ними.
Создание нормативной базы для проведения КИ ЛС
Повышение требований к качеству ЛС, а значит, и к качеству КИ характеризует тенденции развития фармацевтического рынка Украины. В целях внедрения международных стандартов организации и проведения КИ ЛС в Украине сотрудниками Сектора был проведен значительный объем работ по созданию нормативной базы КИ.
В конце 2000 г. на основании ст. 7 и 8 закона Украины «О лекарственных средствах», а также с учетом международных норм проведения КИ были разработаны и утверждены:
1. «Инструкция о проведении КИ ЛС и экспертизы материалов КИ» — приказ МЗ Украины № 281 от 01.11.2000 г.;
2. «Типовое положение о Комиссиях по вопросам этики» — приказ МЗ Украины № 281 от 01.11.2000 г.
В 2001 г. работа по созданию нормативной документации продолжалась, в частности, были разработаны и утверждены:
-
«Инструкция о проведении инспекционных проверок КИ ЛС» (утверждена научно-экспертным советом ГФЦ МЗ Украины от 01.11.2001 г.).
-
«Перечень лечебно-профилактических учреждений, в которых могут быть проведены клинические испытания лекарственных средств» (далее — Перечень) — приказ МЗ Украины № 420 от 22.10.2001 г.
Сотрудники Сектора также приняли участие в разработке «Инструкции о порядке экспертизы ЛС, которые подаются на Государственную регистрацию в ГП «Государственный фармакологический центр» МЗ Украины и оформление микродосье» (утверждена научно-экспертным советом ГФЦ МЗ Украины 26.02.2001 г.). В этот период были также разработаны предложения к новой редакции закона Украины «О лекарственных средствах».
В соответствии с разработанными нормативными документами сотрудники Сектора проводят экспертизу материалов КИ (протоколов, отчетов). Экспертизе также подвергаются все изменения, вносимые в материалы КИ в процессе их рецензирования и проведения испытаний.
На основании экспертизы сотрудники Сектора анализируют состояние КИ, а именно:
-
качество протоколов и отчетов;
-
количественное распределение препаратов, направленных на КИ независимо от фармакотерапевтической группы и производителя;
-
состояние загруженности клинических баз.
Результаты анализа, проведенного на основании экспертизы протоколов и отчетов о КИ, свидетельствуют о том, что вследствие принятых мер качество оформления документации повысилось. Однако в некоторых случаях оформление протоколов не соответствовало требованиям ГФЦ МЗ Украины. Наиболее значимыми недостатками в оформлении протоколов КИ являются:
-
неадекватный выбор дизайна КИ (не приняты во внимание особенности проведения испытания препаратов различных фармакотерапевтических групп);
-
неточное определение критериев отбора пациентов;
-
необоснованный отбор пациентов в контрольную группу;
-
неполное описание схемы лечения;
-
неточное определение критериев эффективности и др.
Возникли замечания к составлению отчетов о клинических испытаниях:
-
несоответствие протоколу КИ (по количеству больных, критериям отбора пациентов, выбору схем лечения и методов обследования);
-
некорректный анализ результатов КИ (статистическая обработка данных);
-
неудовлетворительное представление клинических данных.
В целях улучшения качества КИ в Украине издано «Руководство по клиническим испытаниям лекарственных средств» [2]. В период работы II Национального съезда фармакологов Украины в 2001 г. в Днепропетровске на заседании межгосударственной комиссии по стандартизации и контролю качества ЛС, изделий медицинского назначения и медицинской техники стран СНГ было принято решение об использовании этого издания в странах СНГ в качестве пособия для врачей-исследователей.
Клинические базы для проведения КИ ЛС
Одно из направлений деятельности Сектора — работа с клиническими базами по проведению КИ.
В соответствии со ст. 7 закона Украины «О лекарственных средствах» (1996 г.) КИ ЛС должны проводиться в специализированных лечебно-профилактических учреждениях, Перечень которых определяется МЗ Украины или уполномоченным органом.
При создании Перечня клинических баз были учтены возможности лечебно-профилактических учреждений в проведении современных лабораторных и клинико-инструментальных исследований. Основное внимание было уделено:
-
научно-клиническим направлениям работы лечебно-профилактического учреждения (определение фармакотерапевтических групп препаратов, которые могут быть испытаны на данной клинической базе);
-
кадровому составу с наличием опыта подготовки к проведению КИ ЛС (в том числе в соответствии с требованиями GCP);
-
возможности проведения лабораторных и клинико-инструментальных исследований (основные методы);
-
оснащенности лечебно-профилактического учреждения оборудованием, реактивами, компьютерной техникой;
-
характеристике коечного фонда;
-
созданию комиссий по вопросам этики при лечебно-профилактических учреждениях, на базе которых расположены клинические базы ГФЦ.
В настоящее время Перечень клинических баз включает 218 клиник из числа наиболее хорошо оснащенных и ведущих в каждой области медицины. Перечень клинических баз периодически пересматривается. Для включения лечебно-профилактического учреждения в число клинических баз его руководитель подает соответствующее заявление на имя директора ГФЦ и заполняет карту аттестации клинической базы. После рассмотрения материалов и проведения аттестации клиники выносится решение о возможности включения в Перечень.
В целях контроля за проведением КИ ЛС в 1999 г. в составе Сектора была выделена Группа аттестации и контроля клинических баз.
При выявлении в ходе инспекции грубых нарушений порядка проведения КИ и/или этических норм клиническая база может исключаться из Перечня.
Другие аспекты проведения КИ ЛС в Украине, в частности, роль фармакологического надзора за побочными реакциями/явлениями ЛС, этические аспекты и осуществление государственного инспектирования КИ ЛС будут освещены в ближайшем номере «Еженедельника АПТЕКА».
Владимир Мальцев, руководитель сектора координации
и контроля клинических исследований ГФЦ МЗ Украины,
доктор медицинских наук, профессор
Татьяна Ефимцева, кандидат медицинских наук
Дмитрий Пилипенко
Денис Сухинин
ЛИТЕРАТУРА
|

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим