|
Как свидетельствуют данные проведенного в 52 странах мира исследования, выведение на рынок ЛС с новыми фармацевтическими ингредиентами обеспечило в период 1986–2000 гг. увеличение ожидаемой продолжительности жизни почти на 2 года (1,96 года), тогда как для всей популяции этот прирост составил 0,056 лет или 2,93 нед (Lichtenberg F.R., 2003). Однако наряду с восторженными надеждами, возлагаемыми на прогресс фармакотерапии, общественность, медицинское сообщество, государство, страховые компании выражают обеспокоенность отмечаемыми нежелательными последствиями приема ЛС. Так, например, в США побочные реакции (ПР) препаратов занимают 4–6 место по значимости среди причин смерти, опережая СПИД и сахарный диабет. Согласно результатам метаанализа в период с 1966 по 1996 г. серьезные ПР выявляли у 6,7% госпитализированных больных, причем у 0,32% (95% доверительный интервал 0,23–0,41%) они имели фатальный исход (Lazarou J., Pomeranz B.H., 1998).
Не удивительно, что за последние несколько десятилетий изучение ПР дало начало новым научным направлениям со всеми неотъемлемыми атрибутами: терминологией, понятиями, определениями, методами исследования и оценки полученных результатов.
|
|
Татьяна Ефимцева, заместитель начальника отдела координации клинических испытаний ГФЦ, и Наталья Богачева, руководитель группы надзора за побочными реакциями при клинических испытаниях ГФЦ, детально осветили порядок отчетности о ПР при проведении КИ в Украине.
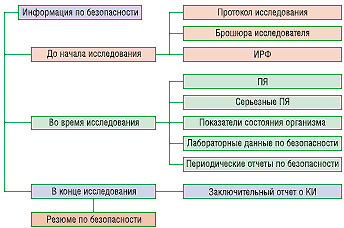
Главным нормативным актом, регламентирующим отчетность при проведении КИ, является приказ Министерства здравоохранения Украины от 13.02.2006 г. № 66 «Об утверждении Порядка проведения клинических испытаний лекарственных средств и экспертизы материалов клинических испытаний» (далее — Порядок). Согласно этому нормативному акту мониторинг безопасности следует осуществлять на всех этапах КИ (рис. 1).
|
||||
|
При проведении КИ задействовано пять сторон: пациент, спонсор, исследователь, этический комитет (ЭК) и регуляторный орган. Все, кроме больного, включены в систему мониторинга безопасности. В обязанности исследователя входит выявление побочных явлений (ПЯ), ПР, серьезных непредвиденных ПР, обеспечение безопасности пациентов, внесение информации в индивидуальную регистрационную форму (ИРФ) и первичную документацию, а также предоставление данных спонсору, ГФЦ, ЭК. В свою очередь, на спонсора возложен анализ информации о безопасности в документации КИ, обеспечение получения информации от исследователей и ее хранение, анализ полученных данных, информирование ГФЦ и ЭК, предоставление периодической отчетности по безопасности, а также подготовка отчета о проведенном КИ. ГФЦ и ЭК занимаются регистрацией сообщений, отчетов по безопасности, заключительных отчетов о КИ, анализом полученных данных. ГФЦ, спонсор, исследователь уполномочены в случае необходимости остановить проведение КИ временно или полностью. Исследователь обязан предоставить спонсору срочное сообщение о серьезных ПЯ, а также в плановом порядке сведения обо всех ПЯ. Спонсор обязан предоставлять исследователю сообщения обо всех случаях серьезных непредвиденных ПР, которые влияют на безопасность испытуемых.
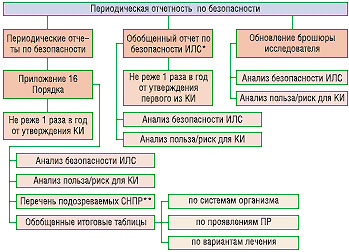
В ГФЦ и ЭК поступают срочные сообщения от исследователя о серьезных ПР в течение 2 дней с момента выявления по форме, указанной в приложении 14 Порядка, а также дополнительная информация, особенно в случае смерти. Эти требования не распространяются на международные КИ. При проведении таких КИ спонсор должен предоставить в ГФЦ и ЭК срочные сообщения о серьезных непредвиденных ПР, угрожающих жизни или приведших к смерти в течение 7 дней с момента получения информации от исследователя согласно требованиям приложения 15 Порядка. Помимо указанной выше информации, спонсоры обязаны предоставлять ГФЦ периодические отчеты (рис. 2)
Заключительный отчет о КИ должен содержать сведения о степени воздействия (доза и длительность) испытываемого ЛС, анализ наиболее часто отмечаемых ПЯ, причем для серьезных ПЯ следует указать их исход, коррекцию и последствия; перечень индивидуальных данных. Сведения могут быть приведены в таблицах, графиках.
С удовлетворением докладчик отметила, что на протяжении последних лет прослеживается увеличение количества сообщений относительно безопасности, поступающих в ГФЦ. Однако, в ряде случаев, предоставляемая информация не лишена недостатков:
- не передаются сообщения о ПР и отчеты по безопасности или не соблюдаются сроки подачи;
- не оформляются сопроводительные документы или они не информативны (не указывается, проходит ли в Украине исследование по данному протоколу, отсутствует его номер; при ПР, возникших в Украине, не указывается клиническая база, на которой произошел случай);
- предоставляются неполные или малоинформативные данные (не указывается причинно-следственная связь с ЛС или на ней не акцентируется внимание);
- сообщения о ПР при проведении международных КИ передаются исследователями, а не спонсорами.
Предполагается, что в будущем удастся устранить имеющиеся недостатки и наладить механизм сотрудничества всех звеньев системы от производителя или спонсора КИ до ГФЦ, который должен обеспечить получение полного объема информации о ПР ЛС, минимизацию риска для испытуемых в КИ и, впоследствии, более безопасное лечение пациентов. По мере дальнейшего развития процесса обработки и систематизации данных согласно мировым и европейским стандартам станет возможной интеграция с другими информационными системами по безопасности ЛС.
|
Как рассказал заведующий отделом фармакологического надзора ГФЦ, заведующий отделом клинической фармакологии Национального научного центра «Институт кардиологии им. Н.Д. Стражеско АМН Украины», профессор Алексей Викторов, фармакоэпидемиология как наука возникла на стыке клинической фармакологии и эпидемиологии еще в 60-е годы прошлого столетия. Она изучает в реальных условиях эффективность и безопасность ЛС при их медицинском применении на уровне популяции или больших групп пациентов (5000–10 000 человек и более), способствуя рационализации фармакотерапии на основе различных критериев, в том числе, — стоимость/эффективность. Фармакоэпидемиология позволяет оценить вклад применения препаратов в показатели здоровья населения.
Цель фармакоэпидемиологического исследования — изучение эффективности и/или безопасности медицинского применения ЛС в целях выявления или подтверждения его клинических, токсикологических, фармакодинамических и/или фармакокинетических свойств и взаимодействия препарата с другими ЛС. Результаты этих исследований необходимы каждому врачу в повседневной работе для оценки риска применения ЛС у конкретного пациента и обоснованного решения о назначении ЛС или, наоборот, отказе от его применения. В свою очередь, фармацевтические компании получают дополнительную информацию о ПР ЛС, имеют возможность оценить перспективы нового ЛС по сравнению с применяющимися, определить профиль безопасности. Кроме того, фармакоэпидемиологические исследования обеспечивают «реальную» базу для проведения фармакоэкономических исследований.
По своей сути фармакоэпидемиологические исследования, как правило, неинтервенционные, то есть ЛС назначают согласно инструкции по медицинскому применению. Однако в некоторых случаях прибегают и к интервенционным исследованиям. В этом случае обязательно получение информированного согласия. Различают проспективные, ретроспективные и одномоментные исследования, а изложение результатов может носить как описательный, так и аналитический характер. Описательные исследования включают в себя описание случая (case report) или случаев (case series), изучение долговременных тенденций (analyses of secular trends). Аналитические исследования могут быть типа случай-контроль (case-control studies), когортными (cohort studies) или же принимать форму опросов (surveys). Последнюю форму чаще всего используют в социологических исследованиях, а также в исследованиях по изучению фармацевтического рынка.
Наиболее высокой доказательностью обладают рандомизированные КИ. Это наиболее методологически близкий к классическому научному эксперименту вид исследований, который при правильном планировании позволяет свести к минимуму систематические ошибки. Самая надежная структура исследования — это контролируемое испытание. Главное его отличие в том, что результат применения конкретного метода сравнивают с результатом в контрольной группе. Если сравниваемые группы отличаются друг от друга только способом лечения, то есть все основания считать, что различие в исходах связано с отличиями в терапевтических подходах. Это надежное свидетельство преимуществ или недостатков нового лечения.
При проведении фармакоэпидемиологических исследований очень важно правильное планирование. При этом можно выделить такие этапы: определение задач предстоящей работы, выбор замысла исследования, сбор фактического материала, выбор математического аппарата анализа базы данных, обработка полученных результатов и формулировка выводов и предложений. При проведении фармакоэпидемиологичесикх исследований следует учитывать показатели состояния обследуемых популяций, а именно: заболеваемость, распространенность патологии, ее относительный и атрибутивный риск, стандартизованные показатели заболеваемости. Также необходима исчерпывающая информация об исследуемом препарате, его фармакокинетике, дозовом режиме, химико-фармакологической характеристике. Следует учитывать также другие факторы, которые могут модулировать действие ЛС, такие как вредные привычки, производственные условия, характер работы, место жительства пациентов. Такие показатели, как социальная принадлежность, пол, возраст, раса, также учитываются при проведении исследований, однако использование соответствующих статистических методик позволяет уравнять распределение этих факторов в сравниваемых группах.
|
Ольга Миронова, директор представительства контрактно-исследовательской организации «Scope International AG» (Киев), представила доклад на тему «Современные подходы в оценке побочных явлений при проведении клинических испытаний». Согласно определению, сформулированному ICH-GCP (1996), ПЯ — это любое выявленное у субъекта КИ, получающего ЛС, неблагоприятное медицинское событие, которое может и не иметь причинно-следственной связи с проводимым лечением. Эти события могут проявляться обострением или клиническим ухудшением существующего заболевания или состояния, повышением частоты или интенсивности эпизодов заболевания, которое диагностировали ранее, или новым диагностированным состоянием после применения исследуемого препарата. Важно, что регистрация ПЯ начинается с момента дачи информированого согласия пациента. ПЯ классифицируют, исходя из их серьезности, ожидаемости, тяжести клинических проявлений и взаимосвязи с применением ЛС. Серьезным ПЯ считается то, которое приводит к смерти, угрожает жизни пациента, требует госпитализации или продления существующей госпитализации, приводит к стойкой утрате трудоспособности, проявляется врожденной аномалией или дефектом развития. Взаимосвязь между ПЯ и применением ЛС оценивает исследователь или врач. ВОЗ предлагает такие возможные оценки связи между применением ЛС и ПЯ ():
- нет связи
- определенная
- вероятная
- возможная
- условная/неклассифицированная
- не поддающаяся оценке/неклассифицируемая.
В случае установления связи между приемом ЛС и ПЯ, последнее рассматривается как ПР. В зависимости от выраженности клинических проявлений различают ПЯ различной степени тяжести. Например, может быть отмечено транзиторное покраснение кожи вследствие аллергической реакции (расценивается как ПЯ легкой степени тяжести), высыпание в виде крапивницы (умеренной степени тяжести), бронхоспазм, сопровождающийся артериальной гипотензией (тяжелое ПЯ). Анафилактический шок расценивают как состояние, угрожающее жизни, и самым тяжелым ПЯ является смерть пациента. История болезни и ИРФ должны содержать такую информацию:
- природа ПЯ. К исследователям выдвигается требование при описании ПЯ использовать исключительно терминологию, соответствующую Международной классификации болезней 10 пересмотра. Полюбившаяся нашим врачам многословная описательная форма изложения диагноза неприемлема. Согласно требованиям терминология должна быть максимально лаконичной. Например, вместо «нарушение ритма и проводимости в виде мерцательной аритмии» в отчетной документации следует указать «фибрилляция предсердий». В случае информирования общеевропейских органов фармаконадзора либо организаторов исследования предписано пользоваться Медицинским словарем для уполномоченных органов (Medical Dictionary for Regulatory Activities — MedDRA), который обновляется дважды в год. К сожалению, он не является общедоступным;
- время возникновения ПЯ;
- было ли ПЯ однократным или повторяющимся. Под однократностью подразумевается единичный случай или непрекращающееся ПЯ; в случае неоднократного возникновения с интервалами более 24 ч ПЯ считается повторяющимся;
- серьезность ПЯ в соответствии с изложенными выше критериями;
- оценка тяжести клинического проявления ПЯ;
- длительность наблюдаемого ПЯ в днях, часах или минутах;
- меры, предпринятые для купирования ПЯ. Иногда наблюдаемое ПЯ не требует каких-либо действий, однако в ряде случаев дополнительно назначают другие ЛС, изменяют дозировку, форму введения исследуемого препарата, что обобщенно называют лекарственной терапией. Иногда необходима отмена ЛС и прекращение участия больного в исследовании в связи с возникшим ПЯ. Среди других мер могут быть хирургическое вмешательство, курс физиотерапии и т.д.;
- описания исхода ПЯ проводится с использованием таких терминов: разрешено, если проявления ПЯ более не отмечают; в процессе разрешения, если существует положительная динамика, но разрешение не наступило; не разрешено; разрешено с последствиями; летальный исход; исход неизвестен;
- на основании детального анализа полученных данных делается вывод, связано ли ПЯ с приемом исследуемого препарата. Если существует обоснованная или вероятная возможность, что ПЯ было вызвано применением ЛС, ПЯ далее расценивается как ПР. Если не существует взаимосвязи между применением исследуемого ЛС и возникшим случаем, но имеется очевидная альтернативная причина возникновения ПЯ, например основное заболевание или наличие сопутствующего заболевания, то в выводах значится, что ПЯ не связано с применением препарата.
Обобщенные сведения об эффективности применения препарата и наблюдаемых ПР приводят в отчетности о проведенном КИ в соответствии с действующими нормативными актами. О непредвиденных и серьезных ПР в четко указанные сроки дополнительно сообщают спонсору и органам фармаконадзора, которые оставляют за собой право запретить дальнейшее проведение исследований.
|
В докладе «Обработка и анализ информации о побочных эффектах в ходе клинических испытаний» Алексей Жмуро, директор компании «ПАРЕКСЕЛ Украина», остановился на вопросах обеспечения безопасности КИ. Поскольку при проведении испытаний из всех участвующих сторон наибольший риск отмечен именно у испытуемого, подвергающего опасности свое здоровье, а может быть и жизнь, особенно при проведении I фазы КИ, то защита его прав и минимизация риска является самой главной юридической и этической проблемой. При этом каждая из участвующих сторон в той или иной мере несет ответственность за последствия.
Включению больного в группу исследуемых предшествует детальный сбор персональных данных, что позволяет оценить риск для пациента. В дальнейшем эти сведения должны оставаться строго конфиденциальными. Прозрачность и доступность результатов КИ позволяют медицинскому сообществу, органам фармаконадзора, ЭК и соответствующим общественным организациям наблюдать со стороны за ходом испытания и при необходимости влиять на его дальнейший ход. Предполагается, что в своих действиях исследователь, в данном случае врач, будет следовать положениям Хельсинкской декларации Всемирной медицинской ассоциации — рекомендации для врачей по проведению биомедицинских исследований на людях, которая гласит, что «каждому проекту медицинского исследования на людях должна предшествовать тщательная оценка прогнозируемых рисков и отягощающих обстоятельств в сопоставлении с предполагаемой пользой для испытуемых и других лиц» (п. 3). Кроме того, «врачи должны воздерживаться от участия в исследовательских проектах, предполагающих участие людей до тех пор, пока они не убедятся, что возможные риски адекватно оценены и могут должным образом контролироваться. Врачи должны прекращать любые исследования, если выявленные риски преобладают над потенциальной пользой или получены убедительные доказательства позитивных и благоприятных результатов» (п. 4).
При проведении КИ особое внимание исследующей стороны должно уделяться сбору сведений о ПЯ и управлению данными по безопасности. Как свидетельствует опыт, принципы и методы минимизации риска при проведении КИ мало отличаются от таковых в других областях знаний, поэтому оправдано привлечение специалистов в области риск-менеджмента. Необходима разработка плана управления риском и создание команды управления безопасностью. На практике применяется такая последовательность действий: исследователь в случае выявления ПЯ обязан информировать спонсора — организацию, проводящую КИ, тем раньше, чем серьезнее наблюдаемое явление. Это сообщение должно включать собственную оценку врачом причинно-следственной связи. В помощь исследователю к протоколу КИ должны прилагаться исчерпывающие сведения о критериях идентификации и определения ПЯ.
Кроме результатов конкретного исследования, производится сбор релевантной информации из других источников. Далее проводится идентификация и оценка риска. При этом учитываются временные точки оценки, клинические ситуации, в которых отмечали ПЯ, проводится изучение причинно-следственной связи. Далее на основе полученных данных, выявленных ранее сведений, рассмотрения индивидуальных случаев проводится оценка соотношения польза/риск. В последующем данные группируются и подвергаются комплексному исследованию. Идентификация и оценка риска в ходе КИ может производиться непрерывно, по требованию, периодически, на определенных этапах (точках) проекта, по завершении исследования. В последнем случае проводится анализ всей полученной в ходе КИ информации, не ограничиваясь данными о ПЯ, что приводит к обновлению сведений о продукте.
При статистической обработке данных действует принцип «отсутствие доказательства связи не есть доказательство отсутствия связи». К сожалению, методы анализа не разработаны в такой мере, как для анализа эффективности и не унифицированы, поэтому в протоколе исследований должно содержаться описание используемых методов.
В мировой практике спонсор может обращаться за помощью к группе независимых экспертов для периодической оценки хода КИ и дачи рекомендаций относительно продолжения, прекращения либо модификации испытания.
Кроме прагматического и ограниченного подхода к ПР как показателям безопасности ЛС, существует другой, более широкий научный взгляд на эти реакции как таковые, о чем рассказал в докладе «Побочные реакции лекарственных средств: классификации, механизмы развития» А. Викторов. Сегодня много внимания уделяется регистрации ПР, их частоте в свете безопасности конкретного препарата, однако ряд принципиально важных вопросов теории и практики, относящихся непосредственно к ПР ЛС (причинам возникновения, механизмам развития, особенностям клинического течения, профилактики и лечения, организационным мероприятиям), остаются недостаточно изученными. Особое значение имеет отсутствие единого подхода к патогенетическим основам ПР ЛС, а, к сожалению, общепринятый интегральный взгляд на фундаментальные основы лекарственной патологии отсутствует и является предметом дискуссий.
Согласно одной из классификаций различают четыре типа ПР (по Rawling M.D., Thompson J.W., 1991):
- тип А (зависят от дозы);
- тип В (не зависят от дозы);
- тип С (эффекты при длительном применении, синдром отмены);
- тип D (отсроченные эффекты, тератогенность).
ПР, зависимые от дозы (тип А), обусловлены фармакологическими свойствами и токсичностью самого ЛС или его метаболитов, предсказуемы на основании знаний их фармакологических свойств. Они возникают часто, для них характерна невысокая летальность. На долю реакций этого типа приходится около 75% всех ПР.
ПР, независимые от дозы (тип В), чаще всего являются реакциями иммуноаллергической природы (например анафилактический шок, синдром Стивенса — Джонсона), а также генетически детерминированными реакциями. Они возникают редко, не связаны с дозой ЛС, часто серьезные, их трудно предвидеть (непредсказуемые, неожиданные), для них характерна высокая летальность; составляют около 25% всех зарегистрированных ПР. Встречаются при всех путях введения ЛС. При наличии повышенной чувствительности организма ПР возникают даже на ЛС в очень низких дозах.
ПР типа С возникают, как правило, после длительной терапии (как следствие продолжительности лечения и дозы ЛС или одного из этих факторов); часто расцениваются как серьезные и по своей природе зачастую необратимы к моменту их выявления; трудны для изучения и выявления, так как всегда четко определяется временной интервал между началом лечения и их развитием (синдром отмены, лекарственная зависимость, кумулятивные эффекты и эффекты подавления выработки гормонов, толерантность); возникают в результате ослабления или прекращения действия механизмов адаптации организма вследствие длительного воздействия ЛС.
Отсроченные эффекты (тип D) включают канцерогенные, мутагенные, тератогенные эффекты, дефекты репродуктивной системы и др., которые могут возникать через месяцы или годы после лечения.
|
В продолжение обсуждения вопроса о значимости изучения ПР Наталья Горовенко, член-корреспондент АМН Украины, профессор, заведующая кафедрой медицинской генетики НМАПО им. П.Л. Шупика, представила доклад «Фармакогенетическое обоснование побочного действия лекарственных средств».
На сегодня, отметила Н. Горовенко, подбор ЛС осуществляется эмпирически методом проб и ошибок, и если назначенный препарат не оказывает действия у данного пациента, повышают дозу или меняют препарат, пока не будет достигнут положительный эффект. Однако при таком подходе к назначению не учитывается, что генетически обусловленная ответная реакция на применение ЛС будет различной среди индивидов одной популяции.
По выражению Арчибальда Гаррода, в мире не существует двух индивидуумов с абсолютно одинаковым метаболизмом, и индивидуальные колебания активности ферментов в печени могут быть причиной различий в ответной реакции пациентов на одно и то же ЛС (Garrod A., 1902). У одного индивида в разное время жизни, монозиготных близнецов, других индивидов с одинаковыми вариантами генов генетически обусловленные ответные реакции на применение препарата могут не различаться. Фармакогенетика изучает индивидуальную реакцию на воздействие лекарственного вещества, связанную с наличием полиморфных вариантов генов у различных индивидов.
Межиндивидуальные различия ответа на ЛС связаны с полиморфными вариантами генов, которые кодируют ферменты, белки-рецепторы и белки ионных каналов. Так, при быстром расщеплении атипичными энзимами назначенного в обычной дозировке ЛС могут отмечать снижение эффективности препарата, тогда как замедление метаболизма приводит к возникновению кумулятивных, нередко токсических явлений. Кроме атипичной ферментативной активности, на отклонения эффективности лечения и выраженность ПР также влияет соотношение активности исходного препарата и его производных, а также новые свойства метаболитов, в том числе токсические.
Некоторые препараты проявляют токсический эффект очень редко (например частота развития гепатотоксичности бромфенака — 1:20 000), следовательно, представление о профиле безопасности после выхода препарата на рынок может существенно измениться. Так, бромфенак изъяли через 1 год (1998) после применения у 100 000 пациентов (Friedman M.A. et al., 1999). Сегодня известно, что генетические причины определяют от 20 до 95% вариабельности действия препарата, в том числе терапевтической эффективности, резистентности и ПР (Evans W.E., McLeod H.L., 2003). Известно, что к сентябрю 2006 г. около 10% инструкций к ЛС, разрешенным к применению Управлением по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA), содержат информацию о геномных биомаркерах. Соглано современным подходам уже II фазу КИ следует планировать с учетом данных фармакогеномики. Использование геномных биомаркеров может позволить:
- предугадать ответную реакцию пациента на лекарственное вещество;
- избежать токсического эффекта;
- отрегулировать дозу для оптимизации эффективности и безопасности применения препарата;
- снизить стоимость лечения за счет снижения дозы ЛС у лиц с низкой активностью ферментов и отсутствия затрат на лечение ПР.
В процессе метаболизма ЛС или детоксикации различают три фазы. В осуществлении первой фазы ключевая роль отведена семейству цитохромов Р450, насчитывающему около 60 видов гидролаз. Снижение активности одного из этих ферментов приводит к замедлению действия всей системы детоксикации. Глутатионтрансферазы и некоторые другие ферменты отвечают за осуществление второй фазы. В заключительной фазе задействованы выделительные системы организма.
Так, 6-меркаптопурин — первый антиметаболит, который по сей день широко применяют в онкологической практике, метаболизируется тиопуринметилтрансферазой (ТПМТ). Вызванный генетической мутацией дефицит тиопуринметилтрансферазы со снижением активности ТПМТ в 200–400 раз приводит при назначении препарата в обычных терапевтических дозировках к тяжелейшей миелодепрессии, что отмечают у 0,33% населения. В случае выявления мутации необходимо снижение дозировки, что позволит достичь нужного терапевтического эффекта и избежать развития серьезной ПР. Дефицит глюкозо-6-фосфатдегидрогеназы приводит к развитию гемолиза при приеме сульфаниламидов и противомалярийных препаратов. Такую генетическую мутацию отмечают у 8–30% мужчин — жителей Северной Африки, Средиземноморья, Кавказа, что также необходимо учитывать при выборе тактики лечения.
Н. Горовенко подчеркнула, что фармакогенетика учитывает действие не единичных мутантных генов, а полиморфных вариантов, имеющих место у многих индивидов популяции. Нельзя ожидать эффекта «ген — признак» согласно законам Менделя. Выявление патологического варианта гена не носит фатальный характер, а лишь предрасполагает к определенному эффекту. Сегодня кафедра медицинской генетики НМАПО им. П.Л. Шупика ведет активную работу по изучению полиморфизма генов, который влияет на метаболизм и фармакологическое действие ЛС.
Сегодня в лаборатории кафедры медицинской генетики НМАПО изучают широкий спектр полиморфных вариантов генов, в том числе:
- ангиотензиноген (AGT)
- ангиотензинпревращающий фермент (ACE)
- рецептор I типа ангиотензина II (AT2R1)
- NO-синтаза клеток эндотелия сосудов (NOS3)
- метилентетрагидрофолатредуктаза (MTHFR)
- глутатион S-трансфераза M1 (GSTM1)
- глутатион S-трансфераза T1 (GSTT1)
- глутатион S-трансфераза P1 (GSTP1)
- ариламин-N-ацетилтрансфераза 2 (NAT2)
- белок клеток Клара (СС16)
- фактор некроза опухоли альфа (TNF )
- интерлейкин 6 (IL-6)
- цитохром Р450 2С9 (CYP 2С9)
- цитохром Р450 2D6 (CYP 2D6)
- цитохром Р450 2С19 (CYP 2С19)
- хемокиновый рецептор тип 5 (CCR5)
- ТПМТ
О статистических аспектах фармакоэпидемиологических исследований рассказал Павел Бабич, консультант ГФЦ по применению статистических методов, отметивший, что надлежащее планирование фармакоэпидемиологических исследований позволяет снизить риск получения ложных результатов исследования, оптимально расходовать имеющиеся средства.
При статистической обработке данных следует предупреждать возникновение систематической ошибки — неслучайного, однонаправленного отклонения результатов испытаний от истинных значений. Наиболее часто они обусловлены погрешностями отбора, в результате которых оценки реакции субъектов выбранной и генеральной совокупности отличаются. Нередко возникает протопатическое смещение (protopathic bias) при исследованиях типа случай-контроль. Это случается, когда ранние симптомы болезни, которая уже развилась, но еще не распознана, у пациента, начавшего принимать препарат по другому поводу, принимают за ПР ЛС.
При интерпретации результатов следует учитывать, что главная задача статистики — сделать заключение, насколько полученные результаты являются неслучайными. Для этого используется проверка значимости полученных результатов, а также методы интервального оценивания.
Таким образом, успех КИ во многом зависит от продуманности и правильного планирования проведения самого исследования, риск-менеджмента, анализа полученной информации, а также надлежащего контроля выполнения проекта. n
|
Ирина Смольянинова, фото Игоря Кривинского








Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим