 |
| Ольга Баула |
Безопасность фармакотерапии обеспечивается не оценкой соответствия препарата каким бы то ни было нормам, а определением соотношения риска и пользы его применения на всем протяжении жизненного цикла препарата, от разработки до медицинского применения. Это неоднократно подчеркивала Ольга Баула, первый заместитель директора ГФЦ, на протяжении своего доклада.
 |
| Шанти Пал |
Второй важнейший тезис, звучавший и в выступлении д-ра Шанти Пал (Dr Shanthi Pal), сотрудницы штаб-квартиры ВОЗ (группа «Quality Assurance&Safety for Medicines»): во главе угла должны быть интересы пациента. Только такой подход, по признанию обоих докладчиков, помогает выйти из регуляторных коллизий. Для иллюстрации этого положения О. Баула привела цитату из Директивы Европейского парламента и Совета Европы 2001/83/EC: «Основной целью любых правил, регулирующих разработку, производство, распределение и использование лекарственных препаратов, должна быть защита здоровья людей. Однако средства, используемые для достижения этой цели, не должны препятствовать развитию фармацевтической промышленности или торговле лекарственными препаратами…» Как отметила сама докладчик, смысл этой фразы состоит в том, что зачастую сомнительное качество препарата по сравнению с его полной недоступностью — меньшее зло для пациента.
Сегодня в нашей стране для обеспечения и контроля за качеством и безопасностью ЛС сделано уже очень многое — как на уровне нормативных документов, так и их практической реализации. Но в действующем Законе Украины «О лекарственных средствах» (1996 г.) многие важные положения вообще отсутствуют, к примеру нет даже определения фармацевтической разработки и фармаконадзора. Новая же редакция закона, которую готовят уже на протяжении полугода, включит все основополагающие положения надлежащих практик — от производственной (GMP) до регуляторной (GRP) (схема 1).

Многие из этих норм уже активно внедряются и используются. Чего стоят только около 30 приказов МЗ Украины, согласно которым препараты получают государственную регистрацию! Да и фармацевтические предприятия, хотя во многом тяготеют к советским принципам разобщения этапов создания (проектирования) ЛС и их производства, постепенно внедряют у себя системы контроля качества. Все больше фармзаводов выполняют фармацевтическую разработку ЛС, а ведь это именно тот этап, на котором закладывается безопасность ЛС. От адекватного прохождения следующих этапов — доклинических и клинических исследований, государственной регистрации и производства — будет зависеть сохранение препаратом профиля безопасности, сформированного при разработке (схема 2).

В настоящее время, отметила О. Баула, ГФЦ сотрудничает с Государственной инспекцией по контролю качества лекарственных средств. Во время инспекций выявляют много изменений, которые реализованы на производстве, но не внесены в регистрационную документацию. При этом влияние этих изменений на эффективность и безопасность препаратов не доказано. К примеру, без согласования с регуляторным органом меняют поставщиков активных фармацевтических ингредиентов (АФИ), что совершенно недопустимо. Помимо простого внесения изменений (Iа, Ib и II типов) в регистрационное досье, может возникнуть необходимость в новой регистрации препарата.
 |
| Ирина Кудрявцева |
К таким изменениям, как отметила в своем докладе Ирина Кудрявцева, заместитель директора ГФЦ, директор Департамента регистрации (перерегистрации) лекарственных средств, относят следующие (согласно приказу МЗ Украины от 01.03.2006 г. № 95):
1. Изменения действующих веществ:
- добавление одного или более;
- исключение одного или более;
- количественные изменения;
- замена действующего вещества на его солевое или изомерное производное с тем же самым терапевтическим эффектом;
- замена изомеров и их смесей;
- замена вещества, выделенного из естественных источников или полученного биотехнологическим путем, веществом или продуктом с другой химической структурой;
- новый носитель для радиоактивных ЛС.
2. Изменения терапевтических показаний:
- добавление показаний в другой терапевтической области;
- изменение показаний в другой терапевтической области.
3. Изменения дозирования, лекарственной формы и способа применения:
- изменения биодоступности;
- изменения фармакокинетики;
- изменения дозировки ЛС;
- изменение или добавление лекарственной формы;
- изменение или добавление нового пути введения.
Действия производителя, подчеркнула О. Баула, сегодня строго регламентированы нормативными документами МЗ, которые скоро будут подкреплены на законодательном уровне. То же касается и регуляторных органов, процедуры которых сегодня понятны, прозрачны и открыты: правила игры едины для всех. «На сегодня ГФЦ выступает одной из сторон в 18 или более судебных процессах, и это нормально: когда есть предмет спора, его можно разрешить, — такое не совсем обычное заявление сделала О. Баула. — Бывает, что в этих спорах мы оказываемся победившей стороной, бывает, наоборот…, но в любом случае это — нормальное явление, которое входит в повседневную практику».
Самые лабильные аспекты качества и безопасности ЛС связаны с его фармацевтическими свойствами. Но вместе с тем все они доступны измерению и оценке и потому нуждаются в тщательной стандартизации на этапе фармразработки, когда надо четко зафиксировать диапазоны изменений всех важных параметров. Результаты последующих доклинических и клинических исследований будут относиться только к тем ЛС, для которых соблюдены заложенные изначально требования.
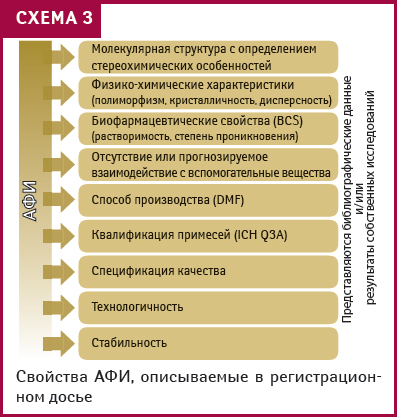
И фармразработка, и последующие этапы жизненного цикла препарата завязаны на АФИ, которых касаются до 90% замечаний, возникающих у ГФЦ при работе с заявителями (схема 3). Об АФИ нужно знать все, — напомнила О. Баула, отметив, что стереохимические особенности серьезнейшим образом меняют механизм действия. «Это азбучная истина, но когда мы сталкиваемся на практике с регистрационными досье (в которых эти данные отсутствуют — прим. ред.), нам говорят: «Это не важно. Мы доказали наличие функциональных групп, но как они расположены — узнать слишком сложно». И это при том, что существуют такие методы, как ядерно-магнитный резонанс, масс-спектрометрия, высокоэффективная жидкостная хроматография с использованием хиральных колонок», — с сожалением отметила докладчик. Также мало внимания разработчики обращают на физико-химические свойства ЛС. Между тем полиморфизм свойственен практически каждому из АФИ, что серьезно отражается на их свойствах. То же касается формы кристаллических структур, образуемых лабильными молекулами, причем метастабильная форма обеспечивает повышенную биодоступность. Существенно изменить фармакологические свойства, следовательно, и безопасность, может и другая степень дисперсности АФИ. Большой шаг вперед — введение в законодательное поле 4 классов субстанций в зависимости от биофармацевтических свойств.
Особое внимание заявители должны обращать на квалификацию примесей, использовать жесткие предельные показатели. Без описания всего спектра примесей, когда в регистрационных материалах описана их сумма, заявление о регистрации не может быть принято, подчеркнула О. Баула.
При составлении профиля примесей следует исходить из стадий технологического процесса. То же касается спецификации АФИ в целом. Ее составляет производитель готового ЛС и включает в контракт с поставщиком АФИ. На зарубежных предприятиях, рассказала докладчик, и мысли не допускают, что может быть иначе, еще бы: «Если мы напишем в контракте «белый порошок», то компаньоны его и пришлют», — считают там.
Очень серьезно следует относиться к соблюдению требований фармакопей, которые сейчас обновляются уже не раз в 5 лет, а практически ежегодно. Если действующее вещество описано в фармакопее, надо пользоваться этим, но с одним условием: монография любой фармакопеи привязана к технологическому процессу, она не является абстрактной. Поэтому нужно подтверждение, что фармакопейная статья пригодна в каждом конкретном случае, что подтверждается:
- сертификатом соответствия монографии Европейской Фармакопеи;
- подробным описанием производства АФИ;
- предоставлением мастер-файла препарата (drug master file — DMF).
В составлении спецификаций на АФИ есть несколько путей, которые можно проследить, пользуясь алгоритмом выбора, принятым ICH. Самый простой и самый надежный — полагаться на сертификат соответствия фармакопее, выданный Европейским директоратом качества лекарственных средств и медицинской помощи (The European Directorate for the Quality of Medicines&HealthCare). Производителям О. Баула советует работать с поставщиками, которые участвуют в процедуре сертификации соответствия.
Многих пугает, отметила О. Баула, перспектива предоставления информации о способе производства из DMF. Этот документ, сопровождающий приобретаемую субстанцию, дает информацию о той же молекулярной структуре, других физико-химических свойствах. Как предоставляется DMF? Этот документ разделен на 2 части, одна из которых — открытая (обычно ее бывает достаточно), доступная производителю готового ЛС, а другая — конфиденциальная, предоставляемая производителем субстанции напрямую в регуляторное агентство.
Влияние на безопасность и эффективность препаратов находящихся в их составе вспомогательных веществ необходимо обосновать в соответствии с функциями, выполняемыми последними. К сожалению, в Украине нет утвержденных требований к вспомогательным веществам и их максимальному содержанию. Эксперты могут только давать рекомендации, ориентируясь при этом на позицию других регуляторных органов. В качестве примера О. Баула привела некоторые рекомендации Управления по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration):
- ртутьсодержащие консерванты используют только при отсутствии альтернативы им (например в препаратах для применения в офтальмологии);
- бензиловый спирт не включают в состав готовых ЛС, применяемых у детей в возрасте младше 2 лет;
- парагидроксибензоат и его производные не используют в готовых ЛС для парентерального применения;
- этиловый спирт включают со строго лимитированной концентрацией:
— 0,5% р-р спирта допускается в готовых ЛС для детей младше 6 лет;
— 5% р-р спирта — от 6 до 12 лет;
— 10% р-р спирта — старше 12 лет.
Очень ответственно следует подходить к выбору материала для упаковки, отметила докладчик. Обычно первичную упаковку изготавливают из многофункциональных полимеров, вступающих в свободнорадикальные и окислительные реакции. Алюминиевую же фольгу для этой цели используют все реже.
Таким же научно обоснованным должен быть выбор лекарственной формы, который следует подтверждать экспериментальными данными на этапе фармацевтической разработки. Эмпирический выбор лекарственной формы или ее произвольная замена не допускается!
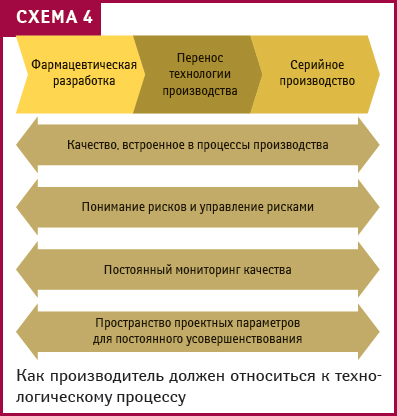
Однако все затраты производителя будут нивелированы, если знания о свойствах ЛС перенести с малого объема серий на все производство: тот же самый препарат не будет получен. Поэтому размер опытно-промышленной серии должен составлять 1/10 промышленной серии или быть равным последней (если она составляет <100 000 единиц)). Исследования эффективности и безопасности можно начинать, только убедившись, что перенос этот возможен.
Для большинства производителей, представляющих препараты на нашем рынке, проведение дорогостоящих доклинических и клинических испытаний обычно вообще не актуально, так как выпускают они генерические ЛС, и от них требуется только подтверждение эквивалентности их препарата оригинальному, на основании чего свойства последнего автоматически присваиваются генерику. При этом все эксперты сходятся во мнении, отметила О. Баула, что при использовании субстанции, полученной не тем способом, что у оригинального ЛС, получится не генерик, а другой препарат, с другим профилем эффективности и безопасности.
Подытожив изложенное в докладе, О. Баула отметила следующие нерешенные проблемы и перспективы:
- углубление процессов гармонизации в сфере регулирования ЛС с европейскими и международными требованиями;
- внедрение надлежащей регуляторной практики как неотъемлемого элемента системы управления качеством ЛС;
- осуществление координации и согласованности действий между регуляторными структурами;
- переориентация регуляторных функций с осуществления надзора за соответствием на применение подходов по оценке и минимизации рисков;
- усовершенствование практики инспектирования производственных участков и организаций, проводящих доклинические и клинические исследования;
- усиление кадрового потенциала.
Один из пунктов, а именно «переориентация регуляторных функций с осуществления надзора за соответствием…» требует пояснений. Пагубность такого подхода докладчик проиллюстрировала примерами, которые, по ее словам, свидетельствуют о крушении принципов, на которых базировались регуляторные системы. Так, один весьма резонансный случай произошел в Евросоюзе в 2007 г., когда выяснилось, что два регуляторных органа — Швейцарское агентство по лекарственным средствам (Swissmedic) и Европейское агентство по лекарственным средствам (European Medicines Agency) — на протяжении нескольких лет не препятствовали нахождению на рынке препарата нелфинавира, контаминированного по вине производителя генотоксическим веществом (этилмезилатом). В результате более 30 тыс. пациентов подверглись воздействию этого потенциально опасного соединения. Ошибка регуляторных органов — контроль качества препарата по параметрам, установленным самим производителем. Еще более грозное предупреждение, связанное с гибелью около 200 людей, регуляторы ЕС, США и других стран получили в 2008 г. Трагедии можно было избежать, если бы регуляторные органы не ограничивались проверками соответствия препарата спецификациям производителя. На этот раз препарат (гепарина сульфат) был родом из Китая, а упомянутый выше нелфинавир — из Швейцарии, и это в который раз подтверждает, что ни у АФИ, ни у готовых ЛС нет национальности, подчеркнула О. Баула.
Вообще контроль качества субстанций со стороны не только призводителя, но и регуляторного органа — прогрессивный подход, о введении которого, отметила докладчик, все больше задумываются на Западе. Поэтому регистрация субстанций — скорее, позитивный момент отечественной регуляторной сферы, чем недостаток.
Сместить акценты с ЛС как таковых на пациентов, которые их принимают, — к этому призвала Ш. Пал. Пусть главным вопросом будет не «насколько безопасен тот или иной препарат », а «в безопасности ли пациент, принимающий данные ЛС ».
Исходя из того, что 50% побочных реакций (ПР) — предотвращаемые, ВОЗ осуществляет пилотный проект «Безопасность пациента — фармакологический надзор». Ш. Пал рассказала и о новых web-инструментах ВОЗ: VigiFlow — для передачи данных о ПР; CEMFlow — для управления данными и PaniFlow — для обработки данных о ПР при пандемическом гриппе.
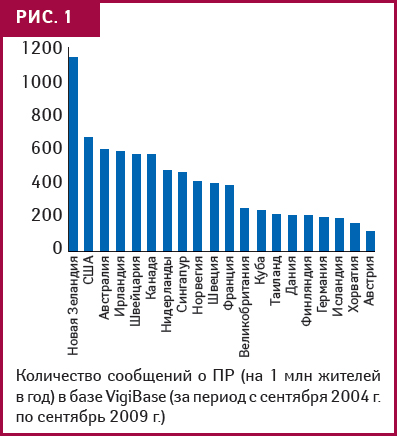
Единственной глобальной базой данных о ПР ЛС разного происхождения была и остается VigiBase. Серьезным недостатком этой базы является региональный дисбаланс по источникам поступления сообщений (рис. 1; среднее за 5 лет количество сообщений в Украине не позволило отобразить этот показатель на рисунке, но уровень подачи сообщений последних лет — около 150 на 1 млн населения, вполне достойный на общем фоне). Исключительно спонтанная отчетность — тоже недостаток VigiBase, и до недавнего времени украинская база данных содержала только такую информацию.
 |
| Елена Матвеева |
В Украине за последние год-два принят ряд нормативно-правовых документов, на основании которых будет осуществляться мониторинг эффективности и безопасности ЛС в стационарах — ретроспективный и проспективный анализ и сбор демографических, социальных и медицинских данных всех поступающих пациентов с целью активного выявления всех ПР. Об организации этой работы рассказала Елена Матвеева, начальник Управления послерегистрационного надзора ГФЦ МЗ Украины. Мониторинг и анализ полученных при его осуществлении данных будут проводиться с привлечением клинических провизоров (или ответственных лиц с высшим фармацевтическим образованием) при помощи программного обеспечения. Информацию, полученную при мониторинге, руководители лечебно-профилактических учреждений (ЛПУ) должны своевременно предоставлять в ГФЦ МЗ Украины для последующей передачи непосредственно в МЗ Украины.
Мониторинг предусматривает два этапа экспертизы фармакотерапевтических назначений (первичная — не позднее 48 ч с момента госпитализации и заключительная — не позднее 48 ч с момента выписки), что подтверждается записью в «Медицинской карте стационарного больного».
Соответственно, в базу мониторинга вводят данные относительно фармакотерапевтических назначений, ПР и отсутствии эффективности ЛС. Клинический провизор (или уполномоченное лицо) анализирует результаты мониторинга и предоставляет его данные руководителю ЛПУ ежемесячно.
Возможны следующие направления анализа данных мониторинга применения ЛС в стационаре:
- фармакоэпидемиологическая оценка ЛС;
- АВС-анализ;
- VEN-анализ;
- анализ «затраты/эффективность» (по торговым наименованиям ЛС).
VEN-анализ предусматривает разделение ЛС на три группы:
- жизненно важные (Vital);
- необходимые (Essential);
- второстепенные (Non-Essential).
При АВС-анализе ЛС делят на другие три группы:
- класс А: 10–20% препаратов, на которые тратят 75–80% «лекарственного» бюджета стационара;
- класс В: 10–20% препаратов, на которые тратят 15–20% бюджета;
- класс С: 60–80% препаратов, на которые тратят 5–10% бюджета.
Сопоставление результатов двух вышеупомянутых видов анализа дает представление о том, на какие ЛС (жизненно важные, необходимые или второстепенные) ЛПУ расходуют бюджетные средства. Как отметила Е. Матвеева, результаты АВС-/VEN-анализа, проведенного в российских и украинских больницах, свидетельствуют об относительно больших затратах на второстепенные ЛС.
Проведение анализа «затраты/эффективность» предусматривает определение соотношения затрат на ЛС (прямых и непрямых) и неценового показателя эффективности, к примеру величины снижения артериального давления, уменьшения количества случаев смертности или, напротив, излечения.
Заключительный этап анализа данных мониторинга, отметила докладчик, заключается в сопоставлении данных всех трех видов анализа: АВС, VEN и стоимость/эффективность. Результаты отражаются в отчете в виде перечня ЛС, разделенных на группы, исходя из критериев эффективность/безопасность/стоимость:
- ЛС, которые следует использовать в ЛПУ;
- ЛС, которые могут быть рекомендованы к использованию при условии коррекции затрат;
- ЛС, которые могут быть рекомендованы специалистами ЛПУ при наличии четкого обоснования;
- ЛС, которые следует исключить или максимально ограничить их применение.
Такой анализ позволит адекватно и всесторонне оценить ЛС, используемые для фармакотерапии в стационаре, а также принять адекватное решение относительно целесообразности дальнейшего применения тех или иных ЛС.
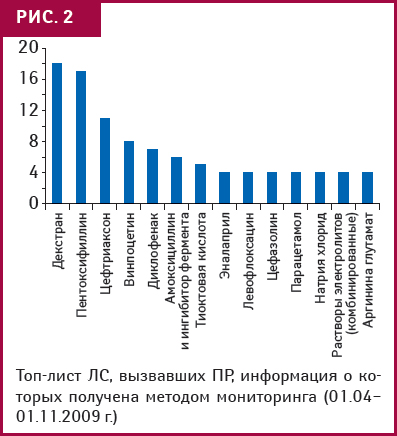
Первые результаты мониторинга можно оценить на основании данных пилотного проекта, организованного по поручению МЗ Украины в Житомирской обл. За период исследования (с 01.04.2009 по 01.11.2009 г.) количество карт- сообщений увеличилось втрое, причем 88% из них получены в результате мониторинга. Среди системных проявлений ПР ЛС лидировали аллергия (24%), изменения со стороны кожи и производных (22%) и со стороны ЖКТ (16%). Среди препаратов, чаще других вызывавших ПР, — декстран, пентоксифиллин, цефтриаксон, винпоцетин и диклофенак (рис. 2).
В ходе мониторинга был выявлен ряд проблем, на основании которых разработаны следующие рекомендации:
- ответственному за мониторинг следует регулярно, с определенной периодичностью опрашивать врачей о случаях ПР ЛС;
- заведующим отделениями и ответственным лицам необходимо контролировать внесение данных о ПР ЛС в первичную медицинскую документацию;
- врачам следует помнить о необходимости заполнения всех полей в картах-сообщениях;
- нужно формировать мнение у руководителей здравоохранения о важности и необходимости мониторинга эффективности и безопасности ПР ЛС.
 |
| А. Степаненко |
 |
| Виктор Чумак |
Служба фармаконадзора ГФЦ будет принимать участие во внедрении формулярной системы в Украине путем привлечения региональной службы, связанной с учреждениями практического здравоохранения. Без стандартизации оказания медицинской помощи мы никогда не построим страховую медицину, отметил в своем пленарном докладе Виктор Чумак, директор ГФЦ МЗ Украины, уточнив, что для ее функционирования нужны документы трех уровней: руководства по оказанию медицинской помощи (отвечают на вопрос «что »), стандарты оказания медицинской помощи (отвечают на вопрос «как ») и клинические протоколы («чем »).
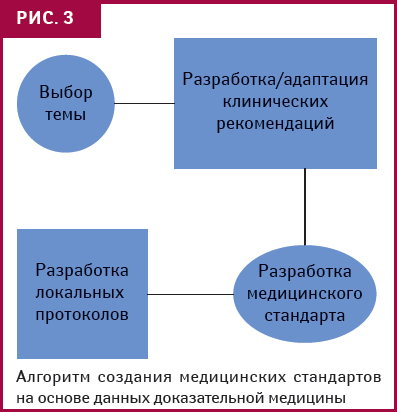
О современной методологической основе разработки руководств и стандартов рассказала профессор Алла Степаненко, руководитель проекта «Поддержка развития системы медицинских стандартов в Украине». Медико-технологические документы (стандарты, клинические протоколы) создаются на основе принципов доказательной медицины, при этом в качестве источников информации выступают клинические рекомендации (рис. 3).
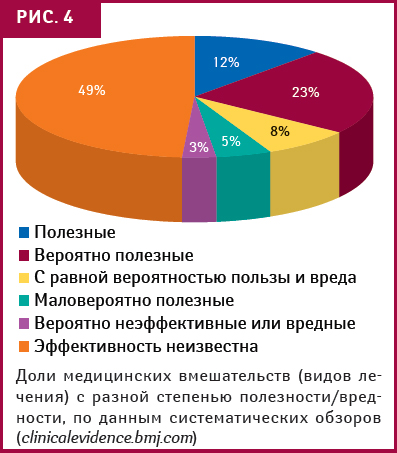
Ситуация с доказанностью эффективности различных лечебных вмешательств непроста, отметила докладчик. По данным одного из самых авторитетных в мире источников данных для принятия информированных решений в медицине, «Clinical Evidence», из 2500 видов медицинских вмешательств 12% отнесены к полезным (beneficial), 23% — вероятно полезным (likely to be beneficial), 8% — с равной вероятностью пользы и вреда (trade-off between benefits аnd harms), 5% — маловероятно полезным (unlikely to be beneficial), 3% — вероятно неэффективным или вредным (likely to be uneffective or harmful) и 49% — с неизвестной эффективностью (unknown effectiveness) (рис. 4).
 |
| А. Морозов |
В числе значимых результатов работы проекта А. Степаненко назвала утверждение методики разработки медико-технологических документов (приказами МЗ и АМН Украины от 19.02.2009 г. № 102/18 и 03.11.2009 г. № 798/75 (часть II)).
В 2009 г. был разработан и утвержден первый Государственный формуляр лекарственных средств. Кроме Государственного формуляра, рассказал Анатолий Морозов, первый заместитель директора ГФЦ МЗ Украины, в медицинскую практику будут внедрены формуляры еще 2 уровней: региональные и локальные, создаваемые на основе государственного. Для разработки и постоянного обновления государственного формуляра и внедрения формулярной системы, отметил А. Морозов, при МЗ Украины (на базе ГФЦ МЗ Украины) создан постоянно действующий Центральный формулярный комитет, при МЗ АР Крым, областных и городских (Киева и Севастополя) управлениях здравоохранения создаются региональные формулярные комитеты, а непосредственно в учреждениях здравоохранения — фармакотерапевтические комиссии, которые будут обеспечивать разработку региональных и локальных формуляров ЛПУ соответственно.
В состав фармакотерапевтической комиссии учреждения здравоохранения входят заместитель руководителя учреждения здравоохранения по медицинской части и клинический провизор (в случае его отсутствия — лицо с высшим медицинским или фармацевтическим образованием, на которое возложено осуществление мониторинга ЛС в стационаре), а также руководители медицинских отделений.
Рационализировать потребление ЛС призван также целый ряд документов, регулирующих порядок обеспечения фармацевтической помощи: как отметил В. Чумак, для того чтобы аптеки стали учреждениями здравоохранения, нужно разработать два с лишним десятка стандартов фармацевтической помощи.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим