|
|
Михаил Пасечник, президент АФПУ, поприветствовал участников семинара и пожелал им плодотворной работы. Также с приветственным словом выступила Людмила Безпалько, генеральный директор ЗАО НПЦ «Борщаговский химико-фармацевтический завод». Она рассказала об истории предприятия и отметила преобразования последних лет, связанные с внедрением европейских стандартов производства. Л. Безпалько подчеркнула роль АФПУ в объединении усилий отечественных производителей лекарственных средств во внедрении необходимых прогрессивных изменений в процессе интеграции Украины в ЕС и мировое сообщество. Елена Алексеева, директор АФПУ, отметила, что совещание-семинар предоставляет прекрасную возможность получить самые современные сведения об организации фармаконадзора «из первых рук» — от ведущих отечественных экспертов со стороны ГФЦ и от специалистов передовых отечественных предприятий.
Выступая с обзором «Фармаконадзор в Украине», Владимир Мальцев, профессор, заслуженный врач Украины, руководитель отдела координации и контроля клинических испытаний лекарственных средств ГФЦ, отметил, что Украина была первой в создании современной системы фармаконадзора среди стран бывшего СССР и сейчас опережает их по уровню развития этой системы. Вместе с тем, на пути гармонизации с европейскими и международными нормами существуют и препятствия, трудности, которые пока не удалось преодолеть.
Согласно Директиве 2001/83/ЕС Европейского парламента и Совета ЕС от 08.07.2004 г., система фармакологического надзора — это государственная система сбора данных, которая на основании полученной информации о побочных реакциях (ПР) на препараты в условиях их обычного применения обеспечивает принятие соответствующих регуляторных решений в отношении лицензированных в Сообществе ЛС. Уже 10 лет прошло с тех пор, как в Украине был организован Центр побочного действия лекарственных средств в составе ГФЦ (с 1999 г. действует отдел фармакологического надзора). С 2002 г. Украина является членом Международной программы по мониторингу лекарственных средств (Drug Monitoring Programme).
На сегодня отечественная нормативная база по организации фармаконадзора состоит из ряда приказов МЗ Украины, один из которых, «Об утверждении Порядка осуществления надзора за побочными реакциями лекарственных средств, разрешенных к медицинскому применению», окончательно еще не утвержден (табл. 1).
| Таблица 1 | ||||||||||
| Состояние отечественной нормативной базы по организации фармаконадзора | ||||||||||
|
Согласно вышеупомянутому проекту, со вступлением его в действие приказы МЗ № 347, № 51 и № 292 теряют силу. Какие изменения в порядке фармаконадзора предусмотрены проектом нового приказа? Для врача важно следующее:
- усовершенствованы форма (137/0) и порядок предоставления информации о ПР ЛС;
- конкретизированы действия врача при развитии ПР, следствием которой стала смерть пациента;
- детализирована взаимосвязь между врачом, администрацией лечебно-профилактического учреждения (ЛПУ) и Государственной инспекцией по контролю качества лекарственных средств в случае развития серьезных ПР ЛС.
По сравнению с ранее существовавшим новый Порядок обладает преимуществами, важными для производителя ЛС:
- гармонизированы требования к системе фармаконадзора в Украине с европейскими нормами;
- усовершенствованы форма, порядок и сроки предоставления сообщений о ПР ЛС производителем или его представителем;
- утвержден порядок обмена и предоставления данных о ПР ЛС между производителем ЛС и регуляторными органами;
- предложена форма отчетов о безопасности применения ЛС в пострегистрационный период (PSUR), а также порядок и периодичность их подачи;
- указаны ситуации, в которых целесообразно проведение исследований профиля безопасности ЛС в пострегистрационный период, а также порядок их проведения;
- представлен алгоритм принятия регуляторных решений, принимаемых на основании экспертной оценки данных о безопасности применения препарата в соответствии с международной практикой.
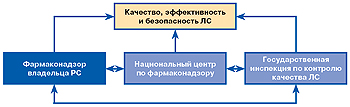
| Рис. 1. Структура мониторинга ПР ЛС в Украине | Рис. 2. Основные составляющие системы обеспечения качества, эффективности и безопасности ЛС |
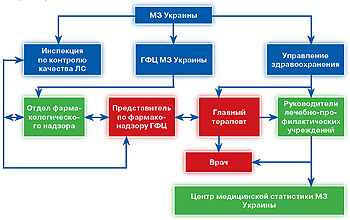 |  |
В системе мониторинга ПР ЛС большое значение имеет деятельность Государственной инспекции по контролю качества лекарственных средств, ГФЦ и управлений здравоохранения (рис. 1). Соответствующим приказом МЗ, отметил профессор В. Мальцев, удалось закрепить положение, согласно которому в этой работе должны активно участвовать лечебно-профилактические учреждения с координацией через главных терапевтов. Таким образом, в настоящее время функционируют два пути поступления информации о ПР в МЗ: через систему спонтанных сообщений от врачей и посредством отчетов о случаях ПР ЛС по форме № 69-здоров от ЛПУ. Как отметил докладчик, в Украине нет ни одной области, где бы не было регионального отделения ГФЦ по фармаконадзору. Пока взаимодействие этих отделений со специалистами предприятий должным образом не налажено, и это — дело ближайшего будущего. Как негативную тенденцию В. Мальцев обозначил уменьшение за последние 6 мес количества поступающих в ГФЦ спонтанных сообщений после непрерывного увеличения в 2002–2005 гг. и сравнительно низкую активность работы в Западном регионе: Ровенской, Закарпатской и Волынской областях.
| Таблица 2 | |||||||||||||||||||||||||||||
| Типы ПР, зарегистрированные в Украине (2003–2005) | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
В Украине, как и в большинстве стран с развитой экономикой, качество, эффективность и безопасность ЛС обеспечивает, прежде всего, владелец регистрационного свидетельства (РС), а также уполномоченные органы, которые выполняют экспертные и контролирующие функции (рис. 2). Национальные центры по фармаконадзору оперируют данными, полученными благодаря системе спонтанных сообщений, отчетам производителей и некоторых других источников. Государственная инспекция делает заключение о качестве ЛС путем установления соответствия качественного и количественного состава ЛС, заявленному в РС.
В структуре ПР ЛС в Украине преобладают несерьезные предвиденные, непредвиденные ПР отмечают редко. Это связано с тем, отметил В. Мальцев, что среди применяемых ЛС преобладают генерические, профиль безопасности которых, как правило, хорошо изучен (табл. 2).
Чаще всего ПР ЛС отмечают при артериальной гипертензии, реже — при пневмонии (примерно в 2,5 раза), ОРВИ, пептической язве, гепатитах, остеоартрите, нефрологических заболеваниях, ревматоидном артрите. Противомикробные ЛС чаще других вызывают ПР (28,3% за 1996–2005 гг.). Примерно пятая часть случаев (19,4%) за тот же период приходится на ЛС, влияющие на сердечно-сосудистую систему; 13,4% — нервную; 10,3% — пищеварительную; 8,9% — систему крови и гемопоэз. Сбор сведений о ПР ЛС позволил принять в отношении некоторых из них решения об ограничении обращения или медицинского применения (табл. 3).
| Таблица 3 | ||||||||||||||
| Некоторые группы или отдельные ЛС, относительно обращения или медицинского применения которых в Украине приняты соответствующие регуляторные решения ГФЦ МЗ Украины | ||||||||||||||
|
Внутренняя система фармаконадзора производителя/владельца РС должна быть создана на каждом предприятии. Необходимо:
- иметь сотрудника или штат сотрудников, отвечающих за фармаконадзор, которые:
- имеют опыт работы в области фармаконадзора (подготовку);
- имеют медицинское образование или возможность обратиться к такому лицу;
- гарантировать, что информация о ПР, которая поступает персоналу производителя/владельца РС и агентам по продаже ЛС, будет обрабатываться и станет доступной регуляторному органу.
Работа по фармаконадзору производителя/владельца РС включает:
- отправление отчетов о случаях ПР (спонтанные сообщения);
- подготовку регулярно обновляемых PSUR (в 2005 г. производителями в ГФЦ МЗ Украины предоставлено 89 PSUR, из них 53 — от отечественных производителей);
- пострегистрационные исследования, финансируемые производителем/владельцем РС.
С целью идентификации проблем, связанных с безопасностью применения ЛС, ранее не являвшихся очевидными, и исследования возможного риска для пациента производители проводят клинические исследования (КИ) по безопасности. Они полностью или частично финансируются фармацевтическими компаниями, при этом ЛС применяют в условиях обычной медицинской практики (амбулаторно или в стационаре). В процессе организации исследования необходимо обсудить проект его протокола с регуляторными органами и независимыми экспертами (согласно национальным требованиям). Спонсор сообщает о начале КИ и предоставляет краткие отчеты через 6 мес или по запросу, а по завершении предоставляет отчет. Такие исследования используют для подтверждения предполагаемого профиля безопасности ЛС в условиях реализации, определения количества установленных ПР и идентификации факторов риска.
КИ по безопасности особенно важны в отношении препаратов, профиль эффективности которых недостаточно хорошо изучен. Это характерно для таких случаев:
- ЛС с новой химической структурой или механизмом действия;
- ЛС, имеющих высокоспецифическую область применения, что обусловливает необходимость наблюдения специалиста;
- если существуют:
- неопределенность относительно токсического эффекта у животных, клинической значимости ЛС или профиля безопасности;
- необходимость более точно определить количество ПР, выявленных во время ранее проведенных испытаний, и изучить факторы риска.
В настоящее время, отметил В. Мальцев, для отечественных производителей, многие из которых модернизировали производство, получили сертификаты GMP, внедрение применяющихся во всем мире правил фармаконадзора крайне актуально, поскольку без детальных сведений о препаратах владельцы РС не смогут выходить на рынки других стран. ГФЦ с марта 2001 г. было проведено 22 обучающих семинара с производителями, областными терапевтами и врачами регионов Украины. Всего в таких мероприятиях по вопросам организации фармаконадзора в Украине приняли участие более 2000 специалистов.
В ближайших выпусках будут представлены прозвучавшие на совещании-семинаре доклады Алексея Викторова, заведующего отделом фармакологического надзора ГФЦ, Елены Матвеевой, руководителя группы организации пострегистрационного надзора ГФЦ, и специалистов по фармаконадзору украинских фармацевтических предприятий. n
Пресс-служба «Еженедельника АПТЕКА», фото Игоря Кривинского


Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим