R&D СЕГОДНЯ
С каждым годом количество молекул на поздних стадиях R&D увеличивается — в основном за счет препаратов для лечения орфанных и хронических заболеваний, узкоспециализированных методов лечения. В период 2013–2018 гг. CAGR* составил 7%. В настоящее время на поздних стадиях клинических исследований находится почти 3 тыс. молекул. Наиболее емкой сферой является онкология с более 800 проектами в разработке (рис. 1).
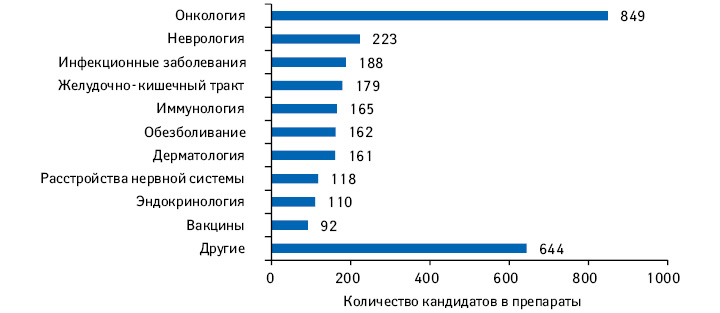
Стоит отметить, что за последние 3 года (2015–2018 гг.) количество разработок биотерапевтических препаратов нового поколения (таких как клеточная и генная терапия) увеличилось более чем в 2 раза, однако в общем объеме R&D доля таковых пока составляет менее 10%.
Также важно подчеркнуть, что на сегодня уже более 70% всех разработок принадлежат инновационным биофармацевтическим компаниям (emerging biopharma companies — EBP)*** (рис. 2).
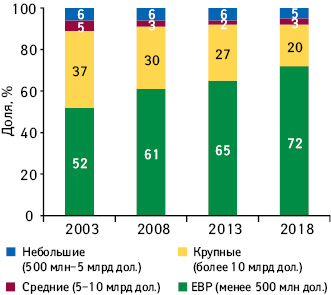
Поскольку R&D-деятельность фармацевтических и биотехнологических компаний сосредоточена в большей степени на создании принципиально новых методов лечения, а также препаратов для лечения редких или хронических заболеваний, это находит отражение и в структуре лончей. Так, по итогам 2018 г. Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) одобрило 59 новых активных субстанций (new active substance — NAS), побив рекорд предыдущего года. Практически половине из них присвоен статус орфанного. Около трети определены как первые в своем классе. 39 из 59 относятся к группе specialty medicines. 12 из 59 предназначены для применения в предиктивно-превентивной медицине. Создателями почти ⅔ лончей 2018 г. являются EBP, однако впоследствии права на некоторые из них вскоре после лонча выкуплены крупными фармкомпаниями.
БУДУЩЕЕ R&D: ОСНОВНЫЕ ДРАЙВЕРЫ
Аналитики IQVIA выделяют 8 ключевых трендов, которые, как ожидается, окажут сильное влияние на сферу проведения клинических исследований в ближайшей перспективе.
Развитие цифровых технологий, позволяющих собирать данные удаленно. Цифровые технологии (включая мобильные приложения для здравоохранения (mHealth), носимые датчики, решения в области телемедицины), находят применение и в клинических исследованиях.
Так, датчики могут использоваться для фиксирования показателей здоровья в реальной ситуации в режиме реального времени, а мобильные приложения и другие девайсы могут собирать и передавать информацию, полученную непосредственно от пациента (путем электронного анкетирования).
Благодаря возможностям телемедицины при помощи мобильного телефона и видеосвязи клиническая оценка может осуществляться удаленно (как виртуальный визит).
Кроме того, применение цифровых технологий может благоприятно повлиять на вовлеченность пациентов и их приверженность к лечению (например за счет напоминаний).
Применение технологий digital health может быть направлено на:
- сбор информации об эффективности и безопасности препарата в реальной жизни. Например, применение у пациентов с неврологическими заболеваниями цифровых маркеров (отслеживание движений, почерка, речи, и т.п.) добавляет новые критерии оценивания, связанные с клинической пользой в реальной жизни;
- получение данных с оценками результатов, фиксируемых самими пациентами при помощи цифровой анкеты;
- повышение безопасности субъектов клинических исследований. Благодаря тому, что данные передаются практически в реальном времени, участники исследования могут получить быструю врачебную помощь в случае неблагоприятного изменения состояния здоровья;
- повышение удобства участия пациентов в клинических исследованиях (в частности благодаря тому, что пациент может осуществлять виртуальные визиты и заполнять анкеты удаленно);
- снижение нагрузки на исследовательский центр и кадровые ресурсы, а также затрат на проведение клинических исследований, ведь цифровые технологии позволяют собирать данные пассивно из многочисленных источников и объединять их в централизованном узле хранения и обработки данных.
Использование реальных данных (Real-World Data — RWD). Разнообразные источники данных (включая электронные медицинские карты, медицинские отчеты, реестры заболеваний) могут использоваться в рамках поддержки клинических исследований с участием определенных групп населения. Это важно для лучшего понимания того, как пациенты реагируют на препараты за пределами контролируемых клинических исследований или как результаты лечения могут варьировать среди различных групп населения.
В клинических исследованиях RWD могут применяться также с целью оптимизации дизайна исследований.
Сбор информации непосредственно от пациентов путем анкетирования. Это позволит лучше учитывать опыт пациентов относительно того, как лечение влияет на их благополучие и качество жизни. Оценивание результативности лечения с точки зрения восприятия самим пациентом может помочь получить более целостную картину об эффективности и безопасности препарата. Ожидается, что результаты, сообщаемые самими пациентами, будут иметь большой вес при принятии решения об одобрении.
Изменения в регуляторном поле, направленные на внедрение подходов индивидуализированной медицины, новых схем исследований и критериев оценки. Например, Закон о лечении XXI века (21st Century Cures Act) в США предусматривал многочисленные изменения, способствующие, в частности, признанию разнообразных подходов к разработке, использованию RWD, технологий цифрового здравоохранения, ведения электронных записей.
Применение прогнозной (предсказательной) аналитики и искусственного интеллекта. Поскольку современные технологии позволяют собирать, отфильтровывать и анализировать огромные массивы данных, это может быть использовано для выдвижения новых гипотез для клинических исследований, прогнозирования будущих результатов, построения моделей для распознавания и выявления связей.
Технологии прогнозной аналитики и искусственного интеллекта также могут идентифицировать среди распространенных патологических состояний подгруппы, к которым может применяться таргетная терапия.
Повышенный интерес к разработке препаратов для таргетной терапии, а также биотерапевтических препаратов следующего поколения. Достижения фундаментальных наук, а также лучшее понимание биологических процессов и развития заболеваний позволяют разрабатывать препараты, воздействующие на конкретные молекулярные мишени. В частности, как ожидается, эти перемены приведут к радикальному изменению стандартов лечения в отношении большинства типов опухолей, а также улучшению качества жизни пациентов с онкологическими заболеваниями. Так, благодаря появлению биотерапевтических препаратов нового поколения, а также раннему выявлению патологии, в стратегии лечения происходит сдвиг в сторону изменяющей течение заболевания терапии.
Использование биомаркеров. При помощи предиктивных биомаркеров можно выделять группы пациентов, которые с большей вероятностью будут поддаваться конкретному лечению. Более широкое использование тестов на биомаркеры в клинических исследованиях может повлиять на критерии отбора их участников, а также способствовать уменьшению размера выборки.
Использование баз, содержащих медицинские данные пациентов, согласившихся сделать эту информацию доступной. Они могут включать информацию об образе жизни, биомаркерах и медицинских состояниях, поведенческую и генетическую информацию, а также метаданные (возраст, пол и т.п.). Это помогает быстрее и эффективнее осуществлять набор субъектов исследований.
По прогнозам аналитиков, перечисленные тенденции в той или иной степени окажут благоприятное влияние на повышение продуктивности**** клинических исследований. Наиболее значимый вклад, как ожидается, сделает использование биомаркеров, а также баз данных пациентов — в частности благодаря уменьшению усилий на проведение исследований (рис. 3).
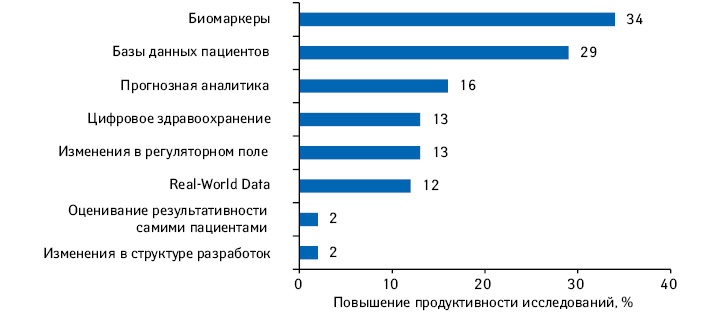
Как считают аналитики, каждый из перечисленных факторов влияния с высокой вероятностью реализует свое воздействие в полной мере в течение следующих 5 лет (рис. 4).
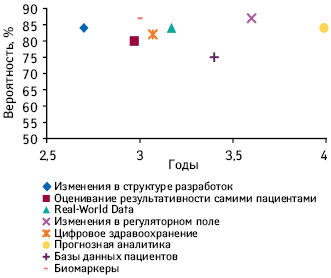
P.S.
Выведение на рынок нового препарата по-прежнему занимает много времени. Так, по оценкам компании IQVIA, в среднем для группы лончей 2018 г. потребовалось 13,6 года от подачи заявки на получение патента до одобрения (это все же на 2 года меньше по сравнению с группой лончей предыдущих 2 лет). Показатель успешного завершения клинических исследований (доля кандидатов, прошедших каждый этап исследований успешно) по итогам 2018 г. снизился до 11,4% (на протяжении последних 10 лет средний показатель находился на уровне 14%).
Роль EBP в создании новых препаратов возрастает. Именно инновационные биотехнологические компании активно занимаются разработками в таких сферах, как онкология и орфанные заболевания. Сегодня им принадлежит более половины разработок кандидатов в препараты.
Поскольку развитие науки, технологий, big data постепенно находит применение в сфере клинических исследований, актуальные тенденции в этих областях постепенно будут наращивать свой потенциал, оказывая благоприятное влияние на различные аспекты R&D.

 2018 г. стал рекордным по количеству одобренных в США новых активных субстанций, около трети из них определены как первые в своем классе. В структуре исследований и разработок (Research and Development — R&D) все больше заметно смещение фокуса в сторону препаратов для лечения орфанных и хронических заболеваний (specialty medicines). С каждым годом количество молекул на поздних стадиях R&D увеличивается, по оценкам аналитической компании IQVIA, именно за счет specialty medicines. По итогам 2018 г., на поздних стадиях клинических исследований находится почти 3 тыс. молекул. Кроме того, на дизайн, сложность и продолжительность, а также продуктивность клинических исследований в настоящее время влияет ряд тенденций, в том числе развитие технологий и использования данных. Предлагаем вниманию читателей обзор, посвященный актуальным тенденциям в сфере R&D, а также основным драйверам изменений, по материалам доклада «The Changing Landscape of Research and Development Innovation, Drivers of Change, and Evolution of Clinical Trial Productivity» компании IQVIA.
2018 г. стал рекордным по количеству одобренных в США новых активных субстанций, около трети из них определены как первые в своем классе. В структуре исследований и разработок (Research and Development — R&D) все больше заметно смещение фокуса в сторону препаратов для лечения орфанных и хронических заболеваний (specialty medicines). С каждым годом количество молекул на поздних стадиях R&D увеличивается, по оценкам аналитической компании IQVIA, именно за счет specialty medicines. По итогам 2018 г., на поздних стадиях клинических исследований находится почти 3 тыс. молекул. Кроме того, на дизайн, сложность и продолжительность, а также продуктивность клинических исследований в настоящее время влияет ряд тенденций, в том числе развитие технологий и использования данных. Предлагаем вниманию читателей обзор, посвященный актуальным тенденциям в сфере R&D, а также основным драйверам изменений, по материалам доклада «The Changing Landscape of Research and Development Innovation, Drivers of Change, and Evolution of Clinical Trial Productivity» компании IQVIA.
Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим