Результатом гармонізації законодавчо-нормативної сфери між ЄС/ЄЕС і Україною має стати досягнення відповідності у визначенні правил генеричної заміни (терапевтичної еквівалентності та взаємозамінності) поряд з уніфікацією термінів в уже наявних актах. Одночасно постануть у повний зріст проблеми обґрунтування перебування на ринку великої кількості раніше схвалених ліків. При цьому аналогічний польському варіант переходу на «нові рейки» в порівняно стислі терміни може бути неприйнятним, враховуючи затяжний період економічного занепаду. Тому може бути доречним виділити для початкового впровадження нових правил сегмент, що покривається реімбурсацією і державними закупівлями, а натомість забезпечити більшу передбачуваність і визначеність для постачальників. Аби досягти цього, можна впровадити тривалі контрактні взаємини із заздалегідь визначеними обсягами, цінами і термінами — підхід, який зараз випробують у США, зіткнувшись з неадекватністю правил вільного ринку завданням базового фармацевтичного забезпечення.
Роль доказів біоеквівалентності в Україні та Європі
Незважаючи на те, що відповідна термінологія (генерики, біоеквівалентність, фармацевтична/терапевтична еквівалентність, взаємозамінність) введена в окремі нормативно-правові акти нашої країни, між ними немає повної відповідності у формулюваннях, а головне — немає обов’язкової вимоги щодо біоеквівалентності/терапевтичної еквівалентності як умови взаємозамінності. В Україні, до того ж, відсутнє офіційне джерело з відповідними даними, якщо не брати до уваги початок публікації окремих звітів про клінічні та доклінічні дослідження на виконання частини 11 ст. 9 закону «Про лікарські засоби». Ця добірка, розміщена в розділі «Відкриті дані» сайту Міністерства охорони здоров’я, не оснащена пошуком і містить звіти, що надійшли не раніше серпня 2021 р. При цьому деякі з них супроводжуються номерами протоколів відповідних досліджень, включаючи зареєстровані в зарубіжних базах даних (EudraCT або ClinicalTrials.gov), інші — просто зазначенням країни проведення, навіть не клінічної бази. Різниця в підходах регуляторів помітна на прикладі поводження з препаратами, в оцінках біоеквівалентності яких виявлені невідповідності: у той час як Європейське агентство з лікарських засобів (European Medicines Agency — EMA) рекомендує відкликання ліків у разі ненадання альтернативних даних, в Україні здебільшого обмежуються рекомендацією щодо їх надання без будь-яких наслідків в іншому випадку. Наприклад, у січні 2015 р. з 1000 препаратів (з урахуванням дозувань і лікарських форм), дані яких щодо біоеквівалентності виявилися недостовірними, 300 залишили на ринку після надання альтернативних даних, а 700 тих, що залишилися, вирішено відкликати.
MCDA на підтримку рішень щодо закупівель
Конкурсні процедури закупівель і державна програма реімбурсації неможливі без опори на багатоджерельні (генеричні) препарати. Тим часом процедури залучення учасників у нашій країні переважно не передбачають надання доказів біоеквівалентності, без якої генерична заміна на будь-якому рівні (призначення, відпуск, споживання) неможлива. Також необхідні докази того, що імпортовані в Україну препарати, багато з яких реєструють за спрощеною процедурою, мають склад, аналогічний такому лікарських засобів з дозволом на маркетинг у ЄС. Оскільки відмінності в складі потенційно призводять до зміни, наприклад, профілів розчинності, можуть знадобитися докази біоеквівалентності. Опубліковані також дані про те, що на ринки країн з більш слабким регуляторним контролем, зокрема, індійські виробники, в тому числі провідні, поставляють продукцію більш низької якості (Bate R. et al., 2016).
Багаторічний відбір препаратів для закупівлі лише за ознакою найнижчої ціни викликає побоювання щодо потенційних проблем з якістю. До того ж, оскільки у платника, споживача, провайдера медичних послуг і постачальників можуть бути різні інтереси і способи їх реалізації, під час прийняття рішення про фінансування за рахунок громадських коштів доцільним є врахування декількох критеріїв. Один із способів структуризації відповідних процесів — мультикритеріальний аналіз прийняття рішень (Multiple criteria decision analysis — MCDA). Розроблений Міжнародним товариством фармакоекономічних досліджень (The International Society for Pharmacoeconomics and Outcomes Research — ISPOR), упродовж останніх років він адаптований до препаратів, що вийшли з-під патентного захисту.
MCDA — це структурування процесу оцінки і вибору альтернатив в умовах високої невизначеності і конфлікту інтересів шляхом об’єднання окремих критеріїв в одну загальну оцінку (Baran-Kooiker A. et al., 2018). Підхід MCDA поступово набирає обертів у рамках оцінки медичних технологій (ОМТ), і його елементи поступово впроваджують, особливо в процеси організації допомоги при рідкісних захворюваннях, по всій Європі (Schey C. et al., 2017; Wątróbski J. et al., 2019).
Таку методику обговорили й внесли в неї уточнення в ході семінару Міжнародного товариства (International Society for Pharmacoeconomics and Outcomes Research — ISPOR), що відбувся в Мілані в листопаді 2015 р. Так, виділено 22 пріоритетних критерії, придатних для адаптації країнами до процесів прийняття власних рішень (Brixner D. et al., 2017). Методика MCDA щодо непатентованих препаратів — «Simple Scoring» була представлена на форумі ISPOR у Сингапурі (вересень 2016 р.). За кілька років, які пройшли з моменту її появи, ряд країн провели власну роботу із впровадження. Невичерпний пошук дозволив знайти приклади Об’єднаних Арабських Еміратів, Катару та Індонезії, з якими буде корисно ознайомитися нашим читачам.
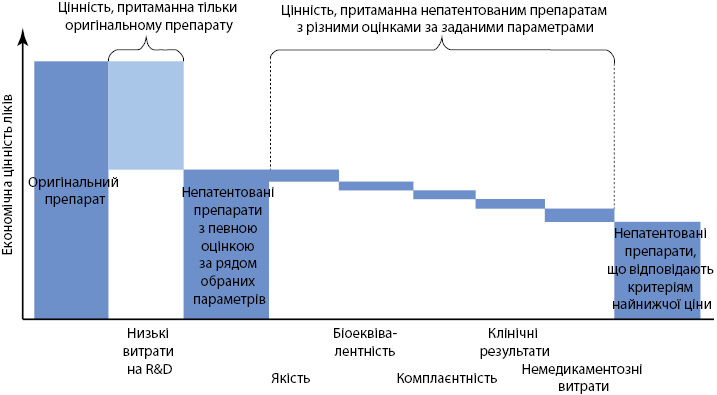
Як зазначено в одній зі статей «Value in Health» — офіційного журналу ISPOR, ефективність політики щодо непатентованих ліків часто оцінюють, виходячи тільки з динаміки цін і ринкових часток. У той же час необхідним є облік і таких факторів, як якість генериків, їх еквівалентність (з оригінальним препаратом і між собою), асортимент лікарських форм, надійність поставок, пов’язані з ними комплаєнтність, послуги з додатковою вартістю (підтримка та інформування пацієнтів), реальні результати щодо здоров’я і нефармацевтичні витрати (Kaló Z. et al., 2015). Ігнорування цих факторів може потенційно привести до погіршення медико-соціальної та економічної ефективності фармацевтичної політики. Навпаки, врахування їх дозволяє полегшити прийняття рішень на основі цінності в цьому важливому сегменті ринку (рисунок). Так, генеричні препарати можуть бути біоеквівалентними оригінальними, але не між собою, якщо їх параметри знаходяться в протилежних частинах інтервалу оцінюваних параметрів. Зміни в складі препаратів, кольорі, формі, розмірі таблеток, доступність різних лікарських форм можуть впливати на прихильність до лікування, особливо з боку осіб похилого віку, дітей, пацієнтів з психічними захворюваннями.
На віртуальний семінар, який відбувся в Дубаї в жовтні 2020 р., було запрошено експертів, що представляли державний і приватний сектори охорони здоров’я. Вони проголосували за включення різних критеріїв у список, ранжування їх і зважування (остаточні вагові коефіцієнти розраховувалися шляхом нормалізації суми ваги до 100%) (табл. 1). Перші чотири критерії, що відповідають за якість, будуть стимулювати виробників до отримання додаткових даних, наприклад, з обсерваційних досліджень або аналізу баз даних (Farghaly M.N. et al., 2021). Управління охорони здоров’я Дубаю (Dubai Health Authority — DHA) має намір зробити перший крок у визнанні поступових інновацій, гарантувавши ринкову винятковість, визнання справедливої цінової надбавки на основі конкретної системи вартості і прийняття недорогих методів збору фактичних даних (Petykó Z.I. et al., 2020).
| Таблиця 1 | Критерії, відібрані експертами ОАЕ для MCDA із зазначенням рангів і вагових коефіцієнтів (Farghaly M.N. et al., 2021) |
| Критерії | Ранг | Ваговий коефіцієнт, % |
| Реальні клінічні та економічні ефекти | 1 | 19,8 |
| Забезпечення якості під час виробництва | 2 | 17,3 |
| Еквівалентність до референтного продукту | 3 | 14,8 |
| Стабільність і склад | 4 | 12,3 |
| Ціна | 5 | 9,4 |
| Надійність поставок | 6 | 7,7 |
| Макроекономічна користь (локальні інвестиції) | 7 | 6,6 |
| Фармаконагляд | 8 | 6,6 |
| Послуги з доданою вартістю, пов’язані з продуктом | 9 | 5,5 |
Критерію ціни експерти з Дубаї відвели лише п’яте місце з ваговим коефіцієнтом 9,4%. У той же час у Кувейті ціновий критерій в інструменті MCDA мав ваговий коефіцієнт 35% (Abdullah A.H. et al., 2019). Така оцінка, ймовірно, характерна для поточного моменту в організації лікарського забезпечення країни: метою впровадження MCDA є підтримка початкового етапу пошуку найбільш цінних альтернатив оригінальним препаратам, яким традиційно віддають перевагу в Кувейті (табл. 2). При цьому точкою відсікання — умовою отримання повного балу за критерієм «ціна» визначено показник «-60%». Тобто для отримання повного бала необхідно надати ціну, що на 60% нижча, ніж у оригінального препарату, у той час як менші значення будуть оцінені пропорційно.
| Таблиця 2 | Критерії, відібрані експертами Кувейту для MCDA із зазначенням рангів і вагових коефіцієнтів (Abdullah A.H. et al., 2019) |
| Критерії | Ранг | Ваговий коефіцієнт, % |
| Ціна в порівнянні з оригінальним препаратом | Пріоритетний | 35 |
| Еквівалентність референтному | 1 | 16,2 |
| Стабільність і склад | 2 | 13,5 |
| Забезпечення якості | 3 | 11,2 |
| Надійність ланцюга поставок | 4 | 8,8 |
| Макроекономічна користь | 5 | 5,5 |
| Реальна клінічна ефективність | 6 | 4,2 |
| Фармаконагляд | 7 | 3,3 |
| Послуги з доданою вартістю, пов’язані з продуктом | 8 | 2,3 |
В Індонезії нарахування балів за критерієм ціни вирішили прив’язати до найдешевшого продукту на ринку (Inotai A. et al., 2018). Максимальний бал за спеціально розробленою шкалою отримує найдешевший препарат, половинний — той, що в 2 рази (на 100%) дорожчий, нульовий — той, що дорожчий у 3 рази (на 200%). При цьому ваговий коефіцієнт цінового критерію в загальній оцінці в Індонезії встановили на найвищому рівні — 40% (табл. 3).
| Таблиця 3 | Критерії, відібрані експертами Індонезії для MCDA із зазначенням рангів і вагових коефіцієнтів (Inotai A. et al., 2018) |
| Критерії | Рейтинг | Ваговий коефіцієнт, % |
| Цінова перевага | Не визначено | 40 |
| Гарантія якості | 1 | 18,8 |
| Еквівалентність референтному | 2 | 12,5 |
| Стабільність і склад | 2 | 12,5 |
| Надійність ланцюга поставок | 3 | 8,4 |
| Реальні клінічні або економічні результати, такі як прихильність або немедикаментозні витрати | 4 | 4,2 |
| Фармаконагляд | 5 | 3,6 |
Індонезійські експерти, які працювали над методикою, підкреслили, що без чітких критеріїв забезпечення якості під час закупівлі ліків фармацевтичне забезпечення країни знаходиться під загрозою. Дійсно, у Індонезії — четвертої в світі країни за чисельністю населення, — свій негативний досвід результатів державних закупівель з урахуванням одного лише критерію низької ціни. На масштабні зусилля в цьому напрямку, що викликали значне зниження цін, місцеві виробники відреагували масовим зниженням якості: стали використовувати дешеві активні фармацевтичні інгредієнти, спростили підходи до упаковки (паперова замість блістерів, негерметична і т.д.) (Hasnida A. et al., 2021). Тому впровадження жорсткого державного цінового тиску в системах з обмеженими технічними можливостями та/або корупцією і недостатнім управлінням у системах охорони здоров’я та судової влади загрожує негативними наслідками щодо якості ліків (WHO, 2017). Ігнорування захисних заходів, зокрема, диференційованого ціноутворення, може дорого коштувати громадському здоров’ю.
Список використаної літератури
- Abdullah A.H., Holtorf AP., Al-Hussaini M. et al. (2019) Stakeholder driven development of a multi-criteria decision analysis tool for purchasing off-patent pharmaceuticals in Kuwait. J of Pharm Policy and Pract 12, 9.
- Baran-Kooiker A., Czech M., Kooiker C. (2018) Multi-Criteria Decision Analysis (MCDA) Models in Health Technology Assessment of Orphan Drugs-a Systematic Literature Review. Next Steps in Methodology Development?. Front Public Health, 6: 287. Published 2018 Oct 15. doi: 10.3389/fpubh.2018.00287.
- Bate R., Jin G.Z. et al. (2016) Poor-Quality Drugs and Global Trade: A Pilot Study. American Journal of Health Economics, 2(3), 373–398.
- Brixner D., Maniadakis N., Kaló Z. et al. (2017) Applying Multi-Criteria Decision Analysis (MCDA) Simple Scoring as an Evidence-based HTA Methodology for Evaluating Off-Patent Pharmaceuticals (OPPs) in Emerging Markets. Value Health Reg Issues. Sep; 13: 1-6. doi: 10.1016/j.vhri.2017.02.001. Epub 2017 May 11. PMID: 29073981.
- Farghaly M.N., Al Dallal S.A.M., Fasseeh A.N. et al. (2021) Recommendation for a Pilot MCDA Tool to Support the Value-Based Purchasing of Generic Medicines in the UAE. Front. Pharmacol. 12: 680737. doi: 10.3389/fphar.2021.680737.
- Hasnida A., Kok M.O., Pisani E. (2021) Challenges in maintaining medicine quality while aiming for universal health coverage: a qualitative analysis from Indonesia. BMJ Global Health; 6: e003663.
- Inotai A., Brixner D., Maniadakis N. et al. (2018) Development of multi-criteria decision analysis (MCDA) framework for off-patent pharmaceuticals — an application on improving tender decision making in Indonesia. BMC Health Serv Res 18, 1003.
- Kaló Z., Holtorf A.P., Alfonso-Cristancho R. et al. (2015) Need for multicriteria evaluation of generic drug policies. Value Health,18(2): 346-51. doi: 10.1016/j.jval.2014.12.012. Epub 2015 Feb 11. PMID: 25773570.
- Petykó Z.I., Inotai A., Holtorf A.P. et al. (2020) Barriers and facilitators of exploiting the potential of value-added medicines. Expert Rev Pharmacoecon Outcomes Res, 20(3): 229–236. doi: 10.1080/14737167.2020.1758558. Epub 2020 Apr 29. PMID: 32321326.
- Schey C., Krabbe P., Postma M., Connolly M. (2017) Multi-criteria decision analysis (MCDA): Testing a proposed MCDA framework for orphan drugs. Orphanet Journal of Rare Diseases12. 10.1186/s13023-016-0555-3.
- Wątróbski J., Jankowski J., Ziemba P. et al. (2019) Generalised framework for multi-criteria method selection. Omega, Volume 86, Pages 107–124.
- World Health Organization (2017) WHO global surveillance and monitoring system for substandard and falsified medical products. Geneva, Switzerland: WHO, 2017. http://www.who.int/medicines/regulation/ssffc/publications/GSMS_Report.pdf. (accessed 8 Dec 2017).

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим