 По данным, опубликованным аналитической компанией «IMS Health» в докладе «Polska na tle innych krajów EU. Analiza skutków wprowadzenia nowej ustawy na rynek farmaceutyczny», по итогам 2010 г. фармацевтический рынок Польши занимает 6-ю позицию в рейтинге крупнейших фармрынков Европы.
По данным, опубликованным аналитической компанией «IMS Health» в докладе «Polska na tle innych krajów EU. Analiza skutków wprowadzenia nowej ustawy na rynek farmaceutyczny», по итогам 2010 г. фармацевтический рынок Польши занимает 6-ю позицию в рейтинге крупнейших фармрынков Европы.
Объем аптечных и госпитальных продаж на польском фармацевтическом рынке в 2009 г. составил 26 млрд злотых (6,7 млрд евро) в ценах конечного потребления. При этом в 2009 г. на фоне общего экономического спада прирост продаж лекарственных средств достиг 9% по сравнению с 2008 г. Увеличение объема продаж препаратов ОТС-группы было наиболее существенным и составило 14%. В то время как объем продаж лекарственных средств Rx-группы, подлежащих реимбурсации, остановился на уровне 6,7%, а остальных — 4,9%.
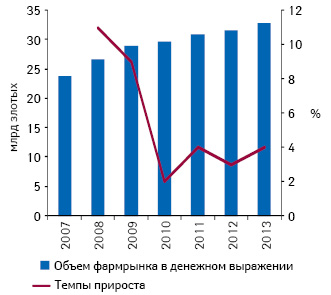
Согласно информации, опубликованной аналитической компанией «PMR» в докладе «Polish pharmaceutical market: modest growth expected between 2011 and 2013», в 2010 г. объем польского фармацевтического рынка достиг 29,7 млрд злотых (7,4 млрд евро), при этом прирост составил 2% (рис. 1). Замедление темпов прироста в 2010 г., по мнению аналитиков компании «PMR», связано с высокой базой сравнения в 2009 г. В соответствии с прогнозами, объем фармрынка Польши в 2011 г. может увеличиться на 4% до 30,9 млрд злотых (8 млрд евро).
Польша занимает 2-е место в ЕС (после Франции) по объему потребления лекарственных средств на душу населения в натуральном выражении. Так, средний поляк ежегодно употребляет около 30 упаковок препаратов, что в денежном выражении составляет около 114 евро. Это обеспечивает Польше 15-ю позицию среди стран — членов ЕС. Для сравнения: аналогичный показатель, по данным, опубликованным аналитической компанией «IMS Health» в докладе «Polska na tle innych krajów EU. Analiza skutków wprowadzenia nowej ustawy na rynek farmaceutyczny», в Германии составляет 317 евро, в Испании — 234 евро, в Венгрии — 168 евро, а в Эстонии и Болгарии — 103 евро и 79 евро соответственно.
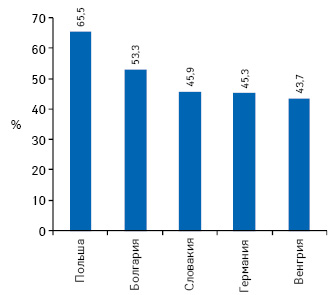
Польский фармацевтический рынок характеризуется наличием в своей структуре значительной доли генерических препаратов. В этом отношении Польша отличается от других европейских стран. Согласно данным, опубликованным на сайте www.nazdrowie.pl, в денежном выражении генерики аккумулируют 65,5% рынка, а в натуральном — до 86,5%. Для сравнения: объем продаж генериков в Италии достигает 2% в денежном выражении и 4% в натуральном, в Чехии — 32% и 55% соответственно. В среднем в Европе доля генериков в общем объеме продаж в денежном выражении составляет около 50% (рис. 2). Наряду с этим в 2010 г. рынок инновационных лекарственных средств, по данным, опубликованным аналитической компанией «IMS Health» в докладе «Polska na tle innych krajów EU. Analiza skutków wprowadzenia nowej ustawy na rynek farmaceutyczny», в Польше оценивался на уровне 2 млрд евро. Для сравнения: этот показатель для Испании (сопоставимой по количеству населения) составляет 11,7 млрд евро.
Как все начиналось
В Польше до 1 мая 2004 г., то есть до вступления в Европейский Союз, существовала единая процедура регистрации лекарственных средств, которую должны были пройти все препараты, включая разрешенные к маркетированию в ЕС. При регистрации этих лекарственных средств заявители предоставляли подробную информацию, основываясь на которой препарат допускался к маркетированию в странах ЕС.
В 1999 г. Польша присоединилась к договору между ЕС и его ассоциированными членами (Collaboration Agreement between Drug Regulatory Authorities in EU Associated Countries — CADREAC), результатом чего стало упрощение процедуры регистрации в Польше лекарственных средств, маркетирующихся в ЕС. Однако, согласно принятым в стране законам, до вступления в ЕС Польша сохраняла право на самостоятельное регулирование ценообразования на лекарственные препараты и выдачу торговых лицензий.
Изобилие возможностей
С момента вступления в ЕС в мае 2004 г. на лекарственные средства, зарегистрированные в ЕС, не нужно получать отдельную торговую лицензию для маркетирования в Польше. В соответствии со ст. 3 п. 2 Фармацевтического закона (Prawo Farmaceutyczne), который вступил в силу 1 мая 2004 г., торговые лицензии, полученные в Польше до 1 мая 2004 г., были действительны еще в течение года (до 1 мая 2005 г.).
В ЕС существуют 3 основные процедуры регистрации лекарственных препаратов: централизованная, децентрализованная (Decentralized procedure) и взаимного признания (Mutual recognition procedure). Первая из них, в соответствии с распоряжением Совета Европы (Regulation 2309/93/EC), обеспечивается Европейским агентством по лекарственным средствам (European Medicines Agency — EMA), которое находится в Лондоне (Великобритания). А непосредственно решение о выдаче торговой лицензии выносит Еврокомиссия, основываясь на рекомендациях ЕМА. Процедура взаимного признания ведется отдельными государствами — членами ЕС на основе национальных правил и регулируется Directive 2001/83/ЕС Европейского парламента от 6 ноября 2001 г. Таким образом, возможно проведение регистрации и авторизации лекарственного средства в странах — членах ЕС на основе документации, направленной регуляторным органом другого государства-члена, в котором этот препарат уже маркетируется. Децентрализованная процедура предполагает одновременное получение торговой лицензии в нескольких государствах — членах ЕС. Кроме того, каждая страна — член ЕС может давать торговую лицензию для маркетирования в пределах одного государства.
Централизованная процедура
Заявки на получение торговой лицензии для маркетирования препаратов в ЕС, которые подаются в ЕМА, рассматриваются одним из 4 комитетов:
- Комитет по лекарственным средствам для применения у человека (Committee for Medicinal Products for Human Use — CHMP);
- Комитет по лекарственным препаратам для использования в ветеринарии (Committee for Medicinal Products for Veterinary Use — CVMP);
- Комитет по лекарственным препаратам-сиротам (Committee for Orphan Medicinal Products — СОМР);
- Комитет по лекарственным препаратам растительного происхождения (Committee for Herbal Medicinal Products — НМРС).
В состав CHMP входят по 2 представителя от каждой страны — члена ЕС, а его научную базу обеспечивают около 3 тыс. исследователей, работающих в качестве консультантов. Комитет излагает свои рекомендации касательно того или иного лекарственного средства, которые принимает во внимание ЕМА при вынесении своего решения.
Разрешение на маркетирование, выданное Еврокомиссией, распространяется на все государства — члены ЕС. Однако возможны исключения, например, если в какой-то стране есть законодательные акты, запрещающие или ограничивающие маркетирование либо использование определенной группы препаратов. После получения торговой лицензии лекарственные средства вносят в специальный реестр и им присваивают номер, который впоследствии обязательно указывается на упаковке. В случае отказа со стороны Еврокомиссии в выдаче торговой лицензии запрет на маркетирование распространяется на все государства — члены ЕС. Информация о получении торговой лицензии, в том числе дата выдачи и регистрационный номер, публикуются в официальном издании.
Полученное таким образом разрешение действительно в течение 5 лет и может быть продолжено в случае подачи заявления держателем торговой лицензии минимум за 3 мес. до окончания срока ее действия. Для продления лицензии ЕМА предоставляется досье, содержащее данные по итогам фармаконадзора.
Препятствием для маркетирования препарата, получившего торговую лицензию от Еврокомиссии, на фармрынке Польши может стать отсутствие инструкции на польском языке. Однако, в соответствии с законодательством ЕС в этой сфере, упаковка и инструкция лекарственного средства должны быть на языке страны — члена ЕС, в которой оно будет маркетироваться. Таким образом, выведение препарата, зарегистрированного Еврокомиссией, на польский рынок потребует дополнительного согласования текста инструкции и оформления упаковки с регуляторными органами ЕС. Только после их одобрения ЕМА лекарственное средство сможет маркетироваться в Польше.
Взаимное признание
1 мая 2004 г. в Польше вступили в силу правила, регулирующие процедуру взаимного признания лекарственных средств, получивших торговую лицензию хотя бы в одном государстве — члене ЕС. Эта процедура применима к препаратам, зарегистрированным в странах ЕС и странах Европейской ассоциации свободной торговли (European Free Trade Association — EFTA), являющихся участниками Соглашения о Европейском экономическом пространстве (Agreement on the European Economic Area), к которым относятся, например, Норвегия, Лихтенштейн, Исландия и др. (кроме Швейцарии).
Процедура взаимного признания инициируется держателем торговой лицензии. С этой целью он должен предоставить заявление, в котором подтвердит, что согласен с выводами и материалами отчета, представленными государством (Reference Member State — RMS), уже выдавшим торговую лицензию на маркетирование препарата на его территории. Также необходимо продемонстрировать образцы упаковки и инструкции на польском языке. Такой способ регистрации лекарственного средства занимает 90 дней с момента подачи заявления. При этом подготовка заявления, как правило, длится еще 90 дней. Отметим, что процедура получения торговой лицензии на маркетирование на территории Польши по обычной схеме занимает около 210 дней.
Децентрализованная процедура
Децентрализованная процедура регистрации лекарственного средства предполагает получение торговой лицензии параллельно в нескольких государствах — членах ЕС. В таком случае в одной стране (RMS) проходят все основные процессы регистрации, в том числе первоначальный анализ предоставленной документации. Также регуляторные органы этого государства осуществляют координацию всего процесса регистрации в разных странах. Процедура такой регистрации занимает не менее 210 дней и может быть продолжена, если возникнут дополнительных запросы данных со стороны других стран, в которых ведется параллельное получение лицензии.
Параллельный импорт
Параллельный импорт препаратов — закупка патентованного лекарственного средства из законного источника в стране-экспортере и его импорт без запроса согласия со стороны патентообладателя в импортирующей стране. Этот механизм позволяет импортировать препараты из стран, где они продаются по более низким ценам, чем на внутреннем рынке, что способствует экономии средств плательщиков.
Правовой основой параллельного импорта в ЕС является постановление Европейского трибунала об общих правилах свободного перемещения товаров в рамках внутреннего рынка ЕС. Так, параллельный импорт — следствие реализации принципа исчерпания прав, способствующего предотвращению безраздельного осуществления патентообладателем своих исключительных прав, если продукт продается на рынке. Правительства государств — членов ЕС могут самостоятельно определять момент исчерпания прав патентообладателя.
Это способствовало созданию упрощенной схемы доступа препаратов, являющихся предметом параллельного импорта. Процедура такой регистрации прописана в Фармацевтическом законе Польши с целью обеспечения импорта более дешевых лекарственных средств. Согласно этому закону, в случае если заявка и прилагающаяся к ней документация полностью соответствуют требованиям, выдача лицензии должна произойти не позднее 45 дней с момента подачи документов. Параллельный импорт разрешен для стран-членов ЕС и EFTA (кроме Швейцарии). Препарат, являющийся предметом параллельного импорта, должен быть зарегистрирован в стране, из которой он импортируется. Заявка на получение торговой лицензии на лекарственное средство, являющегося предметом параллельного импорта, должна включать только основную информацию, содержащуюся в лицензии, выданной страной, из которой препарат импортируется, а также данные об импортере. К заявке прилагаются образцы маркировки упаковки и инструкции, копия лицензии на производство и переупаковку лекарственного средства, а также подтверждение оплаты.
Порядок получения торговой лицензии в Польше
Получение торговой лицензии на лекарственные средства — дорогостоящий, сложный и трудоемкий процесс. Эта процедура занимает в среднем от 1 до 2 лет. Регистрацию препаратов в Польше проводит Управление по регистрации лекарственных средств, медицинских изделий медицинского назначения и биоцидов (Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych) (далее — Управление), организованное в 2001 г. путем вывода из состава Института лекарственных средств (Instytutu Leków) Бюро по регистрации лекарственных средств (Biuro Rejestracji Leków).
Ранее решение о выдаче торговой лицензии принимал министр здравоохранения, но с 1 мая 2011 г. в силу вступил закон об Управлении по регистрации лекарственных средств, медицинских изделий медицинского назначения и биоцидов. Этот документ изменил статус центра регистрации: он становится независимым центральным органом государственного управления, глава которого будет подчиняться непосредственно премьер-министру.
В соответствии с этим законом глава Управления получил новые полномочия. Так, решение о выдаче торговой лицензии на маркетирование лекарственных средств и биоцидов теперь будет принимать он, а не министр здравоохранения, как это было ранее. В распоряжении главы Управления с целью консультирования будет 6 комитетов экспертов, в том числе по лекарственным средствам, фармаконадзору, биоаналогическим продуктам, ветеринарным препаратам.
Среди основных функций, возложенных на Управление, — выдача торговой лицензии на маркетирование лекарственных средств в Польше и регулирование в сфере проведения клинических исследований. Кроме того, оно предоставляет необходимые рекомендации в процессе подготовки документации для получения торговой лицензии, ведет реестр лекарственных средств, получивших разрешение на маркетирование, а также публикует его в официальном издании. Управление контролирует проведение клинических исследований (их соответствие требованиям надлежащей клинической практики) и следит за внесением результатов в базу данных; собирает информацию о побочных реакциях, имевших место при приеме лекарственных средств; проверяет безопасность препаратов. Также на Управление возложена функция проведения расследований и правоохранительных мероприятий в связи с безопасностью, маркетированием и применением лекарственных средств.
В зависимости от данных, полученных в процессе доклинических и клинических исследований, а также группы, к которой относится препарат, заявка и сопровождающая ее документация могут значительно отличаться. Соответственно размер регистрационного сбора варьируется в пределах 20–70 тыс. злотых (5,2–18 тыс. евро). Получение торговой лицензии может проходить по нескольким схемам:
- полный запрос — наряду с документацией, свидетельствующей о качестве препарата, необходимо предоставить данные доклинических и клинических исследований, которые продемонстрируют безопасность и эффективность лекарственного средства;
- запрос «well established use» — доклинические и клинические данные заменяются информацией, полученной из специализированной литературы;
- сокращенный запрос — вместо результатов доклинических и клинических исследований предоставляются данные, демонстрирующие эквивалентность (биоэквивалентность) регистрируемого препарата относительно референтного лекарственного средства. Кроме того, существует переходной вариант между сокращенным и полным запросом, его применяют касательно генерических препаратов, которые по каким-либо характеристикам отличаются от оригинального лекарственного средства, а также биоаналогических препаратов;
- запрос о регистрации лекарственных средств, состоящих из комбинации действующих веществ, зарегистрированных ранее;
- отдельные схемы регистрации разработаны для гомеопатических и традиционных растительных препаратов.
Производители генерических препаратов в процессе регистрации не обязаны предоставлять результаты доклинических и клинических исследований в объёме, предусмотренном схемой полного запроса. Все остальные требования к документации при регистрации генерических лекарственных средств такие же, как и для оригинальных препаратов. Так, производители должны предоставить документацию о характеристиках продукта, процессе производства, контроле исходных материалов и готовой продукции; оценки экспертов; результаты тестов на химическую стабильность. Кроме того, при регистрации генериков необходимо провести сравнение генерической версии препарата с оригинальным лекарственным средством на предмет эквивалентности (биоэквивалентности).
Государственные организации, осуществляющие контроль качества лекарственных средств
Институт лекарственных средств (Instytut Leków)
Основная задача института заключается в проведении научных работ, а также исследований по оценке качества лекарственных средств, изделий медицинского назначения, их безопасности, терапевтической эффективности и т.д.
Эти функции можно разделить на две группы: исследования, связанные с лекарственными средствами; изучение документации для контроля и оценки качества тех лекарственных средств, которые проходят процесс регистрации или уже находятся на польском рынке. Институт сотрудничает с такими европейскими организациями, как EMA и Европейский директорат по качеству лекарственных средств (European Directorate for the Quality of Medicines — EDQM) в Страсбурге, который занимается разработкой Европейской Фармакопеи (European Pharmacopoeia) — руководства, используемого при производстве фармацевтических продуктов в странах — членах ЕС, — а также контролирует сеть национальных лабораторий по контролю качества лекарственных средств (Official Medicines Control Laboratories (OMCL) Network).
Контроль качества и безопасности препаратов, которые еще не получили торговой лицензии, осуществляемый институтом, проводится от имени Управления. Институт проводит анализ документации в соответствии с принципами, принятыми ЕМА, и современными фармакопейными монографиями в течение не более 50 дней.
Наряду с этим проводится дополнительный контроль качества препаратов, уже маркетируемых на рынке. В этом случае деятельность института осуществляется от имени Главной фармацевтической инспекции (Główny Inspektorat Farmaceutyczny). Несмотря на внедрение подходов надлежащей практики — лабораторной (GLP), клинических исследований (GCP), производства (GMP) и дистрибьюции (GDP), институтом фиксируются несоответствия качества лекарственных средств. Проверке подвергаются те маркетируемых на рынке препараты, на которые поступили жалобы от пациентов или врачей.
Главная фармацевтическая инспекция ( Główny Inspektorat Farmaceutyczny )
В состав Главной фармацевтической инспекции входят следующие подразделения:
- Департамент по надзору;
- Департамент по инспектированию производства;
- Юридический отдел;
- Главное управление.
Основными функциями, возложенными на Главную фармацевтическую инспекцию, являются:
- контроль за условиями производства (в том числе соответствие требованиям GMP) и импорта лекарственных средств;
- контроль качества и маркетинга препаратов;
- контроль процесса сбыта лекарственных средств на всех его этапах;
- контроль наличия надлежащей маркировки на упаковках препаратов и соответствия рекламы лекарственных средств нормативно-правовым актам законодательной базы Польши.
Инспекция имеет право запретить продажу определенных препаратов в случае отсутствия торговой лицензии или установления того факта, что продукт не соответствует требованиям по качеству. Кроме того, эта организация выдает лицензии аптекам и оптовым дистрибьюторам, а также контролирует их деятельность.
В состав региональных подразделений Главной фармацевтической инспекции входят лаборатории по контролю качества лекарственных средств (Laboratorium Kontroli i Jakości Leków).
P.S.: Таким образом, получение торговой лицензии в Польше представляет собой многоуровневый процесс, позволяющий заявителю выбрать наиболее оптимальный путь для каждого лекарственного средства. Управление — регуляторный орган Польши, занимающийся выдачей торговой лицензии для маркетирования лекарственных средств на территории страны, — является централизованной и самостоятельной организацией, ответственной за весь процесс регистрации препарата. В Польше работает несколько государственных организаций, обеспечивающих вспомогательные функции по отношению к Управлению, а также контроль препаратов, уже допущенных к маркетированию. Итак, в Польше внедрена достаточно простая, но вместе с тем эффективная система регулирования в сфере маркетирования лекарственных средств.
по материалам www.pulsmedycyny.com.pl, www.nil.org.pl, www.rp.pl, www.bip.urpl.gov.pl,
www.rejestracja-lekow.pl, www.nazdrowie.pl, www.gif.gov.pl, www.ceepharma.com, www.senat.gov.pl
Редакция «Еженедельника АПТЕКА» выражает благодарность за помощь в
подготовке материала Кшиштофу Седлецки,
главе представительства компании
«Astellas Pharma Europe» в Украине; Виталию Кирику, главе комитета по
вопросам здравоохранения Европейской Бизнес Ассоциации,
главе представительства компании «Polpharma» в Украине; Еве Лепжинской,
главе департамента по
регуляторным вопросам компании
«Polpharma».

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим