


Всебічні біофармацевтичні дослідження, проведені в другій половині ХХ ст., вперше переконливо засвідчили значний вплив допоміжних речовин на ефективність ліків унаслідок їх взаємодії з АФІ. На жаль, на цю проблему протягом тривалого часу не звертали уваги, хоча факт складних взаємодій між активними речовинами (синергізм, антагонізм та ін.) при їх спільному використанні був відомий уже на початку століття. Як стверджує Л. Затурецький (1970), «…лише експериментальні дані, чіткі факти й біофармацевтичний аналіз змусили прибічників товарознавчої фармації минулого визнати певні фармацевтичні функції допоміжних речовин та погодитися з необхідністю суворого індивідуального добору їх для окремих груп активних субстанцій».
Ураховуючи практичну неможливість введення в організм чистих активних речовин з лікувальною метою, сучасна наукова фармація вважає за необхідне вивчення фармакологічної дії АФІ тільки за наявності допоміжних речовин, здатних оптимізувати їх ефективність.
Застосування високочутливих методів аналізу (газорідинна й тонкошарова хроматографія, диференційний термічний аналіз, різні види спектрометрії тощо), ретельних біофармацевтичних досліджень на всіх етапах виготовлення й зберігання ліків дозволило встановити взаємозв’язки в системі «активна речовина — допоміжна речовина», довести обов’язкову необхідність ураховувати не тільки технологічні властивості допоміжних речовин, але й характер та якість кінцевих продуктів, що утворюються в процесі виготовлення, тобто їх вплив на терапевтичну ефективність ліків як цілісної фармацевтичної системи в певній лікарській формі.
Характер взаємодії між допоміжними й активними речовинами може бути різним, у більшості випадків він залежить від наявності активних груп, розміру, форми їх розгалуження, просторових властивостей та здатності до міжмолекулярної асоціації, ступеня сольватації, значення гідрофільно-ліпофільного балансу (ГЛБ) та інших характеристик молекул, наявних у системі, що й обумовлює їх реакційну здатність. У цьому разі не розглядається хімічна несумісність інгредієнтів, що є окремим питанням для розгляду, а йдеться про фізичну та фізико-хімічну взаємодію речовин, наявних у фармацевтичній системі.
Найпростішими сполуками, які утворюються внаслідок взаємодії допоміжних та активних речовин, вважають сполуки-вкраплення. Вони утворюються шляхом проникнення молекули одного виду в порожнину або кристалічну решітку іншої молекули. Це відбувається через те, що деякі кристалічні структури мають досить великі порожнини і можуть вмістити невеликі молекули іншого компонента. Без будь-якого «втручання хімічних сил» можуть утворюватися сполуки молекулярного приєднання або клатрати. Стійкість таких сполук значною мірою залежить від просторового розміщення й від того, наскільки конфігурація молекули «гостя» відповідає конфігурації молекули «господаря».
З макромолекул допоміжних і активних речовин можуть утворюватися міцели або асоціати міцел. Відомо, що значна кількість високомолекулярних сполук (ВМС) утворює справжні розчини лише за умови дуже низьких концентрацій (10–15–10–3 моль/л), а більш концентровані розчини набувають властивостей колоїдної структури внаслідок утворення колоїдних агрегатів-міцел. Здатність до структуроутворення залежить від концентрації ВМС і температури розчину. Полімери, молекули яких мають гідрофільну й гідрофобну частини, виявляють підвищену тенденцію до міцелоутворення, що найбільш чітко виражено в амфофільних молекулах. Наприклад, утворення міцел неіонних поверхнево-активних речовин (ПАР) у водних розчинах визначається в основному силами когезії вуглеводневих ланцюгів молекул і спорідненістю гідрофільних груп до молекул води; у разі іонних ПАР — когезією гідрофобних груп і балансом електричних сил іонізованих груп молекули. Тобто їх молекули перебувають у суворо орієнтованому стані по відношенню до полярного розчинника. У цьому разі виникає можливість створення асоційованих сполук. Зазвичай міцели ПАР та інших допоміжних речовин мають великі колоїдні розміри (40–500 Å), складаються зі значної кількості молекул (до 200) і мають велику об’ємну ємність завдяки порожнинам. У ці порожнини міцел або проміжки між згустками макромолекул під впливом міжмолекулярних сил можуть проникати невеликі молекули активних речовин. Утворені сполуки дуже часто стабілізуються додатковими побічними валентними силами.
На рисунку продемонстровано взаємодії активних речовин з міцелою, обумовлені головним чином розміром і властивостями їх молекул. Якщо молекула активної речовини має виражені гідрофобні властивості, вона найбільш вірогідно здатна проникати всередину міцели (а). Якщо молекула речовини має гідрофобну і гідрофільну групи, то найбільш вірогідно, що вона посяде місце посередині між окремими молекулами міцели (б). Гідрофільна молекула активної речовини буде приєднуватися до зовнішньої, найбільш гідрофільної частини міцели (в). Таке розташування активної речовини обумовлено дією полярного дисперсійного середовища системи.
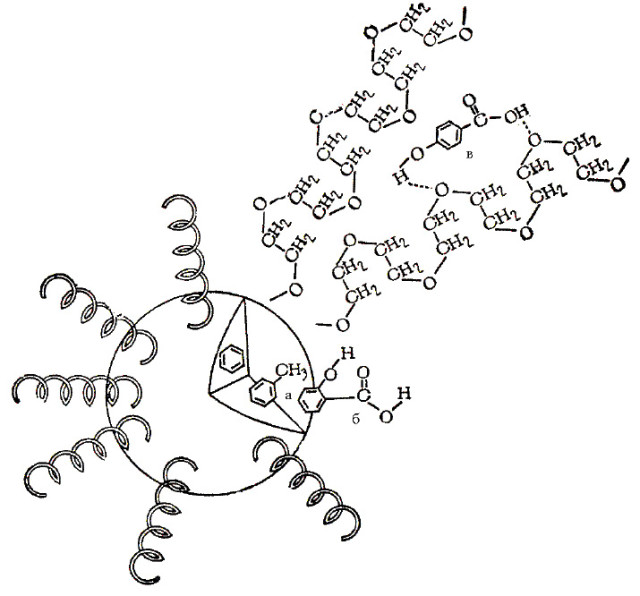
При взаємодії між молекулами допоміжних і активних речовин можуть утворюватися сполуки вищого порядку — комплексні сполуки, які характеризуються значно більшою стійкістю. Особливо легко вступають у реакцію комплексоутворення органічні речовини, що мають молекули складної комформації, якими і є більшість сучасних активних і допоміжних речовин. Тенденція до комплексоутворення речовин різна і залежить, перш за все, від заряду і властивостей різних груп молекул, здатних утворювати водневі зв’язки. Водневий зв’язок розглядається як найбільш важливий серед сил, здатних визначати порядок розташування молекул у міцелі. Така взаємодія з утворенням асоціатів здатна змінювати властивості (в’язкість, розчинність, леткість тощо) багатьох систем.
Не зупиняючись на характері реакції комплексоутворення та видах комплексів, необхідно підкреслити виняткову розповсюдженість цього типу взаємодії не тільки між активними і допоміжними речовинами у фармацевтичній системі, але й між компонентами фармацевтичної системи і складовими харчових продуктів, біологічними секретами, елементами біологічних рідин, особливо їх білковими фракціями, та ін. Зрозуміло, що важко передбачити всі можливі взаємодії компонентів активних речовин та їх метаболітів з компонентами макроорганізму — це питання окремого розділу фармації, але передбачити можливі наслідки взаємного впливу активних і допоміжних речовин в одній фармацевтичній системі на терапевтичну ефективність, особливо на етапі розроблення та виробництва ліків, можна й, більше того, необхідно.
Слід також наголосити на суттєвому впливі на реакції комплексоутворення (прискорення чи спрямування у певному напрямку) інтенсивності технологічних процесів виробництва ліків. Особливо відповідальними в цьому сенсі є стадії розчинення й фільтрації, перекристалізації й плавлення, грануляції й сушіння, змішування, пресування та ін., реалізація яких супроводжується зміною агрегатного стану, інтенсифікацією і збільшенням числа контактів компонентів системи, зміною в напрямку значного підвищення температури, вологості тощо, тобто трансформацією поверхневих властивостей активних і допоміжних речовин. У таких умовах можливі своєрідні перетворення інгредієнтів системи, що активують різні взаємодії як активних, так і допоміжних речовин. Подібний вплив чинять і адсорбційні взаємозв’язки, які можуть мати позитивний чи негативний характер по відношенню до швидкості й повноти всмоктування в організмі вивільненого із системи активного фармацевтичного інгредієнта (АФІ), тобто щодо кінцевого фармакотерапевтичного ефекту ліків.
Такі поширені допоміжні речовини, як крохмаль, желатин, поліетиленгліколі, похідні целюлози, неіонні ПАР, здатні утворювати комплекси з активними речовинами різної природи, утворювати сполуки, що відрізняються за своїми характеристиками від вихідних активних речовин (розчинністю, стійкістю, абсорбційною здатністю тощо). Прикладом може бути поєднання амфетаміну і карбоксиметилцелюлози в таблетках, драже, гранулах, суспензіях, сиропах та інших лікарських формах, з яких активна речовина практично не всмоктується і відповідний фармакотерапевтичний ефект не забезпечується. Аналогічне явище відмічають при використанні ПЕГ 4000 з фенобарбіталом. Одержаний комплекс майже не розчиняється та не всмоктується.
Унаслідок взаємодії між неіоногенними ПАР і активними речовинами утворюються сполуки різної стійкості, які по-різному впливають на фізико-хімічні властивості активних субстанцій — змінюється їх розчинність, оскільки міцелярне накопичення ПАР має властивості підвищувати розчинність речовин (олеофільні вітаміни, гормони та їх замінники, етерні олії та ін.). Також унаслідок такої взаємодії знижується швидкість гідролізу, оскільки додані до міцел активні речовини краще захищені. Солюбілізована активна речовина може міститися глибоко всередині гідрофобного центру міцели, і гідроксильні чи водневі іони при цьому не можуть контактувати із солюбілізованою речовиною, внаслідок чого не відбувається гідролітичного розщеплення. Доведено, що аніонні та катіонні ПАР уповільнюють гідроліз етерів, оскільки гідрофобні етери розташовуються в центрі міцели й оточуються вуглеводними ланцюгами ПАР.
Експериментально підтверджено, що антибіотики (хлорамфенікол, синтоміцин, хлортетрациклін і частково стрептоміцин) значно активніші щодо деяких мікроорганізмів за наявності ПЕГ у системі, що й виявляється в таких комбінованих препаратах, як Левосин, Левомеколь та ін. Наприклад, ефективність хлорамфеніколу може підвищуватися майже в 9 разів за наявності ПЕГ, тоді як активність бензилпеніциліну не підвищується, а в деяких випадках (по відношенню до дизентерійних бактерій та кишкової палички) навіть знижується. Сульфаніламіди можуть створювати комплекс з макромолекулою полівінілпіролідону. Ефективність комплексу «хлорамфенікол — полівінілпіролідон» залежить від концентрації полімеру, активної речовини і температури. Взаємодія лабільного вітаміну А з циклодекстрином сприяє отриманню більш стабільної сполуки.
При віскозометричному вивченні гідрогелів метилцелюлози з концентрацією 1–5% і неоміцину сульфату встановлено, що помітно змінюється структура гелю, значно підвищується стійкість системи, відмічено пролонгування бактерицидної дії антибіотика, але разом з цим може погіршитися технологічність системи. Взаємодія тетрацикліну гідрохлориду з неіоногенними ПАР сприяє утворенню сполук, які надають антибіотику тривалої стійкості.
Стрептоміцину сульфат взаємодіє з натрію карбоксиметилцелюлозою, натрію альгінатом, при цьому його активність помітно знижується. Сила взаємодії залежить від рН середовища, наявності електролітів у системі та концентрації антибіотика.
Тестостерону пропіонат впливає на міцелярну структуру ПАР (підвищується показник заломлення розчину), що пояснюється створенням міцелярних комплексів «активна речовина — ПАР» унаслідок внутрішньої молекулярної взаємодії між сполуками.
Ефективність йоду у водних розчинах високополімерів не тільки зберігається, а й у деяких випадках значно підвищується, тоді як токсичність різко знижується. Це явище відкриває широку можливість створення фармацевтичних препаратів з йодом для ентерального й парентерального застосування.
Виявлено підвищення в’язкості розчинів метилцелюлози при взаємодії з багатьма консервантами (бензалконію хлорид, фенілмеркурію борат та ін.). Взаємодія метилцелюлози з піридинію хлоридом пояснюється зміною конфігурації полімерного ланцюга при адсорбції на ньому четвертинної амонієвої сполуки. З естерами кислоти п-оксибензойної утворюються розчинні та нерозчинні комплекси. В утворенні осадів метилцелюлози з п-оксибензойною та п-амінобензойною кислотами беруть участь гідроксильні та карбоксильні групи цих кислот і гідрофільні групи метилцелюлози. Переважним типом зв’язку між метилцелюлозою і деякими похідними фенотіазину є взаємодія гідрофобних частин цих молекул.
Натрію карбоксиметилцелюлоза як колоїдний електроліт виявляє здатність до іонних реакцій. Більшість катіонних речовин, що належать до солей, здатні до взаємодії з натрію карбоксиметилцелюлозою з утворенням іонного зв’язку. Якщо такі низькомолекулярні катіонні речовини, як ефедрину гідрохлорид і новокаїну гідрохлорид, не взаємодіють з натрію карбоксиметилцелюлозою, то сполуки з великою молекулярною масою (антигістамінні речовини, неоміцину сульфат, хініну гідрохлорид та ін.) виявляють здатність до комплексоутворення. Крім утворення осадів, взаємодія натрію карбоксиметилцелюлози й активних речовин може супроводжуватися зміною в’язкості розчинів полімеру, підвищенням розчинності речовини тощо.
Полівінілпіролідон сумісний з такими речовинами, як поліспирти, складні естери, аміди, ланолін, олія рицинова, силікони, похідні целюлози та ін.; виявляє високу здатність до комплексоутворення, зв’язує активні речовини, а також токсини; має велику абсорбційну здатність, унаслідок чого в деяких випадках знижується токсичність антибіотиків при їх іммобілізації на полівінілпіролідоні. Полімер широко використовується для створення твердих дисперсних систем.
Поліетиленгліколь, метилцелюлоза, полівініловий спирт, полівінілпіролідон сумісні з гіалуронідазою, що підвищує здатність до більш швидкого вивільнення та всмоктування антибіотиків, сульфаніламідів, місцевоанестезувальних та інших речовин.
Цинку танат виражено пролонгує дію вітаміну В12 унаслідок утворення повільно дифундуючого комплексу в місці ін’єкції. Подібний ефект виявлено й при використанні олійної суспензії вітаміну В12, де як стабілізатор і загусник використовують гель алюмінію моностеарат.
Прикладом реакції комплексоутворення активної й допоміжної речовин, що змінює фармакокінетику фармацевтичного препарату, є розчин протамін-цинк-інсуліну. Дію інсуліну можна помітно подовжити, використовуючи полівінілпіролідон як пролонгатор, а дію гепарину — додаванням карбоксиметилцелюлози. Магнію стеарат і кислота стеаринова уповільнюють швидкість розчинення кислоти саліцилової в таблетках, тоді як натрію лаурилсульфат прискорює розчинення. Кальцію дифосфат уповільнює всмоктування тетрацикліну внаслідок утворення важкорозчинного комплексу, який майже не всмоктується в кишечнику.
Прикладами, коли в системі «активна речовина — допоміжна речовина» утворюються комплексні сполуки з високим ступенем розчинності та біологічної доступності, є такі, як «полісорбат — кислота саліцилова», «кислота дезоксихолієва — резерпін», «полівінілпіролідон — кислота саліцилова», «полівінілпіролідон — преднізолон», «b-циклодекстрин — різні антигістамінні речовини» та багато інших. Такі допоміжні речовини, як лактоза, магнію карбонат, взаємодіють з фенілбутазоном, кислота стеаринова — з натрію диклоксациліном. В основі такої взаємодії лежить явище фізичної адсорбції.
У сучасній літературі є багато інших відомостей про вплив допоміжних речовин на стабільність АФІ та їх фармакотерапевтичну ефективність. Так, лактоза, що широко використовується як наповнювач і вважається найбільш індиферентною сполукою у фармакологічному й хімічному відношенні при виготовленні таблеток, драже тощо, здатна по-різному впливати на швидкість і повноту всмоктування активних речовин та їх стабільність. Зокрема, лактоза прискорює всмоктування тестостерону, але уповільнює абсорбцію пентобарбіталу, чинить негативний вплив на стабільність багатьох активних речовин. Калію хлорид як допоміжна речовина прискорює всмоктування глюкози, а кальцію хлорид — уповільнює. У деяких випадках додавання навіть малої кількості барвників до таблеток з рибофлавіном з похідними метилцелюлози спричиняє помітне уповільнення швидкості вивільнення активної речовини з фармацевтичної системи. Коригенти також помітно впливають на швидкість усмоктування різних груп активних речовин. Таким чином, усі випадки використання допоміжних речовин при виробництві ліків вимагають ретельного вивчення можливості підсилення чи послаблення їх терапевтичної ефективності.
Є цікаві відомості й про те, що синтетичні та деякі природні макромолекули в дуже малій кількості у комбінації з речовинами білкової природи в 100–1000 разів підсилюють імунну реакцію організму (порівняно з реакцією на ті самі білки без додавання полімеру). Це явище дозволило використовувати процес взаємодії допоміжних і активних речовин для отримання вакцин як фармацевтичних систем нового покоління. Наприклад, створення макромолекулярного тромболітичного препарату Стрептодеказа (поєднання ферменту стрептокінази з водорозчинними похідними природного полімеру декстрину) та препарату Ценовокаїн (поєднання водорозчинних похідних целюлози з новокаїном). Доведено також, що при переході від звичайної низькомолекулярної активної речовини до її макромолекулярної похідної помітно змінюється характер фармакологічної активності. Так, при поєднанні ферменту з полімерним носієм транспортна функція в організмі немов передається макромолекулярній речовині, а терапевтична — активній субстанції. Унаслідок зазначеної модифікації змінюється характер їх взаємодії з рецепторами організму.
Все це підтверджує можливість реального управління властивостями і структурою фармацевтичного препарату в широкому діапазоні, що й використовується при отриманні фармацевтичних систем з контрольованим вивільненням і цілеспрямованою доставкою активних речовин, які отримали назву «терапевтичні системи». До складу таких систем входить полімерна матриця, на якій закріплюється (механічно або хімічно) активна субстанція. Системи регулюють швидкість надходження АФІ в організм у міру розсмоктування матриці-носія. При розробці таких терапевтичних систем головним є створення відповідної полімерної матриці (з певним терміном розсмоктування) та її введення в організм (прикріплюється до слизової оболонки, до шкіри, вшивається під шкіру, уводиться в порожнини тіла тощо).
На сьогодні суттєве значення надається й цілеспрямованій доставці активних речовин до органа-мішені. Найбільш простими та ефективними терапевтичними системами доставки протипухлинних речовин є трансдермальні системи, у тому числі пластирі, дія яких ґрунтується на всмоктуванні активних речовин крізь шкіру. Незважаючи на різні форми, усі вони призначені для виконання однієї функції — пролонгованої дії АФІ за рахунок оптимального їх сполучення з носієм.
Таким чином, короткий огляд проблем, пов’язаних з вибором і використанням допоміжних речовин при виробництві ліків, дозволяє зробити висновок про велику значущість цього питання, що вимагає обов’язкових всебічних і копітких біофармацевтичних досліджень.
Тільки в поєднанні активних і допоміжних речовин з урахуванням типу лікарської форми і технології виробництва ефективність ліків як фармацевтичних систем може бути правильно й об’єктивно охарактеризована.
Перелік використаної літератури
1. Абрамзон А.А. Поверхностно-активные вещества. — Л.: Химия, 1981. — 304 с.
2. Башура Г.С., Оридорога В.А. Вспомогательные вещества и их роль в создании лекарственных форм // В кн.: Технология и стандартизация лекарств. — Х.: ООО «РИРЕГ», 1996. — С. 317–411.
3. Взаимодействие лекарств и эффективность фармакотерапии. Справочное пособие для врачей и фармацевтов / Л.В. Деримедведь, И.М. Перцев, Е.В. Шуванова, И.А. Зупанец, В.Н. Хоменко; под ред. проф. И.М. Перцева. — Харьков: Мегаполис, 2002. — 784 с.
4. Вспомогательные вещества в производстве микрогетерогенных лекарственных форм / Р.Д. Дильбарханов, Г.С. Башура, Н.С. Дубинин и др. — Алма-Ата, 1978. — 66 с.
5. Головенко М.Я. Биофармация и фармакокинетика // Вестник фармакол. и фармац. — 2002. — № 2. — С. 9-16.
6. Допоміжні речовини в технології ліків: вплив на технологічні, споживчі, економічні характеристики і терапевтичну ефективність: навч. посібник / І.М. Перцев, Д.І. Дмитрієвський, В.Д. Рибачук та ін.; за ред. І.М. Перцева. — Х.: Золоті сторінки, 2010. — 600 с.
7. Застосування поверхнево–активних речовин у фармацевтичній практиці / І.М. Перцев, Г.С. Башура, І.О. Муравйов, Є.В. Лабунський // Фармац. журн. — 1972. — № 2. — С. 5–13.
8. Киселева Г.С. Биоэквивалентность и качество лекарственных средств. // Провизор. — 1998. — № 4. — С. 43-45.
9. Кондратьева Т.С. Технология лекарственных форм. — Т. 1. — М.: Медицина, 1991. — 496 с.
10. Наказ МОЗ України № 339 від 19.06.2007 р. «Про затвердження переліків назв допоміжних речовин та барвників, що входять до складу лікарських засобів».
11. Настанова 42–01:2001. Належна виробнича практика. — К.: МОЗ України, 2001. — 82 с.
12. Настанова 42–01–2003. Технологічній процес. Документація. — К.: МОРІОН, 2003. — 42 с.
13. Настанова 42–3. 1:2004. Фармацевтична розробка. — К.: МОЗ України, 2004. — 18 с.
14. Настанова 42–3. 6:2004. Допоміжні речовини. — К.: МОЗ України, 2004. — 11 с.
15. От субстанции к лекарству / Под ред. В.П. Черных. — Харьков: Изд–во НФаУ; Золотые страницы, 2005. — 1244 с.
16. Перцев И.М., Даценко Б.М., Гунько В.Г. Многокомпонентные мази на гидрофильной основе // Фармация. — 1990. — № 5. — С. 73–77.
17. Перцев И.М., Башура Г.С., Алющин М.Т., Дмитриевский Д.И. К вопросу взаимодействия лекарственных и вспомогательных веществ // Фармация. — 1973. — №5. — С. 67–77.
18. Перцев И.М., Сало Д.П., Десенко В.Ф. Влияние фармацевтических факторов на биологическую доступность лекарств. — Харьков, 1978 — 27 с.
19. Перцев И.М., Христенко Л.А., Рачев Д.Р. Влияние вспомогательных материалов на фармакокинетику лекарственных средств в виде ГЛП. // 4th symposium on biopharmaceutics and pharmacokinetics with international participation. — Streske pleso (high tatras), Czechoslovakia May 24–27, 1982. (Abstracts).
20. Перцев І.М. Башура Г.С., Кабачний Г.І. Солюбілізація в технології ліків // Фармац. журн. — 1974. — № 5. — С. 26–35.
21. Полимерные вспомогательные вещества нового поколения / Э.В. Сорокина, Л.А. Бобрицкая, А.И. Сорокин, И.И. Прокопенко // Вісн. фармац. — 2002. — № 2. — С. 68–69. (Спецвипуск).
22. Тенцова А.И., Ажгихин И.С. Лекарственная форма и терапевтическая активность лекарств. — М.: Медицина, 1974. — 336 с.
23. Технология и стандартизация лекарств. / под ред. В.П. Георгиевского и Ф.А. Конева. В 2–х т. Том 1 — Харьков: ООО «РИРЕГ», 1996 — 786 с.; Том 2. — 2000 — 784 с.
24. Технологія ліків промислового виробництва. / В.І Чуєшов, Є.В. Гладух, І.В. Сайко та ін. — У 2-х ч. — Х.: Оригінал, 2012. — 694 с.
25. Фармацевтичні та медико-біологічні аспекти ліків. / І.М. Перцев, О.Х. Пімінов, М.М. Слободянюк та ін.; за ред. проф. І.М. Перцева — Вінниця: Нова книга, 2007. — 728 с.
26. Ясницкий Б.Г., Оридорога В.А. Вспомогательные химико–фармацевтические вещества. Состояние и пути дальнейшего развития // Фармаком. — 1992. — № 2. — С. 3–8.
Національний фармацевтичний університет

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим