 В ходе XVII Российского национального конгресса «Человек и лекарство», проходившего 12–16 апреля 2010 г. в Москве* с проблемной лекцией на тему «Особенности пероральных лекарственных форм с модифицированным высвобождением» выступила Марина Леонова — доктор медицинских наук, профессор кафедры клинической фармакологии Государственного образовательного учреждения высшего профессионального образования «Российский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» (ГОУ ВПО «РГМУ Росздрава»). Она подчеркнула, что пероральный способ введения является одним из наиболее распространенных в клинической практике, поэтому создаваемые препараты пероральных лекарственных форм (ЛФ) с модифицированным высвобождением имеют важное клиническое значение и характеризуются самым широким многообразием.
В ходе XVII Российского национального конгресса «Человек и лекарство», проходившего 12–16 апреля 2010 г. в Москве* с проблемной лекцией на тему «Особенности пероральных лекарственных форм с модифицированным высвобождением» выступила Марина Леонова — доктор медицинских наук, профессор кафедры клинической фармакологии Государственного образовательного учреждения высшего профессионального образования «Российский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» (ГОУ ВПО «РГМУ Росздрава»). Она подчеркнула, что пероральный способ введения является одним из наиболее распространенных в клинической практике, поэтому создаваемые препараты пероральных лекарственных форм (ЛФ) с модифицированным высвобождением имеют важное клиническое значение и характеризуются самым широким многообразием.Пероральные ЛФ с модифицированным высвобождением объединяют не только обеспечивающие замедленное или пролонгированное высвобождение активного фармацевтического ингредиента (АФИ), но и более сложные по кинетике высвобождения системы доставки. При создании ЛФ с модифицированным высвобождением учитывают многие факторы лекарственного препарата, а именно: условия всасывания в желудочно-кишечном тракте (ЖКТ), — место, скорость и механизм всасывания, — растворимость в желудочно-кишечной среде, особенности фармакокинетики (наличие пресистемного метаболизма, взаимосвязь скорости всасывания с концентрацией препарата в плазме крови), особенности фармакодинамики (связь концентрация — эффект, вероятность развития толерантности при постоянном поступлении его в организм). ЖКТ представляет большой диапазон препятствий для лекарственных средств (ЛС), назначаемых внутрь: морфологические барьеры (слой слизи, микроворсины и т.д.), физиологические барьеры (рН, ферменты, специфический транспорт, время транзита), которые ограничивают всасывание. Для всасывания плохо- или медленнорастворимых ЛС требуется более продолжительное время для растворения в желудке, чем продолжительность физиологического транзита через желудок. Для всасывания высоколипофильных ЛС, плохорастворимых в водной среде ЖКТ, также необходимы специальные ЛФ, обеспечивающие их дисперсию в водной среде. С целью повышения всасывания плохорастворимых ЛС используется несколько технологий: солидные дисперсии АФИ, микрочастицы для увеличения площади поверхности, системы носителей (полимерный мицелий, микроэмульсии и др.). ЛФ с модифицированным высвобождением позволяют решать все основные задачи: изменять скорость и продолжительность высвобождения АФИ, место высвобождения АФИ, а также интенсивность терапевтического эффекта ЛС. Кроме того, пероральные системы доставки ЛС имеют дополнительные свойства: защита ЛС от деградации в ЖКТ под влиянием соляной кислоты и пищеварительных ферментов, увеличение времени транзита в верхних отделах ЖКТ, улучшение проницаемости через эпителиальные барьеры.
Общая характеристика ЛФ с модифицированным высвобождением.
По строению различают 4 типа ЛФ с модифицированным высвобождением:
1) монолитные (матриксные) системы;
2) резервуарные (мембранные) системы;
3) насосные (осмотические) системы;
4) системы на основе множественных пеллет.
По механизму высвобождения АФИ может высвобождаться из ЛФ с помощью диффузии в растворимых системах (растворимый матрикс, полупроницаемая оболочка) или через нерастворимую оболочку (для резервуарных типов) или нерастворимый матрикс (для монолитных типов) после набухания или биодеградации. Осмотическая система обеспечивает высвобождение АФИ вследствие образующегося осмотического давления в резервуаре, содержащем молекулы АФИ.
Монолитные системы. Основу монолитной системы составляет матрикс, который может характеризоваться различными физико-химическими свойствами, быть растворимым (гидрофильным) или нерастворимым (гидрофобным), но способным к набуханию, биодеградации (Jonsson U.E., 1990) (рис. 1).

Схема высвобождения ЛВ из различных матриксных систем (Jonsson U.E., 1990) (здесь и далее ЛВ — лекарственное вещество)
Гидрофильный матрикс способен впитывать большое количество воды без растворения (например гидрогели) и используется для высвобождения гидрофильных ЛС. Гидрофобные матриксы нерастворимы в воде, но способны к набуханию в присутствии жидкости или биодеградации путем гидролиза или химических превращений, при этом в них появляются микропоры, эрозии и микроканалы, через которые высвобождается АФИ. АФИ может быть физическим или химическим способом соединено с матриксом, что также определяет механизм и кинетику высвобождения. АФИ может высвобождаться из матрикса путем диффузии или вымыванием (трением) из деградируемого матрикса. Диффузия АФИ через растворимый матрикс не может обеспечить кинетику «нулевого» порядка, то есть контролировать постоянную скорость высвобождения и стабильную концентрацию в крови. Если же высвобождение контролируется не только диффузией АФИ, но и биодеградацией матрикса, то может быть достигнута кинетика «нулевого» порядка. Для достижения кинетики высвобождения «нулевого» порядка прибегают также к использованию смешанных систем — сочетание матриксного и резервуарного типа (Ari ns E.J., 1990).
Резервуарные системы. Резервуарная система состоит из оболочки (мембраны), которая образует резервуар, и ядра, в котором находится АФИ. Высвобождение АФИ контролируется свойствами оболочки и осуществляется главным образом диффузией через поры мембраны, образующиеся после изменения ее проницаемости вследствие растворения, набухания или биодеградации. Если ее толщина не изменяется, то процесс высвобождения АФИ описывается кинетикой «нулевого» порядка (Ari ns E.J., 1990).
Осмотические системы. Пероральные осмотические системы (технология OROS — oral osmotic, «Alza Corp.») имеют форму обычных таблеток и включают общий резервуар, содержащий АФИ и осмотическое вещество, и наружную полупроницаемую оболочку; в резервуаре находится отверстие, которое производится с помощью лазерного луча (диаметром 300–500 микрон), — через него происходит высвобождение АФИ (рис. 2а). Механизм действия осмотической системы заключается в том, что через ригидную полупроницаемую оболочку (мембрану) начинает поступать жидкость из ЖКТ, растворяя ядро АФИ и приводя к расширению осмотическое вещество, создающее осмотическое давление, в результате которого АФИ выдавливается через отверстие со скоростью, равной скорости проникновения в систему жидкости (контролируемая скорость высвобождения). Кинетика высвобождения из такой осмотической системы обеспечивает выход до 85% АФИ по кинетике «нулевого» порядка. Для нерастворимых или, наоборот, избыточно растворимых АФИ используется двухкамерная форма осмотической системы, в которых резервуар разделен эластичной непроницаемой перегородкой: верхняя камера содержит АФИ, нижняя камера — осмотическое вещество, а наружная оболочка отдельно контролирует поступление воды в каждую камеру (рис. 2б).

Схема строения пероральной осмотической системы (а) и системы с дополнительной эластической перегородкой (б)
Осмотические системы доставки предназначены для контролируемого высвобождения с кинетикой «нулевого» порядка, поэтому получили название гастроинтестинальной терапевтической системы (ГИТС). Дополнительно пероральные осмотические системы могут покрываться кишечно-растворимой оболочкой для предупреждения активации системы в желудке, что важно для нестабильных в кислой среде ЛС. Пероральные осмотические системы обычно очень стабильны в ЖКТ, действуют только в присутствии жидкости, не чувствительны к колебаниям рН, положению в ЖКТ, присутствию содержимого в кишечнике, моторике; продолжительность их действия ограничена временем транзита по ЖКТ (Theeuwes F., 1979). После транзита по ЖКТ оболочка экскретируется.
Пероральные ЛФ с модифицированным высвобождением могут быть представлены единой системой или системой из множественных микрогранул или микрокапсул (пеллет) диаметром 1–2 мм, которые размещены в матриксе или заключены в капсулу (спансулу) (multiunit pellet system — MUPS) (Sandberg A. et al., 1988). Каждая пеллета содержит ядро с АФИ, покрытое полимерной оболочкой или многослойной оболочкой из растворимых и нерастворимых полимеров, контролирующих скорость высвобождения АФИ (технология SODAS «Elan Corp.»). Таблетка (спансула) после поступления в ЖКТ распадается на пеллеты, которые свободно распределяются в ЖКТ. Процесс высвобождения АФИ из пеллет происходит в несколько фаз: проникновение воды через оболочку внутрь пеллеты, постепенное растворение ядра АФИ и диффузия через мембрану с постоянной скоростью; кинетика высвобождения АФИ из такой системы обычно описывается кинетикой «нулевого» порядка в течение 20 ч (Sandberg A. et al., 1988). Такая система имеет ряд преимуществ: может иметь форму таблетки, капсулы, гибкость дозирования — таблетки можно делить, можно комбинировать 2 лекарственных препарата, такая система исключает случайный выход всего АФИ сразу при повреждении наружной оболочки таблетки или капсулы. Вся система или пеллеты могут иметь дополнительную кишечно-растворимую оболочку для локализации места высвобождения и всасывания ЛС.
ЛФ с модифицированным высвобождением различаются по степени управления процессом высвобождения (контролируемое высвобождение, пролонгированное или замедленное высвобождение) и кинетике высвобождения (непрерывное, прерывистое, отсроченное, пульсирующее) (Коржавых Э., Румянцев А., 2003).
КАРДИОЛОГИЯ
Основные проблемы использования кардиоваскулярных ЛС профессор М.В. Леонова связывает с низкой и вариабельной биодоступностью, короткой продолжительностью действия, требующей 3–4-кратного приема в сутки, что является причиной недостижения желаемой эффективности и прекращения приема препаратов. Поэтому ЛФ с модифицированным высвобождением для кардиоваскулярных препаратов позволяют успешно решать существующие клинические проблемы. К ЛФ с модифицированным высвобождением кардиоваскулярных препаратов относятся следующие.
1. ЛФ, улучшающие растворимость, всасывание и повышающие биодоступность ЛС. Это достигается химическими методами, например с помощью образования хорошорастворимых солей и комплексов АФИ или пролекарств; другими технологиями, например с помощью оболочек, позволяющих устранять влияние рН, полярность молекул АФИ и предотвращать преждевременное высвобождение и инактивацию АФИ в желудке.
Отдельную проблему представляет пероральное назначение ЛС, имеющих узкое «окно всасывания» (Davis S.S., 2005). Понятие «окно всасывания» характеризует период времени и локализацию всасывания ЛС в ЖКТ. «Окно всасывания» зависит не только от физиологии ЖКТ, но и от физико-химических свойств ЛС; наиболее важными из них, определяющими всасывание в ЖКТ, являются стабильность и растворимость АФИ, проницаемость кишечного эпителия и время транзита в тех отделах ЖКТ, в которых происходит максимальное всасывание ЛС. Узкое «окно всасывания» определяется коротким временем транзита ЛС в верхних отделах ЖКТ, в которых происходит максимальное всасывание большинства ЛС, и в течение короткого периода (менее 6 ч) ЛФ поступают в дистальные невсасывающие отделы ЖКТ. Поэтому даже для ЛФ с замедленным высвобождением оптимального всасывания в ЖКТ не происходит, что в результате приводит к снижению биодоступности препарата.
 Для повышения всасывания ЛС, имеющих узкое «окно всасывания», создаются специальные ЛФ, задерживающиеся в желудке, что обеспечивает пролонгирование фазы всасывания с контролируемым или замедленным высвобождением АФИ в желудке (табл. 1). Технологии создания задерживающихся в желудке ЛФ основаны на: а) использовании увеличения в объеме или расширения формы in vivo, б) изменении удельной плотности формы (флотирующие ЛФ), в) применении биоадгезивных технологий.
Для повышения всасывания ЛС, имеющих узкое «окно всасывания», создаются специальные ЛФ, задерживающиеся в желудке, что обеспечивает пролонгирование фазы всасывания с контролируемым или замедленным высвобождением АФИ в желудке (табл. 1). Технологии создания задерживающихся в желудке ЛФ основаны на: а) использовании увеличения в объеме или расширения формы in vivo, б) изменении удельной плотности формы (флотирующие ЛФ), в) применении биоадгезивных технологий.
2. ЛФ с замедленным или контролируемым высвобождением, различающиеся кинетикой высвобождения. ЛФ с контролируемым высвобождением характеризуются изменением времени высвобождения АФИ в соответствии с требуемыми характеристиками терапевтического эффекта и должны отвечать следующим условиям:
1) процесс высвобождения АФИ должен описываться известным видом математической зависимости;
2) высвобождение АФИ должно происходить по заданной скоростной программе;
 3) процесс высвобождения не должен зависеть от влияния различных физиологических или патологических факторов (прием пищи, действие ферментов и и.п.) и определяться только параметрами самой системы (Коржавых Э., Румянцев А., 2003). Таким образом, процесс высвобождения АФИ характеризуется предсказуемостью и точностью по скорости, продолжительности и месту высвобождения, что позволяет прогнозировать развитие терапевтического эффекта. К таким ЛФ относятся желудочно-кишечные терапевтические системы (ГИТС) и другие системы, обеспечивающие кинетику «нулевого» порядка (ZOK, XL, CR). Если какое-либо условие не выполняется, то ЛФ относится к пролонгированным. ЛФ с пролонгированным или замедленным высвобождением также должны отвечать определенным требованиям: обеспечивать оптимальную концентрацию АФИ без сильных колебаний в течение длительного времени; используемые вспомогательные вещества должны быть безвредными для организма и полностью выводиться; используемые технологии должны быть простыми и доступными. К таким ЛФ относится большинство пероральных ретардных форм (табл. 2).
3) процесс высвобождения не должен зависеть от влияния различных физиологических или патологических факторов (прием пищи, действие ферментов и и.п.) и определяться только параметрами самой системы (Коржавых Э., Румянцев А., 2003). Таким образом, процесс высвобождения АФИ характеризуется предсказуемостью и точностью по скорости, продолжительности и месту высвобождения, что позволяет прогнозировать развитие терапевтического эффекта. К таким ЛФ относятся желудочно-кишечные терапевтические системы (ГИТС) и другие системы, обеспечивающие кинетику «нулевого» порядка (ZOK, XL, CR). Если какое-либо условие не выполняется, то ЛФ относится к пролонгированным. ЛФ с пролонгированным или замедленным высвобождением также должны отвечать определенным требованиям: обеспечивать оптимальную концентрацию АФИ без сильных колебаний в течение длительного времени; используемые вспомогательные вещества должны быть безвредными для организма и полностью выводиться; используемые технологии должны быть простыми и доступными. К таким ЛФ относится большинство пероральных ретардных форм (табл. 2).
Замедленное высвобождение может быть достигнуто физико-химическими свойствами матрикса, в котором находится АФИ: медленно распадающимся полимерным веществом, способным к набуханию (гидрогели), биодеградации или образованию пор; АФИ может быть комплексовано с плохорастворимым веществом матрикса (например ионообменные резины). Гидрогели впервые были созданы для пероральных ЛФ с замедленным высвобождением благодаря своей способности к набуханию. В результате набухания в гидрогеле образуются ячейки или поры определенного размера; если размер молекул АФИ больше размера ячеек гидрогеля — происходит замедленное его высвобождение (Lin C-C., Metters A.T., 2006). Обычно ЛС, для которых существует необходимость создания систем замедленного высвобождения, имеют значимую взаимосвязь между концентрацией и развитием фармакодинамических эффектов, в том числе и побочных. Для таких ЛС очень важно устранение «пиковых» концентраций, чтобы уровень концентрации удерживался в определенном диапазоне для предотвращения развития токсических или «пиковых» концентраций. Это клинически важно для препаратов с узким терапевтическим индексом, имеющих концентрационнозависимые токсические побочные эффекты (антиаритмические препараты, дигоксин и др.), а также для препаратов, имеющих концентрационнозависимые нежелательные эффекты, ухудшающие переносимость терапии (нитраты, антагонисты кальция, блокаторы 1-адренорецепторов и др.). Использование ЛФ с контролируемым или замедленным высвобождением способствует уменьшению кратности приема ЛС до 1–2 раз в сутки, что повышает комплаентность больных и клиническую эффективность фармакотерапии, улучшает ее переносимость.
Проблемой создания ЛФ с замедленным высвобождением является ограниченное время физиологического транзита по ЖКТ, составляющее не более 12 ч. Для увеличения продолжительности высвобождения АФИ из таких ЛФ используются технологии, способствующие замедлению желудочно-кишечного транзита, пролонгируя время действия ЛФ до 24 ч. Для увеличения продолжительности действия пероральных ЛФ более 24 ч используются буккальные системы доставки (биоадгезивные ЛФ — пленки, пластыри), которые обеспечивают высвобождение АФИ в полости рта с последующим всасыванием как в полости рта, так и в результате глотания в ЖКТ. В создании таких форм применяются мукоадгезивные технологии, а также технологии замедленного высвобождения (присутствие в пластырях дополнительного слоя, контролирующего высвобождение АФИ), пролонгирующие время высвобождения и всасывания АФИ. Дополнительными преимуществами буккальных ЛФ являются: устранения эффекта пресистемного метаболизма ЛС в портальной системе печени, в результате повышается биодоступность для таких ЛС; предупреждение разрушения ЛС в условиях ЖКТ, действие кислоты, протеолитических и других пищеварительных ферментов; быстрое начало действия, что может иметь клиническое значение для некоторых ЛС; повышение комплаентности пациентов (ЛС более удобны при приеме — не требуют запивания, проглатывания, сокращается кратность приема препарата). Буккальные ЛФ имеют следующие кардиоваскулярные препараты: антагонисты кальция (дилтиазем, нифедипин), блокаторы -адренорецепторов (пропранолол, метопролол, пиндолол).
3. ЛФ с пульсирующим или прерывистым высвобождением отличаются способностью к высвобождению АФИ в детерминированное время или через определенный период времени, в необходимом месте и в необходимом количестве, обеспечивая хронотерапевтические подходы в соответствии с циркадными ритмами функционирования физиологических и гуморальных систем организма или патогенезом, клиническими особенности манифестации некоторых заболеваний; они получили название «хронотропные» (Bryan J., 2005; Arora S. et al., 2006). В таких системах АФИ высвобождается отсроченно через латентный период (lag period) или прерывисто порциями в необходимые периоды времени после приема, поэтому такие системы получили название «времязависимых» (time-controlled). «Хронотропные» системы доставки имеют резервуарный тип; механизм высвобождения АФИ из таких систем включает диффузию через эрозии полимерной оболочки, использования многослойных оболочек, полупроницаемых или разрывающихся оболочек под действием различных стимулов (Youan B.C., 2004). Латентный период регулируется толщиной и проницаемостью оболочки. В создании систем с пульсирующим высвобождением АФИ используются модификации осмотических систем (использование эластомеров для полупроницаемой оболочки, изменяющих величину отверстия и создающих латентные периоды; включение внутренней подвижной мембраны между камерами с АФИ и осмотическим веществом, движение которой регулируется наличием на внутренней поверхности оболочки специальных стопоров, контролирующих прерывистое ее движение и латентные периоды; включение в состав системы дополнительной полимерной оболочки, обеспечивающей создание латентного периода), системы на основе множественных пеллет (модификация толщины и проницаемости оболочек для разных популяций пеллет внутри одной системы).
ЛФ с модифицированным высвобождением могут быть важны для ЛС с очень коротким периодом полувыведения (T1/2), которые требуют многократного применения в сутки, или имеющих, наоборот, очень большой период полувыведения для устранения «пиковых» концентраций в крови, а также для препаратов с узким терапевтическим индексом для предупреждения развития токсических концентраций в крови. Клиническое значение ЛФ с модифицированным высвобождением определяется получением более стабильных и предсказуемых концентраций АФИ в плазме крови в рамках терапевтического коридора (рис. 3), что сопровождается стабильностью терапевтического эффекта в течение интервала дозирования, снижением развития концентрационнозависимых побочных эффектов, повышением приверженности больных терапии (Kellaway I.W., 1988). Данные технологии направлены на изменение всасывания; фармакокинетический профиль таких ЛФ должен обеспечивать времязависимый эффект ЛС в течение интервала дозирования для оптимизации их терапевтического действия.
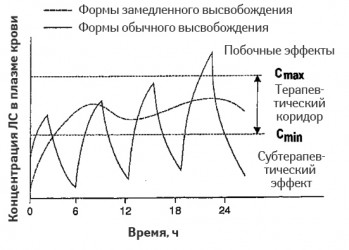
Сравнительные кривые концентраций АФИ в плазме крови после 4-кратного приема препарата ЛФ обычного высвобождения и 1-кратного приема препарата ЛФ с контролируемым высвобождением
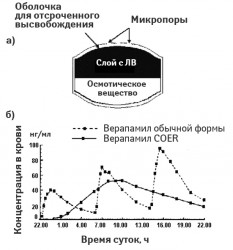
Строение ЛФ верапамила с отсроченным высвобождением COER (СOVERA HS) (а) и сравнение динамики концентрации АФИ после ее приема с верапамилом обычного высвобождения
В качестве примера оратор охарактеризовала ЛФ с модифицированным высвобождением для препаратов группы антагонисты кальция, которые широко используются в клинической практике кардиолога и относятся к основным классам антигипертензивных и антиангинальных препаратов. Для их использования в качестве антигипертензивных средств необходимо времязависимое гипотензивное действие в течение 24 ч. Только 24-часовой контроль за уровнем артериального давления обеспечивает защиту органов-мишеней артериальной гипертензии, а наличие «остаточного» эффекта в конце интервала дозирования (в ранние утренние часы) предупреждает развитие сердечно-сосудистых осложнений (инфаркта миокарда, инсульта, внезапной смерти). Для решения таких задач создано целое поколение антагонистов кальция с модифицированным высвобождением (табл. 3; рис. 4).
АНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯ
Вопрос рациональной антибактериальной терапии сегодня актуален как никогда. Для этого есть много причин, каждая из которых требует адекватного решения и индивидуального подхода. Современная медицина находится в условиях глобального распространения резистентных и полирезистентных штаммов возбудителей многих инфекционных заболеваний, связанного в значительной степени с неправильным использованием антибактериальных препаратов как со стороны врача, назначившего ЛС, так и со стороны пациента, не соблюдающего врачебные предписания. Поэтому от целесообразности использования антибактериальных препаратов зависит эффективность лечения инфекций в настоящем и будущем. Преследуя цель повысить эффективность антибиотикотерапии, нельзя забывать о безопасности лечения. В настоящее время вопросу фармакобезопасности уделяется пристальное внимание как при разработке новых препаратов и проведении клинических испытаний, так и после регистрации в процессе широкого использования лекарства.
| Таблица 3 | Характеристика ЛФ антагонистов кальция модифицированного высвобождения |
| ЛФ | Характеристика | АФИ | Препараты |
| Таблетки с замедленным высвобождением (SR/ER) | Матриксный тип. Длительность действия 12–24 ч | ВерапамилДилтиаземНифедипин | Изоптин SR (Knoll AG)Calan SR (Pfizer)Верогалид ER (IVAX/Galena)
Дилтиазем Ланнахер (Lannacher) Дилкардия SR (Unique) Коринфар-ретард (AWD) Кордафлекс (Egis) Никардия CD-ретард (Unique) Кордипин-ретард (KRKA) Кордипин XL (KRKA) Коринфар УНО (AWD) |
| Таблетки рапид-ретард (SL) | Матриксная система с микрогранулами 2-фазного высвобождения.Длительность действия 12 ч | НифедипинНикардипин | Адалат SL (Bayer AG) |
| Таблетки с контролируемым высвобождением | Двухслойные системы с наружным слоем гидрогеля и внутренним ядром.Длительность действия 24 ч | НифедипинФелодипинНисолдипин | Адалат СС (Bayer AG)Плендил ER (AstraZeneca)Sular CC (Bayer AG) |
| Таблетки с контролируемым высвобождением | Система микрокапсул с растворимой оболочкой, контролирующей высвобождение (пеллеты) (технология SODAS).Длительность действия 24 ч | Нифедипин | Нифекард XL (Lek) |
| Капсулы с контролируемым высвобождением | ДилтиаземВерапамил | Дилакор XR (Rhone-Poulenc)Cardizem CD (Biovail)Алтиазем RR (Lusopharmaco)
Verelan (Schwartz) Ломир SRО (Sandoz) |
|
| Таблетки с контролируемым отсроченным высвобождением | Система пеллет с многослойными оболочками, обеспечивающими латентный период (технология CODAS);Система осмотического действия с отсроченным высвобождением.Длительность действия 24 ч | ВерапамилВерапамил | Verelan PM (Schwartz)Covera HS (Pfizer) |
| Желудочно-кишечные терапевтическиесистемы (ГИТС) | Система осмотического действия с контролируемым высвобождением.Длительность действия 24 ч | Нифедипин | ОСМО-Адалат (Bayer AG)Procardia XL (Pfizer) |
Клиническая эффективность антибактериальной терапии зависит от комплаентности больных. Профессор М. Леонова посетовала на то, что в реальной практике — например при лечении инфекций дыхательных путей — комплаентность к антибактериальной терапии является низкой — около 61%. Причем страдает не только выполнение режима приема препарата в течение суток, но и выполнение длительности курса терапии: у больного улучшилось состояние, перестал мучить кашель — через три дня пациент бросает прием противомикробных средств (хотя это не значит, что пациент вылечился; длительность курсов антибактериальной терапии обоснована и доказана). К основным предикторам некомплаентности относят:
- длительность терапии (относительный риск (ОР) 2,95);
- кратность более 3 раз (ОР 2,47);
- неадекватный контакт врач — пациент (ОР 1,87).
При комплаентности менее 80% — клинический эффект составляет менее 59% (Reyes H. et al., 1997; Anastasio G.D. et al., 1994), при дальнейшей потере комплаентности эффективность продолжает падение в геометрической прогрессии. Этого допустить невозможно, поэтому для повышения эффективности и комплаентности необходимо использовать антибактериальные препараты пероральных ЛФ с модифицированным высвобождением.
Существуют различные ЛФ антибиотиков: для перорального, парентерального и местного использования. Каждая из этих ЛФ имеет свои преимущества и недостатки, которые касаются в основном фармакокинетических характеристик и профиля переносимости. Поэтому современные разработки направлены не только на создание совершенно новых субстанций, но и на улучшение фармакокинетических свойств существующих антибиотиков, что важно для обеспечения их фармакодинамических свойств, а также позволяет существенным образом повысить комплаентность (приверженность пациентов лечению), уменьшить число нежелательных эффектов и добиться лучших терапевтических результатов. Пероральные ЛФ антибиотиков имеют большое значение для амбулаторной практики лечения инфекций. Достижение высокой клинической эффективности антибактериальной терапии в амбулаторных условиях зависит от комплаентности пациентов: несоблюдение режима приема препаратов, а также досрочное прекращение приема в связи с быстрым улучшением состояния неблагоприятно влияют на исход лечения, приводят к развитию хронизации процесса, рецидивов и формированию микробной резистентности. Для оптимизации режимов антибиотикотерапии созданы пероральные ЛФ с модифицированным высвобождением. Среди инновационных разработок докладчик отвела достойное место ЛФ, которые обеспечивают равномерную дисперсию (растворение) частиц, так называемые растворимые формы на основе технологии «Солютаб». Для них характерны особенности в фармакокинетике, направленные на повышение абсорбции и биодоступности препарата при приеме внутрь. Основные и принципиальные различия между обычной и растворимой ЛФ антибиотиков, изготовленных по технологии «Солютаб», представлены в табл. 4 (каждое из положений которой подтверждено результатами лабораторных и клинических исследований).
| Таблица 4 | Основные сравнительные характеристики обычных и растворимых пероральных ЛФ антибактериальных препаратов |
| Характеристика | Обычная форма | Форма «Солютаб» |
| Фармакокинетика:всасывание | Необходимость определенного времени для растворения оболочки; неоднородность высвобождающихся частиц ЛВ; непрогнозируемое высвобождение на ограниченном участке ЖКТ; вариабельность полноты всасывания | Большая площадь поверхности всасывания, обеспечивающая равномерное нарастание концентрации в крови; стабильная полнота всасывания |
| Воздействие на кишечник | Большая остаточная концентрация ЛВ в кишечнике, что приводит к неблагоприятному воздействию на его микрофлору | Минимальное воздействие на микрофлору кишечника |
| Ограничения использования у взрослых | Трудности применения у «лежачих» больных — необходимость находиться в вертикальном положении не менее 5–10 мин | Возможность применения «лежачими» больными (отсутствие необходимости в вертикализации); нельзя растворять в высокоминерализированной воде, прохладительных напитках |
| Применение в педиатрии | Невозможность (или затруднение) проглатывания детьми младшего возраста; необходимость дополнительной детской ЛФ (суспензии, сиропы) | Возможность применения у взрослых и детей; таблетки можно проглатывать целиком или растворять в воде |
Одной из главных целей при создании формы «Солютаб» является повышение комплаентности пациентов, поскольку высокая антибактериальная активность препарата теряет свое значение без должной приверженности пациента лечению. Главный принцип технологии «Солютаб» — это контролируемое высвобождение препарата, обеспечиваемое микрочастицами, состоящими из активного вещества, связанного с неактивным наполнителем. После приема цельной или растворенной таблетки «Солютаб» начинается контролируемое высвобождение препарата: через 10–30 сек микрочастицы таблетки равномерно распределяются в желудке и начинают высвобождение. Процесс высвобождения ЛВ контролируется скоростью проникновения воды в микрочастицы в желудке, так что полное высвобождение препарата происходит при достижении препаратом «окна абсорбции», то есть двенадцатиперстной кишки. Это обеспечивает постоянную и максимальную биодоступность и отсутствие остаточной концентрации в ЖКТ: по такой технологии изготовлены многие ЛФ антибактериальных средств.
В заключение профессор М. Леонова подытожила, что новые технологии и системы высвобождения пероральных ЛФ в настоящее время характеризуются наибольшим многообразием. Для дифференцированного выбора пероральных ЛФ и правильного режима их назначения необходимо знание особенностей их строения и кинетики высвобождения, а также изменений фармакокинетики, связанных с модификацией ЛФ. Важно понимать особенности режима назначения и приема ЛФ с модифицированным высвобождением: их нельзя крошить, растворять, рассасывать в полости рта, а также делить дозу (если нет особых указаний или разделительной риски). ЛФ с модифицированным высвобождением используются только для длительной поддерживающей терапии сердечно-сосудистых заболеваний, они не применяются в неотложных ситуациях, так как не оказывают быстрого эффекта. При рациональном применении ЛФ с модифицированным высвобождением кардиоваскулярных препаратов можно добиться оптимизации фармакотерапии наиболее важных сердечно-сосудистых заболеваний (артериальная гипертензия, ишемическая болезнь сердца), противомикробых средств — оптимизировать режимы антибиотикотерапии, в конечном итоге — получить возможность хронотерапевтического и индивидуального подхода в зависимости от клинических потребностей и особенностей больного.
*Продолжение. Начало (часть 1, 2) см.: «Еженедельник АПТЕКА» № 16 (737) от 26 апреля 2010 г. (www.apteka.ua/article/38438) и № 17 (738) от 3 мая 2010 г. (www.apteka.ua/article/38965).«Человек и лекарство» — 2010 Часть 2. Лекарственная независимость страны в призме лекарственной безопасности пациента: проблемы и приоритеты, стратегии и тактики РФ

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим