 — Виктор Тимофеевич, давайте рассмотрим проблему реформирования на примере системы оборота лекарственных средств. Чтобы понимать, как ее решать, нужно определить отправную точку. Скажите, пожалуйста, на каком этапе сегодня находится Украина в контексте обеспечения качества, эффективности и безопасности лекарственных средств?
— Виктор Тимофеевич, давайте рассмотрим проблему реформирования на примере системы оборота лекарственных средств. Чтобы понимать, как ее решать, нужно определить отправную точку. Скажите, пожалуйста, на каком этапе сегодня находится Украина в контексте обеспечения качества, эффективности и безопасности лекарственных средств?
— Согласно закону Украины о лекарственных средствах качество лекарственного средства — это совокупность свойств, которые: а) заключаются в его способности удовлетворять потребителей в соответствии со своим назначением и б) соответствуют требованиям, установленным законодательством. Если вопросы фармацевтического качества, пусть бессистемным образом, но все же решаются, то в части удовлетворения потребителя в соответствии с назначением препарата у нас совсем плохо. Ведь на самом деле речь идет об обеспечении лечебного процесса. А он, как известно, происходит при участии врача или фармацевтического работника.
На сегодня у нас сложился следующий парадокс. Чуть ли не каждый год создаются комиссии, которые выясняют, насколько система регистрации лекарственных средств в Украине соответствует международным и, в частности, европейским требованиям. И на эти исследования выделяются существенные ресурсы.
Однако процессы, связанные с другими этапами оборота лекарственных средств, в том числе обеспечением качества препаратов при их производстве и реализации, остаются практически без внимания со стороны экспертов. Может, это происходит потому, что Государственная служба Украины по лекарственным средствам и контролю за наркотиками (далее — Гослекслужба) входит в Систему сотрудничества фармацевтических инспекций (Pharmaceutical Inspection Cooperation Scheme — PIC/S), и эксперты полагают, что этого уже достаточно. А может, потому, что спорить с чиновниками себе дороже. Но отсутствие в украинском законодательстве четко регламентированных процедур контроля за соблюдением требований надлежащей производственной практики (GMP) остается нерешенной проблемой, но не для всех производителей.
Зарубежная Фарма получила огромную преференцию от Украины в виде автоматического признания сертификатов GMP, выданных регуляторными органами — членами PIC/S, и не только это. В результате в сфере допуска препаратов на рынок возникли двойные стандарты, ведь дерегуляция коснулась только зарубежных производителей. Поэтому они защищены от коррупционных рисков, а отечественные — нет. При этом государственное предприятие «Государственный экспертный центр МЗ Украины» (далее — ГЭЦ) постоянно оказывается в фокусе внимания правоохранительных органов.
— По Вашему мнению, будет ли способствовать принятию эффективных решений создание единого регуляторного органа, о котором уже давно идут дискуссии в экспертных кругах?
— Действительно, о едином регуляторном органе говорят много, подразумевая, что он будет выполнять функции Гослекслужбы и ГЭЦ. Но надо понимать, что ГЭЦ — это экспертный орган, а решение о допуске препарата на рынок остается за профильным министерством. И до недавнего времени оно и было единым регуляторным органом.
На что здесь важно обратить внимание? Чиновники Министерства здравоохранения и Гослекслужбы не занимаются проверками соблюдения требований GMP и экспертизой регистрационных документов. Они лишь подписывают разрешения в виде лицензии, сертификатов GMP или регистрационных свидетельств на основании заключений, подготовленных экспертами.
— Где работают эти эксперты, кто им платит и куда идут деньги от оплаты экспертных работ?
— В сфере регистрации лекарственных средств в Украине существует экспертная организация — ГЭЦ. Ее деятельность предусмотрена постановлением КМУ от 26.05.2005 г. № 376. Требования к документам и процедурам по созданию и исследованию препаратов, а также экспертизе регистрационных материалов определены приказом МЗ Украины 23.07.2015 г. № 460 и еще несколькими приказами Министерства, регламентирующими доклинические и клинические исследования лекарственных средств, а также мероприятия по фармаконадзору. Эти процедуры регулярно пересматриваются с целью гармонизации с принципами, изложенными в Директиве ЕС 2001/83.
В сфере лицензирования и подтверждения соответствия GMP при Гослекслужбе существуют государственные предприятия — , и ряд частных компаний, которые оказывают консалтинговые услуги в этой сфере. Но при этом нормативные документы, регламентирующие работу этих экспертных организаций, отсутствуют. Также в нашем законодательстве отсутствуют требования к процедурам экспертизы, экспертам и проверкам, в которые они вовлекаются. Как используются средства, полученные за платные услуги, оказываемые вышеупомянутыми предприятиями, тоже мало кого интересует.
— Как, по Вашему мнению, можно урегулировать работу экспертных организаций?
— Оборот лекарственных средств можно рассмотреть в контексте административной реформы, утвержденной постановлением КМУ от 18.08.2017 г. № 644. Среди прочего этот документ предусматривает создание в составе МЗ Украины директоратов.
Схема взаимодействия директоратов МЗ очень напоминает Концепцию административной реформы, предусмотренной Указом Президента от 22.07.1998 г. № 810/98, и она отработана в ГЭЦ. Ее суть состоит в следующем. Функции Министерства как органа, который обеспечивает удовлетворение определенных потребностей общества и государства, необходимо четко разделить. Функции, связанные с предоставлением управленческих услуг населению, подлежат широкой децентрализации, в том числе путем их делегирования хозрасчетным организациям, подчиненным Министерству.
По моему мнению, эта Концепция предусматривала европейскую модель государственного управления, когда государственные услуги, не требующие политических решений, передаются экспертным организациям. Например, если заявитель выполнил все условия, предусмотренные приказом МЗ Украины от 26.08.2005 г. № 426, что определяется экспертным путем, то он должен получить регистрационное свидетельство автоматически без бюрократических проволочек со стороны чиновника, который не изучал регистрационные документы.
— Согласно упомянутому Вами постановлению КМУ от 18.08.2017 г. № 644 в структуре директоратов будут работать экспертные группы. На каких принципах они будут осуществлять свою деятельность и за чей счет финансироваться?
— В экспертных группах будут работать государственные эксперты, но пока неизвестно, на каких принципах и за какие средства. Предполагаемая постановлением КМУ от 18.08.2017 г. № 644 схема работы директоратов скорее просто концепция. Сейчас директораты созданы путем изменения названий структурных подразделений в МЗ, но, вероятно, и их функции будут изменены. Так, например, в настоящее время фармацевтический директорат — это связующее звено между Министерством и ГЭЦ, и он вообще не занимается аптечным сектором. А ведь аптечный сегмент фармрынка — это неотъемлемая часть системы здравоохранения, принимающая участие в предоставлении медицинской помощи в амбулаторных условиях. Также в Министерстве создан директорат медицинских услуг. Но его функция ограничивается лицензированием медучреждений.
Если следовать задекларированным целям реформы здравоохранения, которые в том числе изложены в Законе Украины от 19.10.2017 г. № 2168-VIII и предусматривают регламентацию медицинских услуг, то в составе Министерства необходимо создать директорат по медицинским и фармацевтическим услугам. То есть необходимо объединить фармацевтический директорат и директорат медицинских услуг.
Но вернемся к экспертным группам. В Украине отработаны два подхода к работе экспертных групп. Первый реализован во исполнение распоряжения Президента от 19.04.2000 г. № 1085/2010 в государственном предприятии «Государственный фармакологический центр МЗ Украины», переименованном в 2011 г. в Государственный экспертный центр МЗ Украины. Схема работы предприятия приведена на рисунке.
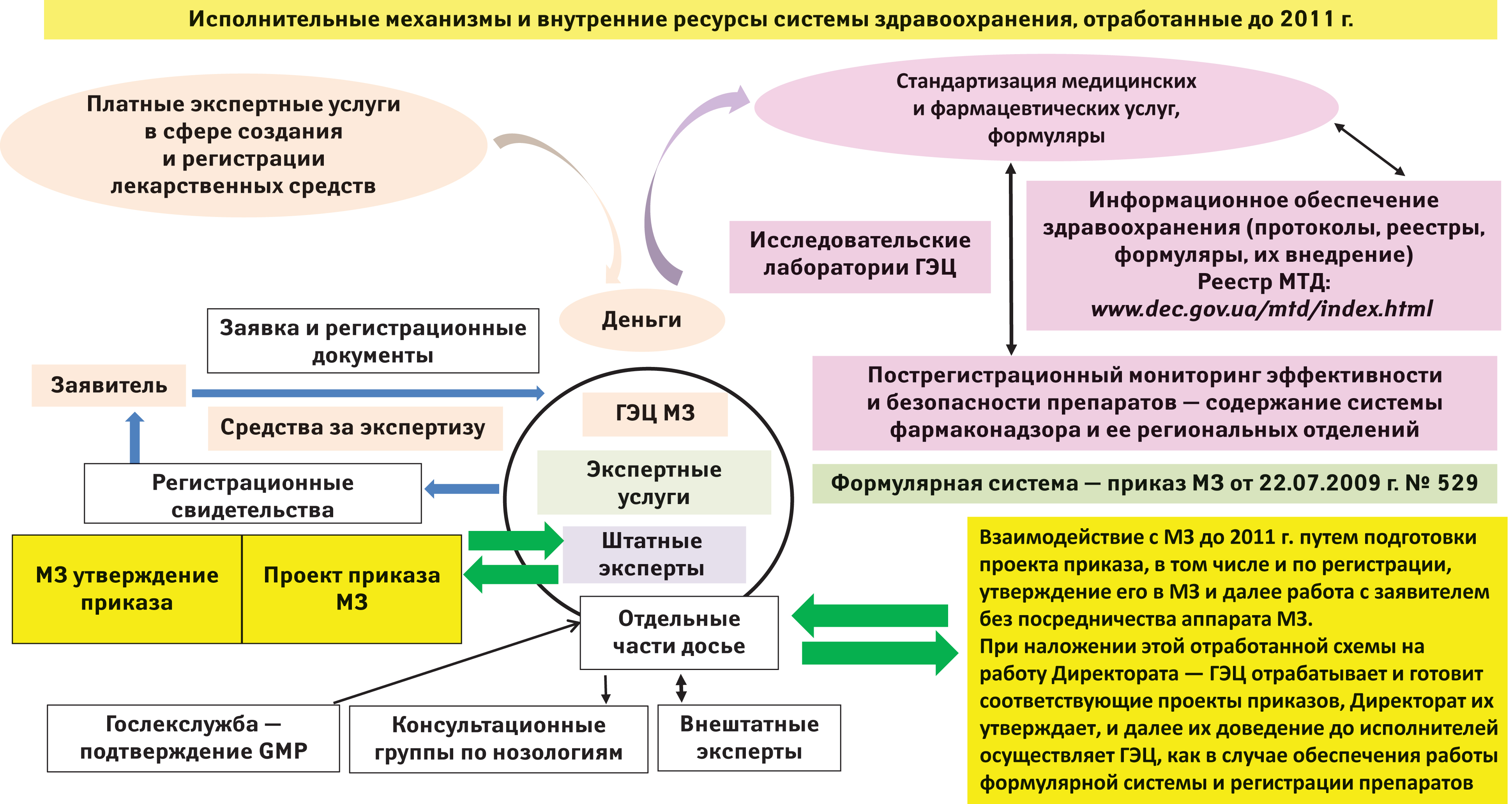
Второй подход подразумевает создание временных экспертных групп для решения проблем с привлечением кредитов, взятых под государственные гарантии, с наращиваем государственного долга, или грантов, выделенных западными государствами в качестве помощи. На такой финансовой основе создавать государственную систему вряд ли целесообразно. Пример последствий такого подхода изложен в статье доктора юридических наук Виталия Пашкова. Автор приводит опыт реализации проекта ЕС «Финансирование и управление в сфере здравоохранения в Украине» в Полтавской обл. Но результаты этих наработок остались незамеченными новыми реформаторами, поскольку после окончания финансирования экспертные группы распались, а их наработки стали малодоступными. Таким образом, если речь идет о европейском пути реформ, то в составе директората медицинских и фармацевтических услуг вместо экспертных групп должен работать ГЭЦ по схеме, приведенной на рисунке. И тогда всем будет понятно, кто, на основании какой информации (регистрационное досье на препарат) и на какие средства будет работать в государственной системе, которая и сегодня работает, но как я уже сказал, бессистемно.
— В чем заключается бессистемность?
— Из европейского законодательства бессистемно выдергиваются фрагменты без понимания сути. При этом зачастую инициаторы такой гармонизации не в курсе, что многое из европейской практики в Украине уже освоено.
На сегодня практически свернута деятельность по стандартизации доврачебных фармацевтических услуг, которые регламентированы приказом МЗ от 30.05.2013 г. № 455. Протоколы провизора, утвержденные приказом МЗ Украины от 11.10.2013 г. № 875, не обновляются и не внедряются в практику. А ведь этот документ направлен на регулирование самолечения безрецептурной группой препаратов — важнейшего компонента для обеспечения доступной и эффективной медицинской помощи в амбулаторных условиях.
Руководство Министерства утверждает, что благодаря реформе в Украине будет построена новая система здравоохранения наподобие британской. А британская система предусматривает широкий спектр доврачебной помощи, предоставляемой в аптечных учреждениях, которые в соответствии со ст. 16 Основ законодательства Украины о здравоохранении являются учреждениями здравоохранения, а не торговыми точками. Об этом подробно рассказывал Виталий Усенко, медицинский директор ПАО «Фармак».
Что касается бессистемности при реформировании системы оборота лекарственных средств, то ее, по моему мнению, можно проиллюстрировать на примере обеспечения качества препаратов после их выхода на рынок, что находится в компетенции Гослекслужбы. Логично предположить, что и эту сферу также должны затронуть реформы. Речь идет не только о работе экспертных организаций, деятельность которых должна быть прозрачной и урегулированной нормативными актами. Еще важнее гармонизировать процедуры, в частности, связанные с инспектированием производства на соответствие Лицензионным условиям в контексте соблюдения требований GMP и контроля качества лекарственных средств.
— Скажите, пожалуйста, как в ЕС регламентируются эти процедуры?
В ЕС эти процедуры регламентируются документами нормативного и процессуального характера. Идеология регулирования определена Директивой ЕС от 08.10.2003 г. № 2003/94/ЕС «Об установлении основных принципов и правил надлежащей производственной практики лекарственных средств для человека и лекарственных средств для испытаний на людях». Требования данной Директивы имплементированы в .
Процессуальный документ ЕС, который рекомендован к имплементации в странах PIC/S, то есть и в Украине — это Сборник процедур Европейского Союза по проведению инспектирования и обмену информацией ( 3 October 2014, EMA/572454/2014 Rev. 17). В этом документе четко регламентированы технические подходы к планированию и проведению инспектирования производств на соответствие правилам GMP. И до настоящего времени положения этого документа не имплементированы в украинское законодательство.
Обращаю внимание на то, что в основу европейских процедур инспектирования положен риск-ориентированный подход. Это означает что требования к производству, например, антибиотиков и ихтиоловой мази разные и зависят от уровня риска для здоровья людей вследствие применения этих препаратов. При этом в ЕС уровень риска для производства рассчитывается согласно алгоритму, приведенному в вышеупомянутом сборнике.
— Но ведь в законодательстве Украины тоже определены уровни риска. В чем заключается отличие украинского подхода от европейского?
— В Украине критерии, по которым оценивается степень риска при осуществлении деятельности в сфере здравоохранения для безопасности жизни и здоровья населения, утверждены постановлением КМУ от 10.09.2008 г. № 843. Также этим документом установлена периодичность осуществления плановых мероприятий государственного надзора (контроля). По определению, критерием, по которому оценивается степень риска при осуществлении деятельности в сфере здравоохранения для безопасности жизни и здоровья населения, является возможность причинения вреда здоровью, трудоспособности и жизни человека или здоровью будущих поколений. Согласно этому постановлению производство, оптовая и розничная реализация лекарственных средств отнесены к высокому уровню риска. То есть любое производство, будь-то активированный уголь, травяной сбор или антибиотик, относится к хозяйственной деятельности с высоким уровнем риска. Это позволяет Гослекслужбе ежегодно устраивать проверки.
В то же время методика определения критериев, утвержденная постановлением КМУ от 28.08.2013 г. № 752, требует, чтобы к высокой степени риска относилось до 10% субъектов хозяйствования, к средней — до 30% и к низкой — не более 60%. Это же абсурд — украинский подход к определению рисков, а значит, и украинские процедуры инспектирования не имеют ничего общего с европейским законодательством.
Аналогичная ситуация наблюдается и в сфере регистрации/перерегистрации лекарственных средств. Эксперты ГЭЦ много говорят о рисках и планах управления ими. В приложении 10 к Порядку проведения подтверждения соответствия условий производства лекарственных средств требованиям надлежащей производственной практики, утвержденному приказом МЗ Украины от 27.12.2012 г. № 1130, и в тексте Порядка предусмотрено, что лекарственные средства по степени риска делятся на 3 уровня — низкий, средний и высокий. Следовательно, их производство, допуск на рынок и послерегистрационный надзор также должны делиться на три уровня, чего нет в Украине.
Украина декларирует наличие у производителей GMP и участие регуляторного органа в PIC/S. «S» — это Scheme, то есть участие в PIC/S — добровольное следование схеме работы и сотрудничества фармацевтических инспекций стран ЕС и государств — членов этой организации. С вхождением в PIC/S украинский регуляторный орган взял на себя обязательство работать по этой схеме. Но на самом деле в нашей стране приняты только требования к производству, а процедуры инспектирования определяются по-украински — по индивидуальному мнению инспектора или привлеченной к инспектированию личности.
Я не сомневаюсь в том, что украинский инспекторат — это профессионалы, которые прошли обучение и получили соответствующие сертификаты. Но для производителей тоже важно знать правила и процедуры, которые применяют в своей практике инспекторы. Это как с правилами дорожного движения — их должны знать не только полицейские, но и участники движения.
— Почему для производителей так важно понимать процедуры, применяемые инспекторатом, ведь есть же Руководство по надлежащей производственной практике, Лицензионные условия и порядок их проверки, или этого недостаточно?
— Принятие нормативного документа, гармонизированного с вышеупомянутым сборником, позволит производителю принимать правильные решения уже на стадии планирования производства. Производитель будет понимать, на что в первую очередь следует обратить внимание при создании системы обеспечения качества лекарственного средства, потому что на это же обратит внимание инспектор во время проверки. А поскольку сегодня производитель и инспектор могут смотреть на один и тот же аспект по-разному, создаются существенные коррупционные риски, такие же, как во времена, когда ГАИ пряталось в кустах.
Понятно, что в решении этой проблемы не все зависит от Гослекслужбы и Министерства, но они могут инициировать обсуждение соответствующих проектов документов, гармонизированных с европейскими требованиями. Однако, к сожалению, на практике все происходит наоборот.
Так, на сайте Гослекслужбы обнародован проект постановления КМУ «Об утверждении критериев, по которым оценивается степень риска при осуществлении хозяйственной деятельности по производству лекарственных средств, оптовой и розничной торговле лекарственными средствами, импорту лекарственных средств (кроме активных фармацевтических ингредиентов), и определяется периодичность осуществления плановых мероприятий государственного надзора (контроля) Государственной службой Украины по лекарственным средствам и контролю за наркотиками», который не имеет ничего общего с процессуальным законодательством Евросоюза.
ООРММПУ предлагало альтернативный проект изменений в постановление КМУ от 10.09.2008 г. № 843, но Гослекслужба и МЗ Украины категорически не хотят его рассматривать.
Подчеркну, что для отечественного производителя гармонизация процедур инспектирования очень важна. Сейчас мы теряем рынки стран СНГ по понятным причинам и осваиваем другие, прежде всего Юго-Восточной Азии. Они менее зарегулированы, чем рынки стран ЕС.
На начальном этапе было важно, что украинский регулятор является членом PIC/S, но сегодня там уже разобрались, как выдаются в Украине сертификаты GMP, и перестали их признавать, требуют отчеты по инспектированию инспекциями стран ЕС, составленные по требованиям вышеупомянутого сборника.
— Если говорить о коррупционных рисках, то, кроме уже упомянутых Вами сфер, где они еще присутствуют?
— Еще одна сфера коррупционных рисков связана с юридическим статусом регуляторных документов и процедур. Так, в законе о лекарственных средствах отсутствует определение надлежащей производственной и других практик. В нем лишь указано, что должностные лица центрального органа исполнительной власти, реализующего государственную политику в сфере контроля качества и безопасности лекарственных средств в пределах компетенции, определенной законодательством, имеют право проверять соблюдение требований законодательства относительно качества лекарственных средств, в том числе правил осуществления надлежащих практик (производственной, дистрибьюторской, хранения, аптечной, лабораторной, клинической, регуляторной и т.д.) на всех этапах оборота.
В Украине надлежащие практики утверждены приказами МЗ Украины в виде руководств, то есть отраслевых стандартов. Статья 14 прим. Основ законодательства Украины о здравоохранении гласит, что отраслевые стандарты обязательны к исполнению, если они определены законами. Таким образом, десятки руководств до сегодня остаются документами с неопределенным юридическим статусом.
Кроме того, в Украине отсутствует реестр этих документов, включая Государственную Фармакопею Украины (ГФУ), хотя ее определение есть в законе Украины о лекарственных средствах. Однако в свободном доступе ГФУ отсутствует, то есть она стала объектом коммерческих интересов.
Я убежден, что любая, даже самая лучшая европейская норма без четко прописанных процедур — это высокий коррупционный риск.
Завершая наше интервью, сообщаю, что фармацевтический факультет Киевского национального университета технологии и дизайна разработал проект руководства на основе вышеупомянутого сборника, в котором четко прописаны риск-ориентированные подходы к проведению инспектирования в соответствии с европейской идеологией. Этот документ даже получил положительную рецензию первой в Украине кафедры промышленной, клинической фармации и клинической фармакологии Национальной медицинской академии последипломного образования имени П.Л. Шупика. Но, увы, мы по-прежнему слышим «нет» от реформаторов.
Поэтому я обращаюсь к редакции «Еженедельника АПТЕКА» с просьбой опубликовать проект руководства на вашем сайте для того, чтобы эксперты фармрынка могли с ним ознакомиться и принять консолидированное решение — нужен ли нам такой документ.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим