 Автори
Автори
Waleed Alhazzani1,2, Morten Hylander Møller3,4, Yaseen M. Arabi5, Mark Loeb1,2, Michelle Ng Gong6, Eddy Fan7, Simon Oczkowski1,2, Mitchell M. Levy8,9, Lennie Derde10,11, Amy Dzierba12, Bin Du13, Michael Aboodi6, Hannah Wunsch14,15, Maurizio Cecconi16,17, Younsuck Koh18, Daniel S. Chertow19, Kathryn Maitland20, Fayez Alshamsi21, Emilie Belley-Cote1,22, Massimiliano Greco16,17, Matthew Laundy23, Jill S. Morgan24, Jozef Kesecioglu10, Allison McGeer25, Leonard Mermel8, Manoj J. Mammen26, Paul E. Alexander2,27, Amy Arrington28, John Centofanti29, Giuseppe Citerio30,31, Bandar Baw1,32, Ziad A. Memish33, Naomi Hammond34,35, Frederick G. Hayden36, Laura Evans37, Andrew Rhodes38
Список причетних закладів
- Department of Medicine, McMaster University, Hamilton, Canada
- Department of Health Research Methods, Evidence, and Impact, McMaster University, Canada
- Copenhagen University Hospital Rigshospitalet, Department of Intensive Care 4131, Copenhagen, Denmark
- Scandinavian Society of Anaesthesiology and Intensive Care Medicine (SSAI)
- Intensive Care Department, Ministry of National Guard Health Affairs, King Saud Bin Abdulaziz University for Health Sciences, King Abdullah International Medical Research Center, Riyadh, Kingdom of Saudi Arabia
- Department of Medicine, Montefiore Healthcare System, Albert Einstein College of Medicine, Bronx, New York
- Interdepartmental Division of Critical Care Medicine and the Institute of Health Policy, Management and Evaluation, University of Toronto, Toronto, Canada
- Warren Alpert School of Medicine at Brown University, Providence, Rhode Island
- Rhode Island Hospital, Providence, Rhode Island
- Department of Intensive Care Medicine, University medical Center Utrecht, Utrecht University, the Netherlands
- Julius Center for Health Sciences and Primary Care, Utrecht, The Netherlands
- Department of Pharmacy, NewYork-Presbyterian Hospital, Columbia University Irving Medical Center, New York, NY, USA
- Medical ICU, Peking Union Medical College Hospital, 1 Shuai Fu Yuan, Beijing 100730
- Department of Critical Care Medicine, Sunnybrook Health Sciences Centre, Toronto, Ontario, Canada
- Department of Anesthesia and Interdepartmental Division of Critical Care Medicine, University of Toronto, Toronto, Ontario, Canada
- Department of Anesthesia and Intensive care, Humanitas Clinical and Research Center, Rozzano, Milan, Italy.
- Department of Biomedical Science, Humanitas University, Pieve Emanuele, Milan, Italy
- Department of Pulmonary and Critical Care Medicine, Asan Medical Center, University of Ulsan College of Medicine, Seoul, Korea
- Critical Care Medicine Department, National Institutes of Health Clinical Center and Laboratory of Immunoregulation, National Institute of Allergy and Infectious Diseases
- Faculty of Medicine, Imperial College, London
- Department of Internal Medicine, College of Medicine and Health Sciences, United Arab Emirates University, PO Box 17666, Al Ain, United Arab Emirates
- Population Health Research Institute, Hamilton, Canada
- Microbiology and Infection control, St George’s University Hospitals NHS Foundation Trust & St George’s University of London, London, UK
- Emory University Hospital, Atalanta, USA
- Division of Infectious Diseases, University of Toronto, Toronto, Canada
- Department of Medicine, Jacobs School of Medicine and Biomedical Sciences, State University of New York at Buffalo, Buffalo, USA
- GUIDE Research Methods Group, Hamilton, Canada ()
- Houston Children’s Hospital, Baylor college of Medicine, USA
- Department of Anesthesia, McMaster University, Hamilton, Canada
- Department of Medicine and Surgery, Milano-Bicocca University, Milano, Italy
- ASST-Monza, Desio and San Gerardo Hospital, Monza, Italy
- Department of Emergency Medicine, King Abdulaziz Medical City, Riyadh, Saudi Arabia
- Director, Research & Innovation Centre, King Saud Medical City, Ministry of Health, Riyadh, Kingdom of Saudi Arabia
- Critical Care Division, The George Institute for Global Health and UNSW Sydney, Australia
- Malcolm Fisher Department of Intensive Care, Royal North Shore Hospital, Sydney, Australia
- Division of Infectious Diseases and International Health, Department of Medicine, University of Virginia, School of Medicine, Charlottesville, Virginia, USA
- Department of Pulmonary and Critical Care Medicine, University of Washington, USA
- Adult Critical Care, St George’s University Hospitals NHS Foundation Trust & St George’s University of London, London, UK
Кореспонденція
Prof Andy Rhodes FRCP, FRCA, FFICM, MD(Res)
Adult Critical Care, St George’s University Hospitals NHS Foundation Trust & St George’s University of London, London, UK E-mail:
УВАГА
Ця стаття пройшла експертну перевірку та була прийнята до друку в журналах «Intensive Care Medicine (ICM)» і «Critical Care Medicine (CCM)».
Це ще не остаточний варіант, оскільки будуть здійснюватися редагування перед публікацією в остаточному вигляді з DOI.
Передбачається, що DOI остаточної версії цих настанов буде:
DOI: 10.1007/s00134-020-06022-5
Резюме
Обґрунтування
Новий штам коронавірусу SARS-CoV-2 є причиною захворювання, що швидко поширюється, — коронавірусної хвороби 2019 (COVID-19), що вражає тисячі людей по всьому світу. Необхідні термінові рекомендації для клініцистів, які працюють з найважчими пацієнтами із COVID-19.
Методи
Ми сформували робочу групу з 36 експертів з 12 країн. Усі члени групи заповнили форму щодо наявності конфліктів інтересів Всесвітньої організації з охорони здоров’я. Комісія запропонувала 53 питання, які стосуються ведення COVID-19 у відділенні інтенсивної терапії (ВАІТ). Ми шукали в науковій літературі прямі та непрямі доказові дані щодо лікування COVID-19 у важкохворих пацієнтів у ВАІТ. Були виокремлені відповідні та найновіші систематичні огляди літератури щодо більшості питань, що стосуються підтримуючої терапії. Було оцінено достовірність доказових даних з використанням принципу Градації Рекомендацій, Оцінки та Експертизи Ступеня їх Обґрунтованості (GRADE), потім створено рекомендації, основані на співвідношенні користі та шкоди, ресурсів та витрат, справедливості та доцільності. Рекомендації були або сильними, або слабкими, або у вигляді рекомендацій на основі прикладів найкращої практики.
Результати
Опубліковано 54 рекомендацій, з яких 4 — найкращі, 9 — сильні та 35 — слабкі. Стосовно 6 питань не було надано рекомендацій. Теми: 1) боротьба з інфекцією, 2) лабораторна діагностика та зразки матеріалу, 3) гемодинамічна підтримка, 4) вентиляційна підтримка та 5) терапія COVID-19.
Висновки
Опубліковано декілька рекомендацій, щоб допомогти медичним працівникам, які доглядають за тяжкохворими з COVID-19, що перебувають у ВАІТ. За доступності, ми надамо нові доказові дані в наступних випусках цих настанов.
Вступ
Наприкінці 2019 року новий штам коронавірусу, який називається SARS-CoV-2, призвів до епідемії гострих респіраторних захворювань у Вухані, Китай [1]. Всесвітня організація охорони здоров’я (ВООЗ) назвала цю хворобу коронавірусною хворобою 2019 (COVID-19).
На момент створення цієї настанови COVID-19 перетворилася на пандемію і вразила понад 120 000 осіб у більш ніж 80 країнах, а також призвела до понад 5000 смертей у всьому світі [2].
ВООЗ та Центр контролю та профілактики захворювань США (CDC) видали попередні вказівки щодо контролю, скринінгу та діагностики інфекцій у загальній популяції, однак є обмежена кількість рекомендацій щодо ведення важкохворих пацієнтів із COVID-19 у гострому періоді.
Сфера застосування
Ця настанова містить рекомендації для лікарів, які ведуть важкохворих дорослих пацієнтів із COVID-19 у відділенні інтенсивної терапії. Ця настанова створена для лікарів, що перебувають на передовій, суміжних медичних працівників та представників директивних органів, які причетні до лікування хворих на COVID-19 у відділенні інтенсивної терапії. Настанова стосується установ як високого, так і низького та середнього доходу.
Команда і Структура Настанов
Підкомітет COVID-19 Кампанії з Подолання Сепсису (SSC), відбирав членів робочої групи таким чином, щоб досягти рівноваги в експертних знаннях, географічному розташуванні та, наскільки це можливо, статі.
Робоча група SSC COVID-19 була сформована та працювала в дуже жорсткі терміни, щоб своєчасно видати рекомендації. До складу групи входили експерти з розробки настанов, боротьби з інфекціями, інфекційних захворювань та мікробіології, інтенсивної терапії, невідкладної медицини, медсестринства та охорони здоров’я. Робоча група була розділена на чотири підгрупи: 1) інфекційний контроль та тестування, 2) гемодинамічна підтримка, 3) вентиляційна підтримка та 4) терапія.
Група розробників Настанов з Розвитку та Оцінювання Інтенсивної Терапії (GUIDE) надавала методологічну підтримку впродовж всього процесу розробки настанов.
Урегулювання конфлікту інтересів
Перед долученням до складу робочої групи усі члени групи заповнили форму щодо наявності конфлікту інтересів [3, 4]. Ми використовували програмне забезпечення з інструментом для розробки настанов GRADEpro (GDT) (), щоб надати членам робочої групи форми щодо конфлікту інтересів від ВООЗ. Наявність прямих фінансових та пов’язаних з місцем роботи конфліктів інтересів неприпустима і дискваліфікує потенційного члена робочої групи. Розробка цих настанов не передбачала жодного фінансового чи нефінансового внеску з боку будь-якої компанії чи особи. Жоден член робочої групи не отримував гонорару чи іншої винагороди за будь-яку роль у процесі розробки настанов.
Методи
Процес розробки настанов узагальнений на Рисунку 1. Усі практичні запитання, на відміну від описових запитань, були структуровані у форматі «Популяція, Втручання, Контроль та Результати (PICO)» із чіткими визначеннями.
Експерти з інформаційного наповнення та методів дослідження кожної групи брали участь у розробці запитань. Формат PICO послужив основою для визначення критеріїв включення та виключення літератури та для ідентифікації відповідних досліджень.
Задля сприяння швидкій розробці рекомендацій ми не впроваджували нові підходи до визначення пріоритетності результатів, а використовували наявний принцип пріоритетності результатів, розроблений SSC настановами 2020, та висновки експертів [5]. Відповідно, ми зосередилися на лікарняній смертності та серйозних наслідках, а також інших результатах, які вважаються критичними для прийняття рішень.
Пошук літератури
Щодо деяких питань ми проводили електронний пошук серед основних баз даних, таких як Cochrane Central та MEDLINE, щоб виявити відповідні систематичні огляди, рандомізовані контрольовані дослідження (РКД), обсерваційні дослідження та дослідження серії випадків. Під час пошуку ми орієнтувались на дослідження, опубліковані англійською мовою з моменту створення до березня 2020 року. Для розробки рекомендацій щодо підтримки гемодинаміки та вентиляції ми використовували нещодавно опубліковані системні огляди та будь-які нові відповідні дослідження.
Відбір досліджень та узагальнення даних
Кілька членів робочої групи переглядали заголовки і резюме досліджень, отриманих з бібліографічних баз даних, що стосувались вибраних у форматі PICO запитань; для кожного запитання всі потенційно прийнятні дослідження оцінювались відповідно до попередньо визначених критеріїв. Експертам з інформаційного наповнення було запропоновано вказати будь-які додаткові дослідження, не виявлені пошуком. Згодом пари рецензентів незалежно відбирали дані щодо відповідних запитань PICO та пунктів, що стосуються ризику помилки.
Ми отримали дані щодо вибірки «тих, що мають наміри лікуватися» там, де це можливо; в іншому випадку ми використовували дані про всі випадки, ігноруючи відсутні дані [6].
Якість доказових даних
Ми використовували принцип Градації Рекомендацій, Оцінки та Експертизи ступеня їх Обґрунтованості (GRADE) для оцінки якості доказових даних [7], тобто нашої впевненості в ефективності рекомендації [8]. Якість рекомендацій оцінювалась як висока, помірна, низька або дуже низька [9]. Ми використовували програмне забезпечення GDT () для формування профілю доказовості (загальне викладення доказових даних) [10].
Використання непрямих доказових даних
Зважаючи на недавню появу COVID-19, ми передбачали нестачу прямих доказових даних, і тому використовували заздалегідь визначений алгоритм, щоб вирішити, чи можуть непрямі доказові дані дати якусь інформацію щодо конкретного запитання (Рисунок S1-2).
Робоча група SSC COVID-19 вирішувала, на яку групи населення слід екстраполювати доказові дані, виходячи з контексту рекомендації та ймовірності наявності модифікатора ефекту (Рисунок S3). Відповідно, ми використовували в якості джерел непрямих доказових даних дані про коронавірус близькосхідного респіраторного синдрому (MERS-CoV), тяжкий гострий респіраторний синдром (SARS) та інші штами коронавірусу; опубліковані дані про підтримуючу терапію у ВАІТ при грипі та інших респіраторних вірусних інфекціях, гострому респіраторному дистрес-синдромі (ГРДС) та сепсисі ми розглядали як опосередковані доказові дані.
Формулювання Рекомендацій
Для формулювання рекомендацій ми використовували принципи, викладені в доказах щодо прийняття рішень (EtD), але через обмеженість в часі ми не заповнювали онлайн таблиці EtD [11]. Структура EtD охоплює такі домени: встановлення пріоритетів, рівень користі та шкоди, вагомість доказових даних, цінності пацієнта, баланс між бажаними та небажаними ефектами, ресурсами та витратами, справедливість, прийнятність та здійсненність.
Кожна з чотирьох підгруп склала попередні рекомендації. Ми використовуємо формулювання «ми рекомендуємо» для рекомендацій і «ми пропонуємо» для пропозицій (тобто слабкі рекомендації). Застосування рекомендацій різної сили представлені в Таблиці 1. Остаточний перелік рекомендацій був розроблений в результаті панельної дискусії та консенсусу; проводити голосування не було потреби. Представляємо рекомендації та ствердження в Таблиці 2.
Оновлення рекомендацій
Ми будемо проводити періодичний автоматизований електронний пошук, який щотижня буде надсилатися призначеним членам колегії для виявлення нових доказових даних у міру їх появи. Відповідно, ми опублікуємо подальші настанови з метою оновлення рекомендацій, якщо потрібно, або сформулюємо нові.
І. Інфекційний Контроль
Ризик передачі SARS CoV-2
Нещодавній звіт Китайського Центру Контролю та Профілактики Захворювань описав 72 314 випадків COVID-19 у Китаї, з них 44 672 були підтверджені лабораторно. Серед підтверджених лабораторією випадків 1716 (3,8%) були серед медичних працівників, більшість з яких 63% (1080 з 1716) інфікувалися в Вухані. У звіті описано, що 14,8% (247 з 1668) інфікованих медичних працівників мали важкі або критичні захворювання, а 5 померли [12]. В Італії станом на 15 березня 2020 року серед медичних працівників зафіксовано 2026 випадків COVID-19 [13]. Хоча дані про захворюваність відсутні, наявні цифри вказують на значну частку інфікування серед медичних працівників. Ризик передачі інфекції від пацієнта до пацієнта у ВАІТ наразі невідомий, тому дотримання запобіжних заходів щодо боротьби з інфекцією є першорядним.
Медичні працівники повинні дотримуватись правил інфекційного контролю та відповідних процедур, що існують в їхніх медичних закладах. Надаємо наступні рекомендації та пропозиції скоріше для розгляду, а не як вимоги для зміни правил інфекційного контролю у ваших закладах.
Рекомендація:
- Медичним працівникам, які проводять пацієнтам з COVID-19 у ВАІТ процедури, пов’язані з утворенням аерозолів*, ми рекомендуємо використовувати респіраторні маски (респіратор N95, FFP2 або інші, еквівалентні за ступенем захисту), на відміну від хірургічних/медичних масок, на додачу до інших індивідуальних захисних засобів (тобто, рукавички, халат і захист для очей, такий як щиток на обличчя або захисні окуляри) (найкраща рекомендація).
*Процедури, пов’язані з утворенням аерозолів у ВАІТ включають ендотрахельну інтубацію, бронхоскопію, відкрите відсмоктування, проведення небулайзерної терапії, ручна вентиляція перед інтубацією, перекладання пацієнта на живіт, відключення пацієнта від вентиляційної підтримки, неінвазивна вентиляція з використанням позитивного тиску, трахеостомія і серцево-легенева реанімація.
Обґрунтування:
Респіраторні маски розроблені для затримки 95–99% часточок аерозолю. Тип N95 відповідає стандартам Федерального Агентства з Лікарських Засобів США, а FFP2 — Європейським стандартам — стандартам Європейського Комітету зі Стандартів). Персонал повинен пройти фіт-тест для кожного типу. Хірургічні (також відомі як медичні маски) розроблені для затримки великих часточок, крапель і спреїв, але менш ефективні для затримки аерозолів з дрібними частинками (<5 мікрометрів) [14].
Ця рекомендація заснована на рішенні консенсусу з рекомендацій CDC, ВООЗ та інших громадських організацій охорони здоров’я, а також на епідеміологічних даних, які демонструють, що процедури, пов’язані з утворенням аерозолів, збільшують ризик для медичних працівників під час епідемії SARS. Респіратори з механічною очисткою повітря (PAPR) можуть використовуватися медичними працівниками, які не пройшли фіт-тест на маску N95, і коли наявність N95 обмежена.
Рекомендація:
- Ми рекомендуємо проводити процедури, пов’язані з утворенням аерозолів, пацієнтам з COVID-19 у ВАІТ в палаті з негативним тиском (найкраща рекомендація).
Обґрунтування:
Палати з негативним тиском — це метод інженерного контролю, призначений для запобігання поширенню патогенів, які переносяться через повітря, з кімнати в кімнату (наприклад, кір та туберкульоз). Основна мета — уникнути випадкового поширення мікроорганізмів закладом, захищаючи тим самим медичних працівників та пацієнтів у лікарняних умовах. У кімнаті пацієнта створюється негативний тиск повітря, щоб утримати збудник всередині і уникнути його розповсюдження. Слід застосовувати цей метод перестороги, коли в приміщенні проводяться процедури, пов’язані з утворенням аерозолів, такі як інтубація трахеї, бронхоскопія або неінвазивна вентиляція з позитивним тиском (НІВПТ), тоді існує нижчий ризик перехресного зараження між приміщеннями та нижчий ризик інфікування персоналу та пацієнтів поза палатою. Негативний тиск створюється і підтримується вентиляційною системою, яка дозволяє надлишковому повітрю потрапляти в ізольоване приміщення за рахунок різниці тисків і виводитися безпосередньо назовні або фільтруватися через високоефективний фільтр твердих часток (HEPA) безпосередньо перед рециркуляцією. Більше того, слід уникати присутності зайвого персоналу в палаті.
Використання палат з негативним тиском виявилось ефективним методом уникнення перехресного зараження під час епідемії SARS [15]. Відповідно, для процедур, пов’язаних з утворенням аерозолів, у пацієнтів з COVID-19 ВООЗ рекомендує використовувати приміщення з негативним тиском із, як мінімум, 12 замінами повітря на годину або провітрюванням зі швидкістю щонайменше 160 л/секунду/пацієнта у приміщеннях із природною вентиляцією [16]. Бронхоскопія належить до процедур, що мають найвищий ризик аерозолізації, і її застосування слід звести до мінімуму. Неінвазивна вентиляція також пов’язана з високим ризиком аерозолізації [17] і поширенням вірусу згідно з попереднім повідомленням про SARS інфекцію [18].
За неможливості застосування цієї рекомендації слід використовувати портативний фільтр HEPA. Фільтр HEPA — це механічний повітряний фільтр, який використовується за потреби максимального зменшення або видалення твердих часточок з повітря. Показано, що фільтри HEPA знижують передачу вірусу в змодельованих умовах [19].
Рекомендації:
- Медичним працівникам, які здійснюють догляд за пацієнтами з COVID-19, які не знаходяться на вентиляційній підтримці, ми пропонуємо використовувати хірургічні/медичні маски, на відміну від респіраторних масок, на додаток до інших засобів індивідуального захисту (наприклад, рукавичок, халату та засобів захисту очей, таких як щиток для обличчя або захисні окуляри) (слабка рекомендація, доказові дані низької якості).
- Медичним працівникам, які проводять процедури без утворення аерозолів пацієнтам із COVID-19 на механічній вентиляції легень (з закритим контуром), ми пропонуємо використовувати хірургічні/медичні маски, на відміну від респіраторних масок, на додаток до інших засобів індивідуального захисту (наприклад, рукавичок, халату та захисту очей, таких як щиток для обличчя або захисні окуляри) (слабка рекомендація, доказові дані низької якості).
Обґрунтування:
Наші рекомендації відповідають настановам ВООЗ та чинним доказовим даним, що свідчать про те, що хірургічні/медичні маски, ймовірно, не поступаються респіраторам N95 у забезпеченні захисту від лабораторно підтверджених сезонних респіраторних вірусних інфекцій (наприклад, грипу, але не кору). Ми оновили останні системні огляди і метааналізи РКД [20] та виявили одне нове РКД [21]. Загалом, 4 РКД (5549 осіб) рандомізували медичних працівників, які використовували респіратори N95 і медичні маски [21–25]. Використання медичних масок, на відміну від респіраторів N95, не збільшувало кількості лабораторно підтвердженої респіраторної інфекції (OR 1,06, 95% ДІ 0,90 — 1,25). Хоча точні оцінки дозволяють припустити, що використання медичних масок було пов’язано з підвищеним ризиком виникнення грипоподібного захворювання (OR 1,31, 95% ДІ 0,94, 1,85) та клінічної респіраторної інфекції (OR 1,49, 95% ДІ 0,98 — 2,28), різниця не була статистично значущою. Нещодавній систематичний огляд та метааналіз дійшли аналогічних висновків [26].
Є лише одне РКД по коронавірусу. Під час тестування на сезонний коронавірус (OC43, HKU1, 229E, NL63) методом ПЛР у цьому некластерному РКД, 4,3% (9/212) медсестер з групи медичних масок мали підтверджену коронавірусну інфекцією методом RT-PCR порівняно з 5,7% (12/210) з групи респіраторів N95 [22].
Розробляючи ці рекомендації, робоча група враховувала відсутність переконливих доказів того, що використання респіраторів N95 покращує клінічні результати, витрати та ресурси, пов’язані з використанням маски N95, та необхідність збереження респіраторів N95 для процедур, пов’язаних з утворенням аерозолю. Тому робоча група сформувала пропозицію використовувати медичні маски в цьому контексті. Однак SARS-CoV-2, схоже, легше передається та спричиняє вищу летальність у порівнянні з сезонним грипом. Зокрема, раннє значення репродукційного числа (R0) SAR-CoV-2, середньої кількості людей, яких інфікована людина згодом інфікує, як функції біологічних властивостей збудника в поєднанні з соціальними та екологічними факторами, становить 2,3 [27]. Для порівняння, передбачуване значення R0 для пандемії грипу 1918 року, що спричинила 50 мільйонів смертей у світі, становило 1,8, а передбачуване значення R0 для сезонного грипу — 1,28 [28]. Отже, медичним працівникам, які доглядають за пацієнтами з COVID-19, які не знаходяться на механічній вентиляції, а також медичним працівникам, які проводять процедури, що не супроводжуються утворенням аерозолю, пацієнтам із COVID-19 на механічній вентиляції (з закритим контуром), рекомендовано використання хоча б хірургічної/медичної маски. При відсутності дефіциту, обґрунтованим є використання респіратора.
Рекомендація:
- Медичним працівникам, які проводять ендотрахеальну інтубацію пацієнтам з COVID-19, ми пропонуємо за наявності відеоларингоскопію замість прямої ларингоскопії (слабка рекомендація, доказові дані низької якості).
Обґрунтування:
Немає прямих доказових даних щодо порівняння використання відеоларингоскопії з прямою ларингоскопією для інтубації пацієнтів із COVID-19. Хоча SAR-CoV-2 переважно поширюється з великими респіраторними крапельками, інтубація пов’язана з утворенням аерозолю з малими часточками (менше 5 мікрометрів), що збільшує ризик передачі інфекції медичним працівникам [29]. Інтубація особливо ризикована з огляду на тісний контакт медичних працівників з дихальними шляхами та виділеннями пацієнта. Таким чином, техніки, що дозволяють зменшити кількість спроб ендотрахеальної інтубації та тривалість процедури, а також мінімізувати близькість між медичним працівником та пацієнтом, повинні бути пріоритетні, потенційно знижуючи ризик ускладнень у пацієнтів з COVID-19 в стані гіпоксії. У систематичному огляді, що включає 64 дослідження та 7444 пацієнтів, відеоларингоскопія знизила ризик невдалої інтубації (OR 0,35, 95% ДІ 0,19–0,65), не маючи істотного впливу на показник успішності першої спроби (OR 0,79, 95% ДІ 0,48–1,3), розвиток гіпоксії (OR 0,39, 95% ДІ 0,1–1,44) або час, витрачений на інтубацію трахеї [30, 31]. У пацієнтів із утрудненою прохідністю дихальних шляхів показник успішності першої спроби може бути покращений за допомогою відеоларингоскопії [32].
Таким чином, у закладах з доступною відеоларингоскопією та кваліфікованим у її проведенні персоналом, ми пропонуємо надавати їй перевагу над прямою ларингоскопією для максимізації шансів на успіх. Зважаючи на те, що не всі центри матимуть швидкий доступ до відеоларингоскопії або кваліфікований персонал, ця рекомендація є умовною.
- Ми рекомендуємо проведення ендотрахеальної інтубації медичним працівником, який має найбільший досвід з відновлення прохідності дихальних шляхів, щоб мінімізувати кількість спроб та ризик передачі (найкраща рекомендація).
Обґрунтування:
Подібно до вищезазначеної аргументації, фактори, що збільшують шанси на успішність першої спроби, слід застосовувати при інтубації пацієнтів із ймовірним або підтвердженим COVID-19. Таким чином, ми рекомендуємо, щоб медичний працівник, який має найбільше досвіду та навичок з відновлення прохідності дихальних шляхів, здійснював першу спробу інтубації.
ІІ. Лабораторна діагностика та зразки матеріалу
Показання до тестування на SARS CoV-2 у пацієнтів у ВАІТ
Нещодавно ВООЗ оголосила пандемію COVID-19. Відповідно, кожного важкохворого пацієнта з ознаками респіраторної інфекції слід вважати потенційно інфікованим SARS-CoV-2. Полімеразна ланцюгова реакція в реальному часі (RT-PCR) є золотим стандартом для подібних вірусних інфекцій, включаючи SARS [33]. Через тривалий інкубаційний період COVID-19 (приблизно два тижні) відмічається також тривалий період (приблизно 5 днів) безсимптомного вірусовиділення до появи симптомів. Більше того, тривалість безсимптомного вірусовиділення не лише варіабельна, але може також відрізнятися залежно від анатомічного рівня ураження дихальної системи [1, 34]. Відповідно, показники біомолекулярного аналізу можуть змінюватися залежно від місця відбору проб.
| Рекомендації:
7. Для інтубованих дорослих пацієнтів, які знаходяться на ШВЛ, з підозрою на COVID-19: |
| 7.1 Для діагностичного тестування ми пропонуємо збирати зразки з нижніх дихальних
шляхів, віддаючи їм перевагу над зразками з верхніх дихальних шляхів (носоглоткові або орофарингеальні мазки) (слабка рекомендація, докази низької якості). |
| 7.2 Що стосується забору матеріалу з нижніх дихальних шляхів, ми пропонуємо
здійснювати забір ендотрахеального аспірату, надаючи їм перевагу перед змивами з бронхів або зразками бронхо-альвеолярного лаважу (слабка рекомендація, докази низької якості). |
Обґрунтування:
Діагноз COVID-19 заснований на ПЛР-тестуванні (зі зворотною транскрипцією) зразків з носоглотки та ротоглотки, а також зразків з нижніх дихальних шляхів, коли це можливо. Проведення бронхо-альвеолярного лаважу слід обмежувати та проводити лише за показаннями та з дотриманням відповідних запобіжних заходів через ризик аерозолізації та наслідки її впливу на медичних працівників. Так само слід уникати провокування виділення мокротиння через підвищений ризик аерозолізації. Виявилось, що збір зразків аспірату з трахеї супроводжується меншим ризиком аерозолізації, а іноді їх можна отримати не відключаючи пацієнта від ШВЛ.
Процедура лабораторного ЗТ-ПЛР тестування на SARS CoV-2, включає в себе низку досліджень, які добре описані [35]. Незважаючи на, в загальному, високу чутливість та специфічність аналізів на основі ЗТ-ПЛР[36], може бути недостатньо виключно орофарингеальних мазків для діагностики SARS CoV-2 через низьке прогностичне значення негативного результату. У недавньому дослідженні лише 9 із 19 (47%) орофарингеальних мазків пацієнтів із COVID-19 виявились позитивними методом ЗТ-ПЛР [37]. Аналогічні дані повідомлялися про використання ЗТ-ПЛР під час епідемії SARS 2002-2003рр. [38]. Використовуючи сероконверсію як «золотий стандарт» для діагностики SARS, ЗТ-ПЛР дослідження зразків з носоглотки та горла були позитивними лише у 65% та 70% випадків відповідно. Однак не було виявлено хибно позитивних результатів, що вказувало на 100% специфічність аналізу. Аналогічно, у дослідженні, що враховує результати КТ-сканування серед підозр на COVID-19, 48% з негативними мазками з ротоглотки або носа вважалися дуже ймовірними випадками, а 33% вважалися ймовірними випадками [39]. Отже, один негативний мазок з верхніх дихальних шляхів не виключає інфікування SARS-CoV-2, і повторний відбір проб з декількох ділянок, включаючи нижні дихальні шляхи, збільшить діагностичний ефект. Так само, враховуючи, що спостерігається ко-інфекція з іншими вірусними збудниками, позитивний тест на інший респіраторний вірус не виключає COVID-19 і не повинен відкладати тестування, якщо є велика підозра на новий коронавірус [40]. Враховуючи високу специфічність, один позитивний зразок підтверджує діагноз COVID-19 і його досить, щоб впровадити запобіжні заходи щодо боротьби з інфекцією та належне лікування пацієнта.
Вважається, що зразки з нижніх дихальних шляхів дають більш високий діагностичний результат, ніж мазки з верхніх дихальних шляхів, у хворих на пневмонію; ці дані відповідають тому, що спостерігалося при SARS [41], і тому їх слід отримувати там, де це можливо.
ІІІ. Підтримуюча терапія
а) Гемодинамічна підтримка
Шок та пошкодження міокарду у пацієнтів з COVID-19
Повідомляється, що поширеність шоку у дорослих пацієнтів з COVID-19 є високо варіабельною (від 1% до 35%), залежно від досліджуваної популяції пацієнтів, ступеня важкості захворювання та визначення шоку. В нещодавньому звіті, що підсумовує епідеміологічні характеристики 44 445 китайських пацієнтів з COVID-19, 2087 (5%) були діагностовані як критичні випадки, з визначеною важкою гіпоксемією та/або наявністю недостатності інших органів, включаючи шок [12]. В іншому китайському дослідженні серед 1099 пацієнтів з COVID-19 з однаковим ступенем важкості захворювання лише у 12 (1,1%) розвинувся шок [1]. У госпіталізованих пацієнтів ймовірність виникнення шоку вища [42] (табл. 3) і може досягати 20-35% серед пацієнтів, які перебувають у стаціонарі [42, 43].
Про ушкодження міокарду (підвищення серцевих біомаркерів вище верхньої контрольної межі 99-го перцентилю) повідомлялося у 7%–23% пацієнтів із COVID-19 у Вухані, Китай [42–45]. Хоча поширеність пошкодження серця може співвідноситися з поширеністю шоку, відсутність систематичного скринінгу на серцеву дисфункцію у гемодинамічно стабільних пацієнтів означає, що цей зв’язок не можна сприймати як достовірний (табл. 3).
Про прогноз пацієнтів з COVID-19 та шоком систематично не повідомлялось. У дослідженні 150 пацієнтів з двох лікарень в Ухані, Китай, шок був головною причиною смерті у 40% і, принаймні частково, міг бути наслідком фульмінантного міокардиту [46]. Досліджень щодо факторів ризику, пов’язаних з шоком у пацієнтів з COVID-19, бракує. Більшість із тих, що є у наявності, подають не відкориговані оцінки [12, 42, 46]. Незважаючи на методологічні обмеження, ці дослідження свідчать, що серед чинників ризику слід розглядати старший вік, супутні захворювання (особливо діабет та серцево-судинні захворювання, включаючи
гіпертонію), зниження кількості лімфоцитів, більш високий рівень D-димеру та, можливо, ураження серця.
Інфузійна терапія:
| Рекомендації:
8. Для дорослих з COVID-19 та шоком ми пропонуємо надати перевагу використанню динамічних параметрів температури шкіри, часу наповнення капілярів та/або рівень лактату сироватки крові над статичними параметрами для оцінки відновлення гемодинаміки у відповідь на інфузійну терапію (слабка рекомендація, докази низької якості). |
Обґрунтування:
Не існує прямих доказів, що стосуються оптимальної стратегії ресусцитації у пацієнтів з COVID-19 та шоком, тому група експертів під час розробки рекомендації спиралась на непрямі дані, отримані від важкохворих пацієнтів.
У систематичному огляді та метааналізі 13 рандомізованих контрольованих досліджень (n=1,652), що вивчали вплив динамічної оцінки інфузійної терапії на важливі показники пацієнтів у дорослому ВАІТ, які потребували відновлення гемодинаміки [47], виявлено, що використання динамічного оцінювання для введення інфузійної терапії дозволило знизити смертність (ВР* 0.59, 95% ДІ* 0.42 до 0.83), тривалість перебування у ВАІТ (MD -1.16 днів, 95% ДІ -1.97 до -0.36) та тривалість ШВЛ (-2,98 годин, 95% ДІ -5,08 до -0,89). Зазначимо, що лише 1 дослідження охоплювало пацієнтів із септичним шоком. Динамічні параметри, які використовувались у цих випробуваннях, включали зміни ударного (систолічного) об’єму (SVV), зміни пульсового тиску (PPV) та зміни систолічного об’єму при пасивному піднятті ніг або при навантажувальній дозі інфузійного розчину. Серед досліджуваних динамічних параметрів пасивне підняття ніг з подальшим визначенням PPV та SVV прогнозувало відновлення гемодинаміки у відповідь на інфузійну терапію з найбільшою точністю [48]. Статичні параметри включали компоненти ранньої цільової терапії, наприклад центральний венозний тиск (CVP) і середній артеріальний тиск (MAP).
*ДІ — довірчий інтервал (СІ)
*ВР — відносний ризик (RR)
Використання рівнів лактату в сироватці для ведення хворих на шок у ВАІТ було узагальнено в систематичному огляді та метааналізі 7 РКД (n=1,301) [49]. Порівняно з терапією, що керується центральною венозною насиченістю киснем (ScVO2), рання терапія, орієнтована на кліренс лактату була пов’язана зі зменшенням смертності (0,68 RR, 95% ДІ 0,56 до 0,82), меншою тривалістю перебування у ВАІТ (1,64 дня, 95% ДІ) Від -3,23 до -0,05) та меншою тривалістю ШВЛ (МД -10,22 години, 95% ДІ -15,94 до -4,50). Однак високий рівень лактату не завжди вказує на гіповолемію; він також може бути викликаний дисфункцією мітохондрій, печінковою недостатністю, бета-агоністами, мезентеріальною ішемією або епінефрином.
У дослідженні ANDROMEDA-SHOCK тестування капілярного наповнення (CRT) кожні 30 хв асоціювалося з несуттєвим зниженням смертності (HR 0,75, 95% ДІ 0,55 до 1,02) порівняно з вимірюванням лактату сироватки кожні 2 години [50]. CRT — це простий і легкий тест, який можна використовувати майже в будь-яких умовах. Враховуючи можливе зменшення рівнів смертності, тривалості перебування та тривалості ШВЛ, які вони можуть давати, а також їх доступність, ми пропонуємо використовувати динамічні параметри температури шкіри, часу капілярного наповнення та/або вимірювання лактату для статичних параметрів для оцінки рідини відповідь у пацієнтів із COVID-19 та шоком.
| Рекомендація: 9. Для ресусцитації дорослих хворих на COVID-19 та шоку ми пропонуємо використовувати консервативну стратегію інфузійної терапії замість вільної стратегії (слабка рекомендація, докази дуже низької якості). |
Обґрунтування:
Немає прямих доказів щодо ресусцитації пацієнтів із COVID-19 та шоком, тому робоча група використовувала непрямі докази щодо критично хворих на сепсис та ГРДС для формування цієї рекомендації. Нещодавній систематичний огляд 9 РКД (n=637 пацієнтів), що порівнював консервативну та ліберальну стратегії інфузійної терапії в початковій реанімації хворих на сепсис, не виявив статистично значущої різниці в смертності (0,87 RR, 95% ДІ 0,69 до 1,10) та серйозних побічних явищ ( RR 0,91, 95% ДІ 0,78 до 1,05) [51]. Однак усі оцінені результати свідчили на користь консервативної інфузійній терапії (менші обсяги). Важливо, що кількість доказів була недостатньою, а якість доказів була оцінена як дуже низька, що свідчить про необхідність проведення додаткових досліджень. Відповідно, у 2017 році метааналіз 11 РКД (n=2 051 пацієнт), в який входили дорослі та діти з ГРДС або сепсисом, які велись відповідно до консервативної інфузійної стратегії, у післяреанімаційній фазі мали більше днів без ШВЛ, і коротший термін перебування у ВАІТ, ніж пацієнти, яких вели відповідно до вільної стратегії інфузійної терапії [52] (див. розділ щодо дихальної підтримки для більш детальної інформації). У 2011 році велика кількість РКД із 3141 африканською дитиною із гарячкою (FEAST) виявила, що діти, рандомізовані за рідинними болюсами з фізіологічним розчином або альбуміном, мали вищу смертність порівняно з дітьми, які не отримували болюси рідини [53].
За відсутності даних, що свідчать про користь використання вільних стратегій інфузійної терапії у важкохворих на сепсис або ГРДС, та враховуючи, що більшість хворих на COVID-19 у відділенні інтенсивної терапії розвивають ГРДС, ми пропонуємо початковий консервативний підхід до інфузійної терапії в пацієнтів з COVID-19 та шоком.
| Рекомендація: 10. Для ресусцитації дорослих в стані шоку та хворих на COVID-19 ми рекомендуємо надавати перевагу використанню кристалоїдів над використанням колоїдів (слабка рекомендація, докази помірної якості). |
Обґрунтування:
Оскільки прямих доказів щодо терапії шоку у пацієнтів із COVID-19 немає, група експертів сформулювала цю рекомендацію виходячи з непрямих доказів щодо критично хворих пацієнтів. У систематичному огляді 69 РКД (n=30,020 пацієнтів), які порівнювали використання кристалоїдів замість колоїдів у важкохворих пацієнтів [54], жоден результат не вказував на переваги використання колоїдів. Враховуючи, що деякі колоїди шкідливі (див. нижче), усі колоїди дорожчі, ніж кристалоїди, а наявність колоїдів у деяких умовах обмежена (наприклад, деякі країни з низьким і середнім рівнем доходу), ми рекомендуємо використовувати кристалоїди для інфузійної терапії у пацієнтів із COVID-19 і шоком.
| Рекомендація: 11. Для гострої ресусцитації дорослих з COVID-19 та шоком ми пропонуємо використовувати буферні/збалансовані кристалоїди замість незбалансованих кристалоїдів (слабка рекомендація, докази помірної якості). |
Обґрунтування:
Немає жодних прямих доказів щодо цього питання у пацієнтів із COVID-19 та шоком. При створенні цієї рекомендації комісія спиралась на непрямі дані щодо критично хворих пацієнтів загалом. Систематичний огляд та метааналіз 21 РКД (n=20 211 пацієнтів), що порівнювали внутрішньовенні буферні (збалансовані) кристалоїдні розчини з 0,9% фізіологічним розчином для ресусцитації критично хворих дорослих та дітей [55], не виявили суттєвих відмінностей у лікарняній смертності (OR 0,91, 95% ДІ 0,83 до 1,01) або частоті появи гострого ураження нирок (OR 0,92, 95% ДІ 0,84 до 1,00) між методами лікування. Однак оцінка обох результатів свідчить про більшу користь буферних кристалоїдних розчинів. За відсутності очевидної шкоди та враховуючи приблизно еквівалентні витрати, ми пропонуємо використовувати буферні кристалоїдні розчини замість незбалансованих кристалоїдних розчинів для реанімації пацієнтів із COVID-19 та шоком. В умовах обмеженої доступності буферних розчинів, 0,9% фізіологічний розчин залишається розумною альтернативою.
| Рекомендація: 12. Для ресусцитації дорослих хворих з COVID-19 та шоком ми рекомендуємо не застосовувати гідроксиетилкрохмалі (сильна рекомендація, докази помірної якості). |
Обґрунтування:
Враховуючи відсутність прямих доказів щодо пацієнтів із COVID-19 та шоком, група експертів спиралась у формуванні цієї рекомендації на непрямі дані від всіх груп критично хворих пацієнтів. Систематичний огляд 69 РКД (n=30,020 пацієнтів) порівнював використання кристалоїдів проти колоїдів у важкохворих; 24 з цих РКД (n=11 177 пацієнтів) порівняли використання кристалоїдів із застосуванням крохмалів [54]. Коли дані були об’єднані, статистично значущої різниці в смертності не спостерігалося у кінці дослідження (RR 0,97, 95% ДІ 0,86–1,09), та протягом 90 днів (RR 1,01, 95% ДІ 0,90 до 1,14) також протягом 30 днів (RR 0,99, 95% ДІ 0,90 до 1,09). Однак автори повідомили про підвищений ризик переливання крові (1,19 RR, 95% ДІ 1,02–1,39) та замісної нирковій терапії (РРТ) при інфузійній терапії гідроксиетилкрохмалем (RR 1,30, 95% ДІ 1,14–1,48). Зважаючи на ризик клінічно значущих побічних ефектів та очевидну відсутність користі від використання гідроксиетилкрохмалів, ми не рекомендуємо їх застосування для ресусцитації пацієнтів із COVID-19 та шоком.
| Рекомендація: 13. Для ресусцитації дорослих хворих з COVID-19 та шоком ми рекомендуємо не застосовувати желатини (слабка рекомендація, докази низької якості). |
Обґрунтування: Оскільки жодне дослідження не висвітлювало це питання у пацієнтів із COVID-19 та шоком, група експертів при створенні цієї рекомендації спиралася на непрямі свідчення щодо інших груп критично хворих пацієнтів. У систематичному огляді 69 РКД (n=30,020 пацієнтів), що порівнювали використання кристалоїдів та колоїдів у критично хворих пацієнтів, кристалоїди порівнювали з желатинами у 6 РКД (n=1698) [54]. Ніякої статистично значущої різниці в смертності від усіх причин не спостерігалося в кінці дослідження (RR 0,89, 95% ДІ 0,74–1,08), протягом 90 днів (0,89 RR, 95% ДІ 0,73–1,09) та протягом 30 днів (RR 0,92, 95% ДІ 0,74 до 1,16), хоча точкові оцінки свідчили на користь використання кристалоїдів. Враховуючи відсутність будь-якої користі від желатинів та їх більш високу вартість, ми пропонуємо не використовувати желатини для реанімації пацієнтів із COVID-19 та шоком.
| Рекомендація: 14. Для реанімації дорослих із COVID-19 та шоком ми не рекомендуємо використовувати декстрани (слабка рекомендація, докази низької якості) |
Обґрунтування: Враховуючи відсутність прямих доказів щодо пацієнтів із COVID-19 та шоком, група експертів спиралась при створенні рекомендації на непрямі доказові дані щодо інших груп критично хворих пацієнтів. Систематичний огляд та метааналіз з приводу застосування кристалоїдів та колоїдів у важкохворих пацієнтів виявив 19 досліджень, що порівнювали використання кристалоїдів з декстраном (n=4 736) [54]. Дослідження виявило що показники смертності не відрізняються наприкінці спостереження (0,99, 95% ДІ 0,88 до 1,11) та протягом 90 днів (0,99 RR, 95% ДІ 0,87–1,12), але можливий підвищений ризик при переливанні крові в судину на тій же руці, куди відбувалась інфузія декстрану (0,92 RR, 95% ДІ 0,77–1,10). З огляду на можливий підвищений ризик при переливанні крові (кровотечі) та підвищення витрат, пов’язаних з декстраном, ми не пропонуємо їх використання для реанімації пацієнтів із COVID-19 та шоком.
Рекомендація: 15. Для реанімації дорослих з COVID-19 та шоком ми не рекомендуємо рутинного використання альбуміну для початкової реанімації (слабка рекомендація, докази помірної якості).
Обґрунтування: Оскільки прямих доказів щодо пацієнтів із COVID-19 та шоком немає, група експертів спиралась при створенні рекомендації на непрямі доказові дані щодо інших груп критично хворих пацієнтів.
Систематичний огляд та метааналіз визначили 20 РКД (n=13,047), де порівнюється використання альбуміну із використанням кристалоїдів [54]. Не було продемонстровано суттєвої різниці в смертності від усіх причин після закінчення спостереження (RR 0,98, 95% ДІ 0,92 до 1,06) протягом 90 днів (RR 0,98, 95% ДІ 0,92 до 1,04) або протягом 30 днів (RR 0,99, 95% ДІ 0,93–1,06). Ризики при переливанні крові (1,31, 95% ДІ 0,95–1,80) та при проведенні нирково-замісної терапії (RR 1,11, 95% ДІ 0,96–1,27) також були подібні.
За відсутності переваги альбуміну, враховуючи його вартість та обмежену доступність, ми не рекомендуємо його рутинного використання для початкової реанімації пацієнтів із COVID-19 та шоком.
Вазоактивні засоби
Рекомендація: 16. Для дорослих з COVID-19 та шоком, ми пропонуємонадавати перевагу норадреналіну як вазоактивну засобу першої лінії, перед іншими засобами (слабка рекомендація, докази низької якості).
Обґрунтування: Не існує прямих доказів щодо пацієнтів із COVID-19 та шоком, тому група експертів спиралась при створенні рекомендації на непрямі доказові дані щодо інших груп критично хворих пацієнтів.
Систематичний огляд 28 РКД (n=3,497 пацієнтів) та клінічна настанова від 2016 року узагальнила наявні дані про найбільш ефективний вазопресор першого ряду для пацієнтів з шоком [56, 57]. Оскільки норадреналін є найбільш широко вивченим вазоактивним агентом з низьким ризиком небажаних ефектів, ми пропонуємо використовувати норадреналін як вазоактивний засіб першої лінії пацієнтам із COVID-19 та шоком.
Рекомендація: 17. Якщо норадреналін недоступний, ми пропонуємо надавати перевагу або вазопресину, або епінефрину як вазоактивним засобам першої лінії, перед іншими вазоактивними засобами, для дорослих із COVID-19 та шоком (слабка рекомендація, докази низької якості).
Обґрунтування: За відсутності прямих доказів щодо пацієнтів із COVID-19 та шоком група експертів спиралась при створенні рекомендації на непрямі доказові дані щодо інших груп критично хворих пацієнтів.
У систематичному огляді 28 РКД (n=3,497 пацієнтів) норадреналін порівнювали як з вазопресином, так і з епінефрином, але жодні дослідження безпосередньо не порівнювали обидва варіанти [57]. Якщо норадреналін недоступний, ми пропонуємо використовувати або вазопресин, або епінефрин, оскільки обидва препарати були оцінені РКД, як ті, що не мають виражених негативних ефектів. Фактори, що визначають вибір між вазопресином та адреналіном, можуть включати наявність та протипоказання до кожного з препаратів. Вазопресин може впливати на підвищення ризику ішемії кінцівок; з епінефрин може впливати на розвиток тахікардії та надлишкову продукцію лактату.
Рекомендація: 18. Для дорослих із COVID-19 та шоком ми рекомендуємо не застосовувати дофамін, якщо норадреналін доступний (сильна рекомендація, докази високої якості).
Обґрунтування:
Оскільки немає жодних прямих доказів щодо цього питання у пацієнтів з COVID-19 та шоком, група експертів спиралась при створенні рекомендації на непрямі доказові дані щодо інших груп критично хворих пацієнтів. В систематичному огляді Cochrane в 2016 році було виявлено 6 РКД (n=1400), що порівнювали використання норепінефрину та допаміну у пацієнтів з шоком [57]. Під час об’єднання результати не показали суттєвої різниці в загальній смертності, але точкова оцінка свідчила на користь норепінефрину (RR 1,07, 95% ДІ 0,99 до 1,16), оскільки в групі допаміну був виявлений підвищений ризик виникнення аритмій (RR 2,34,95% ДІ 1,46–3,78). На основі підвищеного ризику побічних наслідків, включаючи можливий підвищений ризик смертності у пацієнтів, які отримували допамін, ми не рекомендуємо його застосування у пацієнтів COVID-19 та шоком, коли є норепінефрин або інші альтернативи (див. Рекомендацію 17).
Рекомендація: 19. Для дорослих з COVID-19 та шоком ми пропонуємо надавати перевагу додаванню вазопресину як засобу другого ряду перед титруванням дози норепінефрину, якщо цільове значення середнього артеріального тиску (MAP) не може бути досягнуто лише за допомогою норепінефрину (слабка рекомендація, докази помірної якості).
Обґрунтування:
За відсутності даних про пацієнтів з COVID-19 та шоком, група експертів спиралась при створенні рекомендації на непрямі доказові дані щодо інших груп критично хворих пацієнтів. У недавній настанові з клінічної практики було оцінено використання вазопресину та його аналогів у важкохворих дорослих з дистрибутивним шоком [58]. Аналізуючи 25 РКД (n=3737 пацієнтів), автори виявили низьку достовірність зниження смертності (RR 0,91, 95% ДІ 0,85 до 0,99), високу достовірність зменшення фібриляції передсердь (RR 0,77, 95% ДІ 0,67 до 0,88) та помірну достовірність підвищеного ризику виникнення дигітальної ішемії (RR 2,56, 95% ДІ 1,24–5,25) при додаванні вазопресину або його аналогів до катехоламінів. Ще один останній систематичний огляд дійшов аналогічного висновку [59]. З огляду на ці результати ми пропонуємо додавати вазопресин як засіб другого ряду на противагу титруванню дози норадреналіну, якщо цільове значення САТ не може бути досягнуте лише за допомогою норадреналіну у пацієнтів з COVID-19 та шоком.
Рекомендація: 20. Для дорослих з COVID-19 та шоком ми пропонуємо титрування вазоактивних речовин для досягнення середнього артеріального тиску 60-65 мм рт.ст., а не більш високих показників (слабка рекомендація, докази низької якості)
Обґрунтування:
Жодні прямі докази не підтверджують цю рекомендацію; вона заснована на непрямих свідченнях стосовно критично хворих пацієнтів. Нещодавній індивідуальний метааналіз даних пацієнтів з 2 РКД (n=894 пацієнтів), який порівнював високі та низькі показники артеріального тиску при терапії вазопресором у дорослих пацієнтів з шоком, не повідомляв про суттєву різницю для летальності протягом 28 днів (RR 1,15, 95% ДІ 0,87 до 1,52), смертності протягом 90 днів (RR 1,08, 95% ДІ 0,84 до 1,44), ушкодження міокарда (RR 1,47, 95% ДІ 0,64 до 3,56) або ішемії кінцівок (RR 0,92, 95% ДІ 0,36–2,10) [60]. Ризик виникнення аритмії збільшився у пацієнтів, віднесених до групи з вищими показниками АТ (RR 2,50, 95% ДІ 1,35–4,77).
Відповідно, нещодавно опубліковані 65 досліджень повідомляють про абсолютну різницю ризику смертності на 3% (RR 0,93, 95% ДІ 0,85–1,03) на користь досягнення середнього артеріального тиску 60–65 мм рт.ст. (нижча ціль) порівняно з показником САТ при стандартному веденні (вища ціль) [61].
При покращенні перебігу захворювання при нижчому САТ (і без ознак ушкодження, органів, пов’язаного з цим), ми пропонуємо титрувати вазоактивні агенти до цільового САТ у 60–65 мм рт ст.
Рекомендація: 21. Для дорослих із COVID-19 та шоком та даними за серцеву недостатність та персистуючу гіпоперфузію не зважаючи на інфузійну терапію та норепінефрин ми пропонуємо надати перевагу додаванню добутаміну над підвищенням дози норепінефрину.
Обґрунтування:
За відсутності прямих доказів у пацієнтів з COVID-19 та шоком, робоча група використовувала непрямі дані від критично хворих пацієнтів з метою підкріплення цієї рекомендації. У клінічній настанові від 2018 року, що оцінює оптимальну інотропну підтримку у пацієнтів з гострою циркуляторною недостатністю (шоком), не було визначено РКД, які б порівнювали використання добутаміну з плацебо або з відсутністю лікування [62]. Спираючись на фізіологічне обґрунтування, ми пропонуємо надавати перевагу призначенню добутаміну над відсутністю лікування у пацієнтів з COVID-19 та шоком з наявними ознаками порушення функції серця та персистуючою гіпоперфузією незважаючи на інфузійну терапію та високі дози норепінефрину. Використання добутаміну при шоці, включно з використанням у пацієнтів з COVID-19 та шоком є пріоритетом для досліджень.
Рекомендація: 22. Для дорослих із COVID-19 та рефрактерним шоком ми пропонуємо надати перевагу використання низької дози кортикостероїдів (протишокової) над не використанням кортикостероїдів.
Зауваження: типовий режим прийому кортикостероїдів при септичному шоці: призначення внутрішньовенного гідрокортизону у дозі 200 мг на добу у якості інфузії або інтервально.
Обґрунтування:
Оскільки відсутні дані з використання стероїдів у пацієнтів з COVID-19 та шоком, робоча група при створенні цієї рекомендації, спиралась на непрямі доказові дані від критично хворих пацієнтів загалом. І систематичний огляд 22 РКД 2018 року (7279 пацієнтів), що порівнює низькодозову терапію кортикостероїдами з відсутністю терапії кортикостероїдами у дорослих пацієнтів з септичним шоком [63], і клінічно-орієнтована настанова [64] не надають даних про суттєву різницю у короткотривалій смертності (RR 0.96, 95% ДІ 0.91 до 1.02), або кількості серйозних побічних ефектів (RR 0.98, 95% ДІ 0.90 до 1.08). Однак час до розрішення шоку та тривалість перебування у ВАІТ були коротшими при терапії кортикостероїдами. Оскільки час до розрішення шоку та тривалість госпіталізації (особливо у ВАІТ) є важливими факторами, що впливають на вартість лікування, ми пропонуємо використовувати терапію кортикостероїдами у пацієнтів, з COVID-19 та рефрактерним шоком. Нижче ми надаємо подальше керівництво з ведення пацієнтів з COVID-19 та дихальною недостатністю при відсутності рефрактерного шоку.
B) Вентиляційна підтримка
Гіпоксична дихальна недостатність розвивається у 19% пацієнтів із COVID-19 [12]. Згідно з останніми звітами з Китаю, від 4% до 13% пацієнтів із COVID-19, включених у дослідження, знаходились на неінвазивній вентиляції легень з позитивним тиском (НІВЛПТ), а потребу в інвазивній механічній вентиляції мали від 2,3 до 12% пацієнтів (Таблиця 3) [1, 12, 42, 43, 65]. Хоча справжня частота виникнення гіпоксичної дихальної недостатності у пацієнтів із COVID- 19 не відома, виявляється, що приблизно у 14% випадків розвивається важке захворювання, яке потребує кисневої терапії, а 5% пацієнтів змушені перебувати у відділенні інтенсивної терапії з механічною вентиляцією легень [12]. У ще одному дослідженні, яке охоплювало 52 критичних пацієнтів з COVID-19, повідомляється, що 67% пацієнтів мали ГРДС, 33 (63,5%) отримували високопотокову назальну канюлю, 56% — інвазивну механічну вентиляцію легень та 42% — НІВЛПТ [42].
Фактори ризику розвитку дихальної недостатності
Фактори ризику розвитку дихальної недостатності, що потребує механічної вентиляції легень, чітко не описані в опублікованих звітах, хоча з обмежених доступних даних можна сказати, що фактори ризику, пов’язані з розвитком критичного стану або необхідністю перебування у відділенні інтенсивної терапії, включають старіший вік (>60 років), чоловічу стать та наявність супутніх захворювань, таких як діабет, злоякісне захворювання та імуносупресивний стан [1, 12, 42, 43]. CDC повідомляє, що загальний показник летальності становить 2,3%, для пацієнтів віком від 80 років цей показник становить 14,8%. У критично хворих пацієнтів показник летальності становить 49,0%, а у тих, хто перебував на інвазивній механічній вентиляції легень, він був вище 50%. Наявність коморбідних станів, таких як серцево-судинні захворювання, діабет, хронічні респіраторні захворювання, гіпертонія та рак, пов’язана з вищим ризиком смерті [12].
Рекомендації:
- Для дорослих з COVID-19, ми пропонуємо починати кисневу підтримку якщо периферична сатурація киснем (SPO2) менше 92% і рекомендуємо починати кисневу підтримку якщо SPO2 <90%.
- У дорослих COVID-19 та гострою гіпоксемічною дихальною недостатністю, що перебувають на кисневій підтримці, ми пропонуємо підтримувати SPO2 на рівні не вище 96%.
Обґрунтування:
У нещодавньому дослідженні описано перебіг захворювання 1009 пацієнтів із COVID-19 у Китаї та показано, що 41% усіх госпіталізованих та понад 70% хворих із важким перебігом потребують додаткового кисню [1]. У важкохворих пацієнтів гіпоксія може бути смертельно небезпечною і пов’язана з поганими наслідками [66]. Немає рандомізованих чи нерандомізованих досліджень щодо застосування кисню у дорослих із COVID-19. Однак робоча група використовувала непрямі докази на основі дослідження гостро хворого населення для формування рекомендацій.
Системний огляд та метааналіз 25 РКД (16 037 пацієнтів) показав, що вільна стратегія подачі кисню пов’язана з підвищеним ризиком лікарняної смертності (відносний ризик 1,21, 95% ДІ, 1,03–1,43) у гостро хворих пацієнтів [67]. Крім того, мета-регресійний аналіз свідчить про лінійний зв’язок між ризиком смерті та вищими цільовими показниками SPO2 [67]. У всіх дослідженнях медіана SPO2 у групі вільної стратегії оксигенотерапії становила 96% (IQR 96–98). У нещодавніх настановах з клінічної практики є рекомендація підтримувати SPO2 не вище 96% [68].
Наступні дослідження надають подальші настанови щодо цільових показників оксигенації. У рандомізованому дослідженні ICU-ROX 1000 критично хворих пацієнтів було розподілено на дві групи: отримання консервативної оксигенотерапії (заснованої на протоколі зниження подачі кисню) або звичайна терапія. Це дослідження не виявило різниці у 100-денній смертності між двома групами (OR 1.05, 95% CI 0.81 до 1.37) [69]. Дослідження ICU-ROX не порівнювали показники гіпероксії з консервативною стратегією оксигенотерапії; натомість у ньому порівняли консервативну оксигенотерапію із звичайним лікуванням. У нещодавньому рандомізованому дослідженні LOCO2 використовували консервативну стратегію оксигенотерапії (цільовий показник SPO2 88% до 92%) та вільну стратегію оксигенотерапії (цільовий показник SPO2 >96%) для лікування пацієнтів з ГРДС. Дане дослідження було рано припинене через марність та можливу шкоду після 61 смертельного випадку з 205 пацієнтів, включаючи пацієнтів з 28-денною смертністю (різниця ризиків [RD] 7.8%, 95% CI; -4.8 до 20.6) [70]. Після закінчення терміну 90 днів, було визначено, що консервативна стратегія оксигенотерапії була пов’язана з вищим ризиком смерті (RD 14.0%, 95% CI, 0.7 до 27.2).
Враховуючи асоційовану шкоду високих цільових показників SPO2 для пацієнта та підвищену вартість ліберальної оксигенотерапії, а також потенціал зниження неупередженості, якщо ресурси кисню вичерпані, колегія видала рекомендацію щодо використання цільових показників кисню SPO2 >96%, і рекомендує уникати менших значень (SPO2 <90%). Тому вірний діапазон SPO2 для пацієнтів, які отримують кисень, становить від 92% до 96%.
Рекомендація: 25. Для дорослих із COVID-19 та гострою гіпоксемічною дихальною недостатністю, незважаючи на традиційну терапію киснем, ми пропонуємо використовувати HFNC (високопотокова оксигенотерапія через назальну канюлю) у порівнянні зі звичайною терапією киснем (слабка рекомендація, низька доказова якість).
Обґрунтування: Оскільки немає прямих доказів щодо пацієнтів із COVID-19, для створення даної рекомендації група фахівців використовувала непрямі докази, отримані від критично хворого населення. У RКД, що порівнює HFNC із звичайною кисневою терапією у пацієнтів з гострою гіпоксичною дихальною недостатністю, HFNC призводив до зниження 90-денної смертності (OR 0,42, 95% ДІ 0,21 до 0,85), але не знижував ризик інтубації [71]. Систематичний огляд та метааналіз 9 RCT (2093 пацієнтів) показали, що HFNC сильніше знижує частоту потреб в інтубації порівняно зі звичайним киснем (0,85 RR, 95% ДІ 0,74 до 0,99), але не впливає на ризик смерті або тривалість перебування у ВАІТ [72–74 ]. Незважаючи на те, що дані щодо смертності та тривалості перебування були не настільки сильними, зменшення потреби в інтубації є важливою знахідкою, особливо з точки зору пандемій, таких як COVID-19, де такі ресурси, як ліжка ВАІТ та апарати штучної вентиляції легень, можуть стати обмеженим ресурсом. Крім того, при ГРВІ є повідомлення про посилення передачі захворювання медичним працівникам, особливо медичним сестрам, під час ендотрахеальної інтубації (OR 6,6, 95% Cl 2,3 до 18,9) [29, 75, 76]. Незважаючи на те, що це висновок, який ґрунтується переважно на ретроспективних спостереженнях, HFNC не представляє підвищеного ризику передачі захворювання. У дослідженнях, що оцінювали бактеріальне забруднення навколишнього середовища, HFNC представляв ризик забруднення, подібний до звичайного кисню [77]. При SARS медичні працівники, які працювали з пацієнтом на HFNC, не мали підвищеного ризику розвитку захворювання [75]. Нарешті, пацієнтам може здатися, що HFNC зручніше, або, принаймні, є таким же комфортним, як звичайна киснева терапія [71, 74]. Хоча деякі автори радили уникати використання HFNC у пацієнтів із COVID-19 через страх передачі захворювання, досліджень, що підтримують цю рекомендацію, бракує [78]. Незважаючи на те, що деякі пропонують пацієнтам носити маски під час терапії HFNC, ми не впевнені в ефективності та безпеці цього підходу. Це питання можна було б вирішити в майбутніх дослідженнях.
Рекомендація: 26. У дорослих із COVID-19 та гострою гіпоксемічною дихальною недостатністю ми пропонуємо використовувати HFNC замість NIPPV (слабка рекомендація, докази низької якості).
Обґрунтування: У дорослих людей, які страждають на COVID-19 та гостру респіраторну недостатність, ми пропонуємо використовувати HFNC замість NIPPV. У RK4, що порівнювало HFNC з NIPPV у пацієнтів з гострою гіпоксичною дихальною недостатністю, HFNC призводив до зниження 90-денної смертності (HR 2,50, 95% ДІ 1,31 до 4,78), але не вплинув суттєво на потребу в інтубації (50% показник неефективності у NIPPV проти 47% при звичайній подачі кисню та 40% у групах HFNC; p=0,18) [71]. Інший метааналіз, що порівнював HFNC з NIPPV, показав, що HFNC зменшує потребу в інтубації пацієнтів, але не суттєво зменшує смертність або тривалість перебування у відділеннях інтенсивної терапії [72]. Крім того, пацієнтам може здатися, що метод HFNC більш комфортний, ніж NIPPV [71]. Зважаючи на дані щодо зниження ризику інтубації при HFNC у порівнянні з NIPPV при гострій гіпоксемічній дихальній недостатності та дослідження, що свідчать про те, що NIPPV може нести більший ризик нозокоміального зараження медичних працівників, ми пропонуємо надавати перевагу HFNC перед NIPPV. Однак за будь-якими пацієнтами, які отримують HFNC або NIPPV, слід вести ретельний контроль та доглядати за ними, так як у випадку декомпенсації вони потребуватимуть інтубації, оскільки рівень неефективності вентиляції може бути високим, а екстрена інтубація в неконтрольованих умовах може збільшити ризик нозокоміальної інфекції медичних працівників [79, 80].
Рекомендація: 27. У дорослих із COVID-19 та гострою гіпоксемічною дихальною недостатністю, якщо HFNC недоступний та немає термінових показань до ендотрахеальної інтубації, ми пропонуємо проведення проби з NIPPV з ретельним моніторингом та періодичною оцінкою на предмет посилення дихальної недостатності (слабка рекомендація, дуже низькі докази якості).
- Ми не змогли дати рекомендацію щодо переваг використання шолома NIPPV порівняно з маскою NIPPV. Це варіант, але ми не впевнені в його безпеці та ефективності при COVID- 19.
- У дорослих із COVID-19, які отримують NIPPV або HFNC, ми рекомендуємо ретельно контролювати респіраторний статус на предмет погіршення та проводити ранню інтубацію в контрольованих умовах, якщо відбувається погіршення (найкраща практика).
Обґрунтування: У дорослих, які страждають на гіпоксичну дихальну недостатність від COVID- 19, немає прямих доказів, що б свідчили на користі застосування NIPPV; окрім того, деякі попередні дослідження припускали, що його застосування може бути пов’язано із підвищеним ризиком передачі інфекції медичним працівникам. Метааналізи РКД показали зменшення ризиків інтубації та смертності при використанні NIPPV при гіпоксичній дихальній недостатності. Однак ці метааналізи включали дослідження, що фокусувались на імуноскомпрометованих особах, гострих кардіогенних набряках легенів або на післяопераційних пацієнтах; тому їх результати можуть бути менш застосовними для пацієнтів із COVID-19, у яких гостра гіпоксемічна дихальна недостатність та ГРДС є більш поширеними. [43, 81-83] При гострій гіпоксемічній дихальній недостатності, що відрізняється за етіологією від кардіогенного набряку легенів, NIPPV має високий показник неефективності. В одному РКД повідомлялося про неефективність у 49% пацієнтів з гіпоксичною дихальною недостатністю, що знаходились на NIPPV; тому цим пацієнтам потрібна була інтубація [71]. Крім того, у пацієнтів з гіпоксичною дихальною недостатністю, рандомізованими за NIPPV, спостерігалась вища смертність (28%, 95% CI 21%–37%) ніж у пацієнтів, які отримували консервативну оксигенотерапією (23%, 95% CI 16%–33%) або HFNC (13%, 95% CI 7%–20%) (p=0.02).
У когорті пацієнтів із близькосхідним респіраторним синдромом (MERS) NIPPV не був пов’язаний із зменшенням показників смертності чи тривалості перебування, порівняно з пацієнтами, які інтубувались без спроби NIPPV [79]. Однак NIPPV асоціювався з високим рівнем неефективності (92,4%), що призводило до інтубації. Пацієнти, які отримували NIPPV до інтубації, мали підвищені потреби в оксиді азоту що збільшувало рівень смертності [79]. Частота неефективності при інших пандеміях, таких як грип, H1N1 та SARS, коливається в межах від 10% до 70%, тоді як демонстрація ефективності в основному з’являється у серіях випадків та обсерваційних досліджень, а не у РКД, що призводило б до зміни практики. У Китаї поширення використання NIPPV при пандемічній респіраторній інфекції є загальним, тоді як вказівки з Європи, Гонконгу та США свідчать не на користь використання NIPPV в якості терапії першого ряду H1N1 [84]. Існують додаткові занепокоєння щодо використання NIPPV при респіраторних пандеміях, таких як COVID-19: NIPPV може погіршити важкі форми пошкодження легенів внаслідок шкідливого транспульмонального тиску та великих дихальних об’ємів [85, 86] і може затримати початок інвазивної механічної вентиляції , що призводить до виникнення надзвичайних ситуацій або до більш нестабільних інтубацій, які можуть підвищити ризик передачі інфекції до медичної команди [85]. Крім того, NIPPV — це аерозоль-утворююча процедура, яка може підвищити ризик передачі захворювання медичним працівникам [29]. Кілька інших досліджень та метааналізів з приводу SARS також підкреслили ризик нозокоміального поширення захворювання при NIPPV [76, 87].
Баланс між користю та шкодою при застосуванні NIPPV у дорослих із COVID-19 є незрозумілим. Якщо у деяких пацієнтів із COVID-19 виникають інші форми дихальної недостатності, такі як гостра гіперкапнічна респіраторна недостатність або гострий кардіогенний набряк легенів, які, як відомо, є причиною дихальної недостатності, застосування NIPPV може бути корисним [88, 89]. Однак, оскільки обмежений досвід застосування NIPPV в пандемії свідчить про високий рівень неефективності, ми рекомендуємо будь-якого пацієнта, який отримує NIPPV, ретельно контролювати та доглядати в умовах, де інтубація може бути полегшена у випадку декомпенсації [79, 80]. Однак, коли умовах обмежених ресурсів, здатність забезпечити інвазивну вентиляцію може бути недостатньою, і навіть помірний шанс на успіх із застосуванням NIPPV може виправдати його використання.
Якщо використовується NIPPV, шолом NIPPV є привабливим варіантом, за його наявності. Одноцентрове дослідження РКД показало зменшення частоти інтубації та покращення смертності від NIPPV, за допомогою шолому, у пацієнтів із ГРДС [90]. Особливе значення в обстановці пандемії, такої як COVID-19, NIPPV шолом мав для зменшення дисперсії повітря, що видихається, тоді як маски для обличчя були недостатньо [91]. Однак шолом NIPPV є дороговартісним, і без прямих доказів користі для пацієнтів із COVID-19 для придбання цього обладнання, за його відсутності, не можуть використовуватись ресурси. На малюнку 2 узагальнено рекомендації щодо HFNC та NIPPV у пацієнтів із COVID-19.
Інвазивна механічна вентиляція
Рекомендація: 30. У дорослих на ШВЛ із COVID-19 та ГРДС ми рекомендуємо надавати перевагу вентиляції з низьким дихальним (Vt) об’ємом (Vt 4–8 мл/кг передбачуваної маси тіла), перед великим дихальним об’ємом (Vt >8 мл/кг ) (сильна рекомендація, докази помірної якості).
Обґрунтування: В даний час не існує досліджень, що стосуються стратегій ШВЛ у пацієнтів із COVID-19. Однак група експертів вважає, що пацієнтів, які знаходяться на механічній вентиляції з COVID-19 слід вести аналогічно іншим пацієнтам з гострою дихальною недостатністю у відділенні інтенсивної терапії. Хоча механічна вентиляція є потенційно рятувальним методом лікування, вона може викликати вентилятор асоційоване пошкодження легень, що в свою чергу сприятиме виникненню поліорганної недостатності у пацієнтів з ГРДС [86]. Однією з основних стратегій вентиляції для мінімізації VILI є вентиляція з низьким дихальним об’ємом.
Систематичний огляд та метааналіз РКД виявили зворотній зв’язок між більшим градієнтом Vt та смертністю [92]. Крім того, автори встановили, що використання протоколізованої стратегії з низьким рівнем Vt з високим РЕЕР (9 РКД та 1629 пацієнтів) знижувало ризик смерті (RR, 0,80, 95% ДІ, 0,66 до 0,98) [92]. Наш аналіз 5 РКД (1181 пацієнт) показав зменшення внутрішньолікарняної смертності у пацієнтів, яким проводилась вентиляція низьким ДО (RR 0,73, 95% ДІ 0,63 до 0,85) [93–98]. На підставі наявних даних, кілька настанов рекомендували використовувати низький ДО (4-8 мл/кг ідеальної маси тіла) у пацієнтів з ГРДС [99, 100]. Комісія оцінила, що ефективність буде помірною, вартість низькою, а втручання прийнятним та можливим для здійснення, через що була видана сильна рекомендація щодо використання низького дихального об’єму (4–8 мл/кг) при вентиляції хворих на ГРДС.
Практичні міркування: Протокол дослідження ARDSNet встановив початковий Vt на 6 мл/кг, який може бути збільшений до 8 мл/кг, якщо пацієнт з подвійним тригеруванням або якщо тиск у дихальних шляхах на вдиху знижується нижче PEEP [95]. Дотримання цільового Vt у пацієнтів із спонтанним диханням із ГРДС є викликом; десинхронія пацієнта з апаратом ШВЛ не є рідкістю [101].
Рекомендація: 31. Для дорослих на ШВЛ з COVID-19 та ГРДС ми рекомендуємо орієнтуватись на плато тиск (Pplat) <30 см H2O (сильна рекомендація, помірний ступінь доказовості).
Обґрунтування: Не існує клінічних досліджень, які б вивчали вплив обмеження тиску плато (Pplat) при ГРДС, спричиненому COVID-19. Однак є велика кількість непрямих доказів у пацієнтів із ГРДС. Поряд із вентиляцією з низьким ДО, обмеження Pplat — це захисна стратегія легенів для зниження ризику виникнення VILI. Систематичний огляд та метааналіз РКД виявив, що використання захисної стратегії, включно з протоколізованим низьким ДО та Pplat <30 см H2O (9 РКД та 1629 пацієнтів), знижувало ризик смерті (RR, 0,80, 95% ДІ, 0,66 до 0,98) [92]. Подальший метааналіз РКД, що порівнював вентиляційні стратегії із низьким та високим Pplat у пацієнтів із ГРДС (15 досліджень), виявив, що короткочасна смертність була вищою у пацієнтів із Pplat> 32 смН2О протягом першого тижня у ВРІТ (1-й день: 0.77 RR, 95% ДІ 0,66–0,89; День 3: RR 0,76, 95% ДІ 0,64–0,90; День 7: RR 0,78, 95% ДІ 0,650,93) [102]. На підставі наявних даних, декілька клінічних настанов рекомендували зберігати Pplat <30 см H2O у пацієнтів із ГРДС [99, 100]. Робоча група визначила, що позитивний ефект буде помірним, вартість — низькою, значення для пацієнтів ще буде досліджуватись, а втручання — прийнятним і доцільним для здійснення, тому видала сильну рекомендацію щодо збереження Pplat <30 см H2O для вентиляції хворих на ГРДС.
Практичні міркування: Згідно протоколу дослідження ARDSNet початковий Vt був встановлений 6 мл/кг, а потім визначався Pplat (після 0,5 секундної вдихувальної паузи) [95]. Якщо Pplat> 30 см H2O, Vt має бути зменшений на 1 мл/кг (до 4 мл/кг), поки Pplat не буде в потрібних межах.
Рекомендація: 32. Для дорослих, які знаходяться на механічній вентиляції легень із COVID- 19 з середньотяжким та тяжким ГРДС ми пропонуємо більше використовувати стратегію високого PEEP, замість стратегії низького PEEP (слабка рекомендація, низький рівень доказовості).
Зауваження: Якщо використовується стратегія високого PEEP (тобто PEEP >10 см H2O), повинна проводитися динамічна оцінка пацієнтів на предмет баротравми.
Обґрунтування: У пацієнтів з ГРДС PEEP використовується для запобігання повторного відкриття та закриття альвеол (тобто ателектотравми), для зменшення VILI. Крім того, підтримка альвеол у відкритому стані покращує оксигенацію та зменшує потребу в кисні.
Немає клінічних випробувань, які б вивчали вплив РЕЕР при коронавірус-індукованому ГРДС. Однак є велика кількість непрямих доказів у пацієнтів із ГРДС. Індивідуальний метааналіз даних про пацієнтів (IPDMA) з 3 найбільших досліджень (2299 пацієнтів) з високим PEEP [103–105] не виявив різниці в смертності у всіх пацієнтів у стаціонарі (0,94 RR, 95% ДІ 0,86–1,04) [ 106]. Однак у пацієнтів із ГРДС стратегія високого РЕЕР призвела до зниження рівня смертності у ВАІТ (0,85 RR, 95% ДІ 0,76 до 0,95), нижчого рівня смертності в стаціонарі (0,90 RR, 95% ДІ на 0,81 до 1,0) та зменшення частоти реанімаційних заходів (RR 0,63, 95% ДІ 0,53 до 0,75), з іншого боку збільшився ризик пневмотораксу [106].
Нещодавній систематичний огляд та метааналіз 9 РКД (3612 пацієнтів) вивчав вплив стратегії вищого рівня PEEP на важливі цільові показники [107]. Загалом, стратегія використання вищого рівня PEEP не зменшила смертність у лікарнях (0,92 RR, 95% ІС, 0,79 до 1,07). Однак у підгрупі, до яких залучалися пацієнти, що продемонстрували підвищення показників оксигенації у відповідь на підвищення PEEP (6 RCTS, 1888 пацієнтів), використання високого рівня PEEP значно знизило внутрішньолікарняну смертність, порівняно із стратегією нижчого рівня PEEP (RR 0,83, 95% ДІ 0,69 до 0,98) . Хоча сукупність даних свідчить про сприятливий вплив вищого РЕЕР на відібраних пацієнтів, результати, ймовірно, будуть змінені тим фактом, що вентиляція з низьким дихальним об’ємом в цих контрольних групах не використовувалася [108].
Не існує чіткого і узгодженого визначення високого PEEP; крім того, оптимальний рівень PEEP у пацієнтів із ГРДС невідомий і, ймовірно, може змінюватися залежно від ступеня захворювання та інших факторів. У вищезгаданому IPDMA, середній рівень PEEP у групі на вентиляції з високим рівнем PEEP становив 15,3 та 13,3 см H2O у 1 та 3 дні відповідно, порівняно із середніми значеннями 9 та 8,2 см H2O у 1 та 3 дні у групі низького рівня PEEP [106]. Хоча клініцисти можуть довільно розглядати рівень PEEP >10 см H2O як стратегію більш високого рівня PEEP, а рівень PEEP <10 см H2O як стратегію нижчого рівня PEEP.
Практичні міркування: Оскільки IPDMA поєднала різні стратегії для встановлення вищого рівня PEEP, доцільно було б реалізувати стратегію, що використовується у великих РКД, які були включені (наприклад, ALVEOLI, LOV та ExPRESS) [103–105]. Після підвищення рівня PEEP клініцисти повинні слідкувати за своїми пацієнтами на предмет виникнення баротравми. Важливо, що більш високий рівень PEEP може призвести до підвищення рівня Pplat, а Pplat >30 смН2О має власні недоліки та переваги. Клініцисти можуть використовувати стратегії протоколів ГРДС для визначення оптимального рівня PEEP. Інші доступні стратегії включають стратегію поступового зниження рівня PEEP, черезстравохідну балонну техніку та електричну імпедансну томографію. Однак ефект від використання цих методик на перебіг захворювання невідомий.
Рекомендація: 33. Для дорослих, що знаходяться на ШВЛ із COVID-19 та ГРДС ми пропонуємо використовувати стратегію консервативної інфузійної терапії, замість ліберальної (слабка рекомендація, низький рівень доказовості).
Обґрунтування:
Оптимальна стратегія інфузійної терапії при COVID-19 невідома, проте можна припустити, що ці пацієнти будуть мати відповідь на інфузійну терапію, аналогічно іншим пацієнтам з ГРДС. Обмежені дані, доступні для COVID-19, показують, що ізольована серцева недостатність або її поєднання з дихальною недостатністю була причиною 40% смертей від COVID-19 [46]. Ще одне дослідження показало, що 44% пацієнтів із COVID-19 мали аритмію [43]. Дані свідчать про наявність пошкодження міокарда у деяких пацієнтів із COVID-19. Мало опубліковано РКД, які порівнюють консервативну з ліберальною стратегією інфузійної терапії під час ГРДС. Нещодавній систематичний огляд включав 5 РКД, які включили 1206 пацієнтів із ГРДС. Ризик смерті був однаковим для обох груп: 28% у групі консервативної стратегії та 31,1% у групі ліберальної стратегії (RR 0,91, 95% ДІ 0,77–1,07) [52]. Це дослідження включало важкохворих пацієнтів із ГРДС і без, автори виявили, що консервативна стратегія зменшила тривалість перебування у ВАІТ (MD 1,82 дня; 95% ДІ 0,53 до 3,10 дня) та зменшила тривалість перебування в стаціонарі (МД — 1,88 дня, 95% ДІ -0,12 до -3,64 дня) порівняно з ліберальною стратегією інфузійної терапії. Не було різниці в кількості ускладнень включно з нирковою недостатністю між двома групами. Визначне дослідження серед пацієнтів з ГРДС (FACTT) виявило значне скорочення тривалості ШВЛ при консервативній інфузійній стратегії [109]. Крім того, більшість хворих на COVID-19, що знаходяться в стаціонарі — літні люди, у яких може розвинутися дисфункція міокарда, яка в свою чергу може обмежити насосну функцію серця. [46]. З огляду на помірні переваги, які спостерігаються в інших групах ГРДС, комісія сформувала слабку рекомендацію на користь консервативної інфузійної стратегії у пацієнтів із COVID-19 та ГРДС.
Рекомендація: 34. Для дорослих пацієнтів, які знаходяться на механічній вентиляції легень, які страждають на COVID-19 з середньотяжким та тяжким ГРДС, ми пропонуємо вентиляцію у положенні на животі від 12 до 16 годин, замість вентиляції у звичайному положенні (слабка рекомендація, низький рівень доказовості).
Обґрунтування:
У дослідженні 81 пацієнта з COVID-19 рентгенологічні ознаки прогресували протягом перших 1–2 тижнів після виникнення симптомів від переважаючого феномену матового скла до змішаної картини з переважанням консолідації в базальних відділах. Цей рентгенологічний патерн може слугувати підґрунтям для проведення вентиляції в положенні на животі[110].
Теоретично положення на животі робить вентиляцію більш однорідною за рахунок зменшення перерозтягнення альвеол, які знаходяться в передніх відділах легень та колапсу альвеол, що знаходяться в задніх відділах легень. Це може зменшити різницю між дорсальним та вентральним транспульмональним тиском, а також знизити компресію легень [112] та покращити їх перфузію [113].
Нещодавно проведене дослідження, яке описувало клінічний перебіг COVID-19 у відділенні інтенсивної терапії, показало, що вентиляція у положенні на животі застосовується у 11,5% пацієнтів (6 з 52) [42]. Однак не існує досліджень, що описують особливості перебігу захворювання у пацієнтів із COVID-19, які вентилювались у положенні на животі.
Нещодавній систематичний огляд та метааналіз 9 РКД (2129 пацієнтів) показали, що вентиляція у положенні на животі щонайменше 12 годин, у пацієнтів із середньотяжким та тяжким ступенем ГРДС, була асоційована зі зниженою смертністю (5 RCT; RR 0,74, 95% ДІ 0,56 до 0,99), але не вплинула на смертність у дослідженнях, які застосовували вентиляцію у положенні на животі протягом <12 годин (3 RCT; RR 1,03, 95% ДІ 0,88 до 1,20). З іншого боку, вентиляція у положенні на животі збільшувала ризик виникнення пролежнів (1.22 RR, 95% ДІ 1,06–1,41) і непрохідності ендотрахеальної трубки (RR 1,76, 95% ДІ 1,24–2,50) [114]. Інші систематичні огляди дійшли аналогічних висновків [115–117].
Немає достовірних даних, що вентиляція у положенні на животі більше 12 годин у пацієнтів із помірним та важким ступенем ГРДС знижує смертність, але може збільшити ризик виникнення пролежнів та непрохідності ендотрахеальної трубки. Медичні працівники, які лікують пацієнтів із COVID-19, повинні навчатись правильній техніці для виконання заходів інфекційного контролю у разі випадкового від’єднання ендотрахеальної трубки від апарату ШВЛ. Положення пацієнта на животі не пов’язане зі значними витратами, і ми вважаємо, що це може забезпечити значну користь. Крім того, вентиляція у положенні на животі може бути здійснена в умовах закладів низького та середнього доходу та не потребує значних зусиль, тому слід забезпечити необхідне навчання та освіту медичних працівників для полегшення даної практики .
Практичні міркування:
Протокол вентиляції у положенні на животі повинен використовуватися в усіх установах, виходячи з наявних ресурсів та рівня навчання. Якщо використовується вентиляція у положенні на животі, медичні працівники повинні знати про такі ускладнення, як пролежні, зміщення внутрішньвенного катетера та ендотрахеальної трубки, набряк обличчя, тимчасова гемодинамічна нестабільність, ерозії рогівки, травми плечового сплетення та проблеми прохідності судинного доступу на гемодіалізі.
Крім того, клініцисти повинні бути ознайомлені з абсолютними протипоказаннями для вентиляції у положенні на животі, наприклад нестабільність хребта, відкритий живіт або відкрита грудна клітка (тобто операція або травма). Ентеральне харчування через назогастральний або назодуоденальний зонд може бути продовжене під час вентиляції у положенні на животі [118, 119].
Рекомендації: 35. Для дорослих на ШВЛ, з COVID-19 та середньотяжким або важким ГРДС:
35.1. Ми пропонуємо використовувати за необхідності болюсне введення міорелаксантів аніж їх тривалу інфузію NMBA, для полегшення протективної вентиляції легень (слабка рекомендація, низький рівень доказовості).
35.2. У разі стійкої десинхронізації з апаратом ШВЛ, необхідності постійної глибокої седації, вентиляції у положенні на животі або з постійним високим тиском плато, ми пропонуємо використовувати безперервну інфузію NMBA до 48 годин (слабка рекомендація, низький рівень доказовості).
Обґрунтування:
Кілька професійних товариств видали рекомендації щодо використання NMBA у пацієнтів з ГРДС [100, 120–123]. Більшість виданих рекомендацій на користь застосування інфузії NMBA у пацієнтів із середньоважким та важким ГРДС. Ці рекомендації здебільшого ґрунтувалися на сукупних оцінках від 3 РКД (431 пацієнт) , що показали зменшення 90-денної смертності при інфузії NMBA у порівнянні з відсутністю інфузії NMBA [124]. Однак результати повторної оцінки використання ранньої системної нервово-м’язової блокади (ROSE) оскаржують попередні випробування. Дослідники випробування ROSE рандомізували 1 006 пацієнтів із середньотяжким та тяжким перебігом ГРДС з подальшим отриманням або інфузії NMBA протягом 48 годин, або переривчастих болюсів NMBA [125]. Випробування ROSE показало, що безперервна інфузія цисатракурію не виявила жодних показових результатів для пацієнта.
Через відмінності в дизайні між дослідженням ROSE та попередніми дослідженнями ми не провели метааналіз для оцінки рівнів смертності, хоча сукупна оцінка частоти баротравми свідчила на користь постійної інфузії NMBA (RR 0,55, 95% ДІ 0,35 до 0,85). Робоча група припускає, що до безперервної інфузії NMBA слід залучити пацієнтів, які мають показання до тривалої міорелаксації, при якій болюсне введення може бути недостатнім, наприклад для пацієнтів зі стійкою дисинхронізацією з ШВЛ та пацієнтів, які потребують постійної глибокої седації для вентиляції або стійкого високого тиску плато. Вплив NMBA на довгострокові результати є невідомим.
Рекомендації: 36. У дорослих, що знаходяться на ШВЛ із COVID-19 та ГРДС ми не рекомендуємо застосовувати звичайні засоби, напр., інгаляційний оксид азоту (сильна рекомендація, докази низької якості).
- У дорослих на ШВЛ із COVID-19 та важким ГРДС і гіпоксемією, на які не впливає оптимізація вентиляції та інші стратегії, ми пропонуємо пробу з інгаляційним легеневим вазодилататором у якості терапії порятунку; якщо не спостерігається швидкого поліпшення оксигенації, інгаляцію слід припинити або зменшити використання інгаляційного вазодилятатора (слабка рекомендація, докази дуже низької якості).
Обґрунтування:
Немає досліджень, які описують використання легеневих вазодилататорів у пацієнтів із COVID-19. Кокранівський огляд виявив 13 РКД (1243 пацієнтів) що фокусувались на застосуванні інгаляційного оксиду азоту при ГРДС; цей вид терапії не показав, суттєвого впливу на смертність (1,04 RR, 95% ДІ 0,9–1,19), також виявили зв’язок з підвищеним ризиком гострого ураження нирок (RR 1,59, 95% ДІ 1,17–2,16). Інгаляційний оксид азоту призводить до тимчасового поліпшення оксигенації. Підгрупа досліджень, повідомила про підвищення значень PaO2/FiO2 (мм рт.ст.) у періоді до 24 годин після закінчення втручання що показало статистично значущу різницю на користь вдихуваного оксиду азоту, але яка не спостерігалась у періоді після 24 години. Жодне дослідження не оцінювало використання інгаляційного оксиду азоту як терапії «порятунку» [126]. Через можливу шкоду від вдихуваного оксиду азоту та відсутність чіткого впливу на зниження рівня смертності, робоча група випустила сильну рекомендацію проти його рутинного застосування у пацієнтів із ГРДС. Однак з огляду на покращення оксигенації, випробування інгаляційного оксиду азоту як терапії «порятунку», того як інші варіанти вичерпані, є доцільним, якщо він є в наявності. Якщо інгаляційний оксид азоту не призводить покращення оксигенації, його потік слід зменшити або вимкнути, з метою уникнення значної легеневої вазоконстрикції, що може виникнути при тривалому застосуванні та різкому припиненні застосування. Жодне РКД, що виконувалось на належному рівні, не оцінювало застосування інгаляційних простациклінів, таких як іліопрост, тому ми не можемо рекомендувати їх застосування при важких ГРДС.
Рекомендації:
- Для дорослих пацієнтів з COVID-19, що перебувають на ШВЛ і мають гіпоксемію, незважаючи на оптимізацію налаштувань вентиляції, ми рекомендуємо надавати перевагу проведенню рекрутмент маневру (слабка рекомендація, низький рівень доказовості).
- Якщо мобілізаційні маневри проводяться, ми не рекомендуємо застосування покрокового методу (поступове збільшення РЕЕР) для рекрутмент маневру (сильна рекомендація, середня якість доказових даних).
Обґрунтування:
Відсутні дослідження, які б оцінювали роль рекрутмент маневру у пацієнтів з ГРДС на фоні COVID-19. Метою РМ є покращення оксигенації, шляхом підвищення тиску в дихальних шляхах для розкриття ателектованих альвеол [127]. Однак вплив високих рівнів позитивного тиску може призвести до розвитку баротравми, а також стати причиною транзиторної гіпотензії у пацієнтів, які вже є критично хворими та нестабільними. Ми оцінили 8 рандомізованих контрольованих досліджень (далі РКД), що займались РМ у пацієнтів з ГРДС, включно з пацієнтами, що мали сепсис у зв’язку з бактеріальною або вірусною пневмонією. Для мобілізації ателектованої тканини легень були використані різноманітні стратегії, однак дві стратегії, були особливо поширені у 8 рандомізованих контрольованих дослідженнях, що були включені до цього метааналізу. Традиційні методики РМ описують як подовження вдоху протягом фіксованого проміжку часу на вищих рівнях режиму СРАР, найчастіше при 30-45 см водяного стовпа протягом 40 секунд [93, 104, 128, 129]. РМ шляхом покрокового підвищення титрації РЕЕР, описують як поступове підвищення РЕЕР від 25 до 35 і до 45 см водного стовпа протягом 1-2 хвилин на кожному показнику тиску [130–133].
У систематичному огляді і метааналізі шести РКД (1,423 пацієнти). Застосування РМ зменшувало смертність та використання реанімаційних заходів, покращувало оксигенацію протягом 24 годин без підвищення ризику баротравми [134]. Також нами було знайдено 8 РКД (2,554 пацієнти), де було надано дані про внутрішньолікарняну смертність. У цих дослідженнях застосування РМ не було пов’язано зі зменшенням смертності (відношення ризиків 0.90, 95% довірчий інтервал від 0.78 до 1.04). Однак субпопуляційний аналіз надав дані, що традиційні методики РМ значно знижували смертність (ВР 0.85, 95%ДІ від 0.75 до 0.97), тоді як РМ з поступовим підвищенням титрації РЕЕР підвищував смертність (ВР 1.06, 95% ДІ від 0.97 до 1.17). Оскільки ефекти РМ на оксигенацію можуть бути тимчасовими, дослідження показали значиме покращення в оксигенації після 24 годин після їх застосування. У дослідження використовувались різні рівні РЕЕР у групі втручання та групі контролю; РМ є найбільш ефективними у поєднанні з стратегією вищого РЕЕР.
Пацієнти з важким ГРДС та гіпоксемією можуть отримати позитивний результат від мобілізаційних маневрів у поєднанні з вищими рівнями РЕЕР, але необхідні доказові дані специфічні для COVID-19. Пацієнти, яким проводяться ММ мають знаходитись під пильним спостереженням на предмет розвитку важкої десатурації, гіпотензії або баротравми. ММ мають бути зупинені, якщо вони ведуть до погіршення стану пацієнта.
Рекомендація: 40. У дорослих з COVID-19, що знаходяться на ШВЛ, та рефрактерною гіпоксемією, незважаючи на оптимізацію налаштувань вентиляції, ми пропонуємо використання веновенозного ЕКМО, якщо є така можливість, або направлення пацієнта до центру де наявне ЕКМО (слабка рекомендація, низький рівень доказовості).
Зауваження: Через ресурсомістку природу ЕКМО та потребу у медичних центрах та працівниках з досвідом проведення цієї процедури, ЕКМО має розглядатись лише у ретельно відібраних пацієнтів з COVID-19 та важким ГРДС.
Обґрунтування:
Відсутні клінічні дослідження з використання ЕКМО у пацієнтів з COVID-19. Нещодавні дані з Китаю повідомляють, що 11,9% пацієнтів з COVID-19 у відділеннях ІТ отримували ЕКМО [42], але про подальший перебіг захворювання та результати лікування цих пацієнтів не повідомлялось.
Міністерство охорони здоров’я Саудівської Аравії заснувало програму ЕКМО протягом епідемії MERS-CoV. У ретроспективному когортному дослідженні 35 пацієнтів з MERS-CoV та рефрактерною гіпоксемією, група пацієнтів, яка отримувала вено-венозну ЕКМО мала нижчу внутрішньолікарняну смертність (65 проти 100% , Р=0,02) [135]. Однак, у цьому когортному дослідженні існує великий ризик похибки відбору зважаючи на його ретроспективний дизайн.
Лише два РКД порівнювали ЕКМО з традиційною ШВЛ при важкому ГРДС. Настанови, опубліковані у 2017 році не змогли надати специфічних рекомендацій з використання ЕКМО і було рекомендовано подальше дослідження питання [99]. Хоча найбільш недавнє РКД (EOLIA) було зупинено до завершення через відсутність перспективи [136], повторний аналіз цього дослідження з використанням беєсівського підходу надав більш сприятливу інтерпретацію, що припускала меншу смертність при використанні ЕКМО на фоні важкого ГРДС [137]. Нещодавній систематичний огляд, що включав у себе 2 РКД (429 пацієнтів) виявив зменшення 60-денної смертності при використанні ЕКМО (RR 0.73, 95% ДІ від 0.58 до 0.92), але ризик серйозної кровотечі був вищим при використанні ЕКМО [138].
ЕКМО — це ресурсомістка техніка, що обмежується спеціалізованими центрами, і залишається дуже обмеженим ресурсом. Таким чином, її використання має бути обмеженим до ретельно відібраних пацієнтів ECMO [139]. Подальші дослідження, що описують перебіг захворювання у пацієнтів з COVID-19 на фоні використання ЕКМО та механізми смерті покращать наше розуміння та вплинуть на подальшу практику.
VI. Медикаментозна терапія COVID-19
У цьому дослідженні ми обговоримо можливі опції лікування SARS CoV-2 та його ускладнень, включно з противірусними препаратами, імуносупресивyими препаратами, імуномодуляторами та іншими видами терапії.
Синдром «цитокінової бурі»
Синдром цитокінової бурі — це стан надмірної запальної відповіді, що характеризується блискавичною поліорганною недостатністю та підвищенням рівня цитокінів. Нещодавнє дослідження з Китаю показало, що COVID-19 пов’язаний з підвищенням цитокінового профілю, що нагадує вторинний гемофагоцитарний лімфогістіоцитоз (ГЛГ). [44]. Деякі автори навіть припускають, що можна проводити скринінг важкохворих пацієнтів з COVID-19 на ГЛГ, використовуючи шкалу Hscore [140], і що кортикостероїди та імуносупресивні препарати можуть використовуватись у пацієнтів з високою вірогідністю ГЛГ [141]. Більша кількість доказових даних необхідна для створення рекомендацій з варіантів лікування цитокінової бурі.
Рекомендації:
- У дорослих пацієнтів з COVID-19 та дихальною недостатністю, що знаходяться на ШВЛ (без ГРДС), ми не рекомендуємо рутинно використовувати системні кортикостероїди (слабка рекомендація, низький рівень доказовості).
- У пацієнтів з COVID-19 та ГРДС ми пропонуємо надавати перевагу використанню системних кортикостероїдів, перед не використанням системних кортикостероїдів (слабка рекомендація, низька якість доказових даних).
Зауваження: Переважна більшість нашої робочої групи підтримала слабку рекомендацію (тобто пропозицію) з використання стероїдів у найбільш важких пацієнтів з COVID-19 та ГРДС. Однак через дуже низьку якість доказових даних, деякі члени робочої групи проголосували за те, щоб не публікувати рекомендацію до появи доказових даних більш високої якості.
Обґрунтування:
Відсутні контрольовані клінічні дослідження з використання кортикостероїдів у пацієнтів з COVID-19 або іншими коронавірусами. Опубліковане, але не рецензоване дослідження, надає дані з приводу 26 пацієнтів з важким перебігом COVID-19, у яких використання метилпреднізолону у дозі 1–2 мг/кг/добу протягом 5-7 днів було пов’язано з коротшою тривалістю потреби у кисневій підтримці (8.2 днів проти 13,5 днів; Р<0.001) та покращенню радіологічної картини легень [142]. Тим не менш, ми вирішили, що ці недосконалі дані є недостатньою основою для формування рекомендацій через ризик впливу сторонніх факторів. Однак ми використали непрямі доказові дані з позалікарняної пневмонії, ГРДС та інших вірусних інфекцій для підкріплення нашої рекомендації.
Існує декілька РКД з використання системних кортикостероїдів у госпіталізованих пацієнтів з позалікарняними пневмоніями, переважно це не пацієнти відділень ІТ, деякі з сепсисом або септичним шоком. Систематичний огляд та метааналіз РКД показав, що використання кортикостероїдів може знизити потребу у ШВЛ (5 РКД; 1060 пацієнтів; RR 0.45, 95% ДІ від 0.26 до 0.79), частоту розвитку ГРДС (4 РКД; 495 пацієнтів; RR 0.24, 95% ДІ від 0,10 до 0,56) та тривалість госпіталізації (6 РКД; 1499 пацієнтів; середня к-ть днів -1.00 день, 95% ДІ від -1,79 до -0,21), але підвищення ризику розвитку гіперглікемії під час лікування [143]. Однак дані дослідження включали різні популяції, тому вплив на смертність був неоднозначним, а також в них використовувались різні препарати та режими дозування. До того ж є деякі побоювання стосовно використовування кортикостероїдів при вірусних пневмоніях. Також існує вірогідність того, що результати неможливо застосувати для пацієнтів з COVID-19.
Надруковано багато обсерваційних досліджень з приводу використання стероїдів при вірусних пневмоніях (напр. вірус грипу, коронавіруси та інші), але вони можуть піддаватись впливу сторонніх факторів, оскільки важкі хворі зазвичай отримують кортикостероїди. Ми оновили нещодавній Кокрейнівський огляд з використання кортикостероїдів при грипі [144] та провели пошук досліджень з приводу інших коронавірусів. Ми включили всього 15 когортних досліджень з грипу та 10 з коронавірусів. Наш метааналіз відібраних обсерваційних досліджень показав зв’язок між використанням кортикостероїдів та підвищенням смертності (ВР 2.76, 95% ДІ від 2.06 до 3.69), але вплив на пацієнтів з коронавірусами залищився нез’ясованим (ВР 0.83, 95% ДІ від 0.32 до 2.17). Також ці дослідження є обмежені їх значною неоднорідністю. Ми знайшли значну однорідність між обсерваційними дослідженнями з використання кортикостероїдів при ГРДС, викликаному коронавірусами та при вірусному ГРДС у цілому (І2=82% та 77% відповідно). До того ж в обох випадках, сумарна статистика була направлена в бік шкоди від використанні кортикостероїдів.
Ми оновили нещодавній Кокрейнівський огляд [145] та виявили що одне РКД[146] , що займається проблемою ГРДС. Всього ми включили 7 РКД, в яких брали участь 851 пацієнт з ГРДС. Використання кортикостероїдів зменшило смертність (ВР 0.75, 95% ДІ від 0.59 до 0.95) та тривалість ШВЛ (середня к-ть днів -4.93, 95% ДІ від -7.81 до -2.06). Однак, ці дослідження не були сфокусовані на вірусному ГРДС, що обмежує можливість узагальнення їх результатів для пацієнтів з COVID-19. До того ж ми провели огляд обсерваційних досліджень з приводу використання кортикостероїдів при вірусному ГРДС, та визначили 4 когортних дослідження. Хоча точкова оцінка показала підвищення смертності, довірчий інтервал включав в себе значний негативний вплив та переваги (OR 1.40, 95% ДІ від 0.76 до 2.57). У нещодавно проведеному РКД (INTEREST trial), використання рекомбінантного інтерферону β1b (rIFN β1ba) не зменшувало смертність у пацієнтів з ГРДС, однак в підгрупі пацієнтів, що отримувала кортикостероїди, використання rIFN β1ba було пов’язане з підвищенням рівня смертності (OR, 2.53, 95% ДІ від 1.12 до 5.72) [147]. Єдині прямі докази надає ретроспективне когортне дослідження за участі 201 пацієнта з пневмонією викликаною COVID-19. Це дослідження показало зв’язок між кортикостероїдами та зниженням смертності у пацієнтів з COVID-19 та ГРДС (HR 0.38, 95%ДІ від 0.20 до 0.72). Однак дані не були оцінені на предмет наявності суміжних факторів впливу [148].
Вплив кортикостероїдів на пацієнтів з COVID-19, у яких розвинувся сепсис або септичний шок може бути інакшим. Нещодавні систематичні огляди та метааналізи РКД з сепсису показали незначні покращення в рівнях смертності та швидшого розрішення шоку при використанні кортикостероїдів у порівнянні з невикористанням [63, 149, 150] (див. попередній розділ з приводу підтримки гемодинаміки).
Широко відомо, що кортикостероїди мають широкий спектр побічних ефектів. При вірусній пневмонії у ВРІТ, декілька досліджень показали підвищення виділення вірусу при використанні кортикостероїдів [151–153], що потенційно є ознакою підвищення реплікації вірусу, однак клінічне значення підвищення виділення вірусів залишається нез’ясованим.
Враховуючи вищенаведене, робоча група прийняла рішення не рекомендувати рутинне використання системних кортикостероїдів при дихальній недостатності при COVID19 та пропонувати використання кортикостероїдів у більш важкохворій популяції пацієнтів з COVID19 та ГРДС. Якщо лікарі використовуватимуть кортикостероїди при ГРДС, вони повинні використовувати нижчі дози протягом меншого проміжку часу ніж зазвичай.
Рекомендація: 43. У пацієнтів з COVID19, які знаходяться на ШВЛ, та мають дихальну недостатність, ми рекомендуємо надавати перевагу використанню антибактеріальних/протимікробних агентів над їх невикористанням (слабка рекомендація, низька якість доказових даних).
Зауваження:
Якщо команда, яка лікує пацієнта починає емпіричну антибіотикотерапію, вони мають проводити щоденну оцінку на предмет деескалації та повторно оцінювати тривалість терапії та спектр покриття антибіотика за результатами лабораторних досліджень та стану пацієнта.
Обґрунтування:
Немає контрольованих клінічних досліджень, які б оцінювали необхідність використання емпіричних протимікробних препаратів у пацієнтів з COVID-19 або іншими коронавірусами. Ця рекомендація спирається на дані, екстрапольовані з досліджень щодо інших вірусних пневмоній, зокрема грипозної [154]. Визначення бактеріальної ко-інфекції або суперінфекції у пацієнтів з COVID-19 є нелегким завданням, оскільки симптоми можуть залишатись такими ж як і при основній вірусній інфекції. Діагностична складність відображена у високих рівнях призначення в/в антибіотиків у м. Ухань: 53% з неважким перебігом та більше 90% пацієнтів що були госпіталізовані або знаходились у реанімації [1, 42, 43]. Дані з приводу поширеності бактеріальної суперінфекції у пацієнтів з COVID-19 є обмеженими, оскільки у більших дослідженнях кейсів, лікарі були часто занадто заклопотані для того щоб систематично отримувати високоякісний матеріал для бактеріологічного дослідження [1].
У важкохворих пацієнтів з MERS, 18% мали бактеріальну, а 5% — вірусну ко-інфекцію[155]. Ко-інфекція Staphylococcus aureus є досить частим випадком для грипозної пневмонії і може бути особливо вірулентною [154]. Нещодавні клінічні настанови рекомендували починати емпіричну антибіотикотерапію у пацієнтів з позагоспітальною пневмонією, які мають позитивний тест на грип [154]. Дані від пацієнтів з критично-важким перебігом демонструють вторинне інфікування у приблизно 11% випадків, хоча кількість і є маленькою. Виділені мікроорганізми включали в себе такі грам-негативні бактерії як K. pneumoniae, P. aeruganosa, та S. marcescens. Спираючись на ці обмежені дані, важко визначити патерни суперінфекції, включно з ризиком інфекції S. aureus, що часто зустрічається при грипі.
У пацієнтів з COVID-19 , та гіпоксичною дихальною недостатністю, які вимагають ШВЛ, робоча група пропонує емпіричне протимікробне лікування, на тих підставах, що суперінфекція є частим явищем у цій популяції та може призводити до значного підвищення смертності, як при пандемічному грипі [156-158]. Таким чином, критично хворі пацієнтами з підозрою або підтвердженим COVID-19 повинні отримувати емпіричну протимікробну терапію відповідно до клінічного синдрому (тобто позалікарняна або внутрішньолікарняна пневмонія). Вторинні інфекції виникають у пацієнтів з COVID-19, однак їх поширеність залишається невідомою через дуже обмежену кількість даних [159]. Ці інфекції повинні лікуватись відповідно до клінічних та мікробіологічних даних.
Рекомендація: 44. Для критично хворих пацієнтів з COVID-19 які мають лихоманку, ми пропонуємо надавати перевагу використанню ацетамінофену/парацетамолу для контролю температури над їх не використанням (слабка рекомендація, низька якість доказових даних).
Обґрунтування:
У більшості пацієнтів з COVID-19 розвивається лихоманка під час госпіталізації (92% пацієнтів з важким перебігом). У найбільшому звіті з Китаю, медіана температури у 1.099 пацієнтів складала 38.3 °C (IQR 37.8–38.9) [1]. Дані від критично хворих пацієнтів загалом є наявні. Ми провели огляд літератури та визначили 12 РКД (1.785 пацієнтів), у яких було досліджено ефект контролю лихоманки у популяції критично хворих, з виключенням неврологічних показань для контролю лихоманки [160–171]; активний контроль температури (фармакологічний або нефармакологічний) не зменшував ризику смерті (RR 1.03, 95% ДI від 0.81 до 1.31), тривалість перебування у ВРІТ (середня кількість днів -0.07 days, 95% ДI від -0.70 до 0.56), але був ефективний у зменшенні температури тіла (медіана — 0.36 °C, 95% ДI -0.42 до -0.29). Зважаючи на безпечність ацетамінофену та малу кількість негативних наслідків згідно доказових даних, підвищення комфорту пацієнта, шляхом контролю температури тіла може бути важливим. Таким чином, ми створили для клініцистів пропозицію з розгляду можливості використання фармакологічних агентів для контролю лихоманки у пацієнтів з COVID-19. Навколо використання нестероїдних протизапальних препаратів для лікування пацієнтів з COVID-19 продовжують вестись дискусії. До появи більшої кількості доказових даних, ми пропонуємо використання ацетамінофену/парацетамолу для лікування лихоманки.
Рекомендація: 45. У критично хворих пацієнтів з COVID-19 ми пропонуємо НЕ використовувати рутинно стандартні внутрішньовенні імуноглобуліни (ВВІГ) (слабка рекомендація, дуже низька якість доказових даних).
Обґрунтування:
Про використання ВВІГ відомо у декількох серіях випадків COVID-19, але відсутні дані з приводу їх ефективності [172]. За відсутності адекватних титрів нейтралізуючих антитіл, стандартні ВВІГ з високою вірогідністю на мають біологічного ефекту на COVID-19. Оскільки ВВІГ можуть мати імуномодулюючу дію, їх використання рідко може бути також пов’язаним з підвищеним ризиком розвитку серйозних побічних ефектів, включно з анафілактичними реакціями, асептичним менінгітом, нирковою недостатністю, тромбоемболією, гемолітичними реакціями, пов’язаним з трансфузією ураженням легень та іншими пізніми реакціями [173]. Створення анти-SARS-CoV-2 поліклональних або моноклональних антитіл зараз перебуває у процесі розробки. Однак, дані з нещодавніх досліджень з використання терапії антитілами (імунна плазма, гіперімунний глобулін, моноклональне антитіло до стовбуру гемаглютиніну) [173] у госпіталізованих з сезонним грипом пацієнтів не показало покращення у перебігу захворювання [174–176].
Рекомендація: 46. У критично хворих пацієнтів з COVID-19, ми не пропонуємо використовувати рутинно плазму тих, хто одужав. (слабка рекомендація, дуже низька якість доказових даних).
Обґрунтування:
Імунна плазма, отримана від пацієнтів які одужали від COVID-19 була запропонована як потенційна терапія, яка може створити пасивний імунітет за допомогою специфічних антитіл проти SARS-CoV2 [177]. Імунна плазма використовувалась для лікування багатьох інших вірусних інфекцій, включно з тими, що були викликані коронавірусом SARS, пташиним грипом А (H5N1) та грипом А (H1N1) pdm09 [178–182]. Нещодавній метааналіз обсерваційних досліджень з використання пасивної імунотерапії для лікування важких гострих респіраторних інфекцій надає дані, що терапія імунною плазмою була пов’язана зі зменшенням смертності (OR 0.25, 95% ДІ від 0.14 до 0.45) [183]. Протягом поточного спалаху у Китаї, імунну плазму використовували у деяких пацієнтів з COVID-19 [184]. Однак дані з приводу ефективності та безпеки імунної плазми є обмеженими, і цільові рівні титрів антитіл для нейтралізації SARS-CoV-2 залишаються невідомими. Дослідження MERS дійшло висновків, що використання імунної плазми має право на існування, але є проблемним для застосування оскільки кількість донорів з необхідно високими рівнями антитіл є малою [185]. РКД серед пацієнтів з підтвердженим вірусом Еболи показав, що плазма тих хто одужав з невідомим рівнем нейтралізуючих антитіл у використанні не була асоційована з підвищенням виживаності [186]. Інше РКД серед пацієнтів з сезонним грипом, де одна група отримувала протигрипозну плазму з високими титрами антитіл, а інша група з низькими, було зупинене через відсутність перспективи, пов’язану з браком ефективності за результатами первинної оцінки перебігу захворювання за 6-бальною порядковою шкалою оцінки клінічного статусу на 7 день [187]. Через брак переконливих доказових даних з боку РКД та невизначеність стосовно оптимального приготування плазми та її безпеки, ми пропонуємо не використовувати її рутинно для лікування пацієнтів з COVID-19 до появи більшої кількості доказових даних.
Рекомендація:
- У критично хворих дорослих з COVID-19:
47.1 Ми пропонуємо НЕ використовувати лопінавір/рітонавір рутинно (слабка рекомендація, низька якість доказових даних).
47.2 Відсутні достатні дані для створення рекомендації з використання інших противірусних агентів у критично хворих дорослих з COVID-19.
Обґрунтування:
Тривале виявлення РНК SARS-CoV-2 у дихальних шляхах та іноді в інших ділянках тіла важкохворих з COVID-19, наштовхує на раціональність призначення противірусних препаратів для зменшення реплікації вірусу з метою покращення перебігу захворювання [45]. На сьогоднішній день не було виявлено противірусних препаратів прямої дії, які б доведено знижували реплікацію або впливали на покращення стану у пацієнтів з COVID-19 або MERS.
Суттєва кількість агентів визнаних ефективними для інших показань була запропонована для використання, але коментарі нижче стосуються лише найбільш багатообіцяючих. Декілька інших проходять через тестування (напр. арбідол [уміфеновір], фавіпіравір, традиційні китайські лікувальні засоби, інгаляційні інтерферони), їх використання по одному або у комбінаціях в одній або декількох країнах.
Лопінавір — це антиретровірусний інгібітор протеази, що використовується у комбінації з ритонавиром з метою забезпечення адекватного впливу лопінавіру при лікуванні вірусу імунодефіциту людини (ВІЛ-інфекції) ) [188]. Через те, що було з’ясовано його активність in vitro проти SARS-CoV, лопінавір/ритонавір призначались у комбінації з рибавірином та курсом кортикостероїдів з поступовим зниженням дози, у групі з 41 пацієнта з SARS, та були асоційовані зі значним зниженням негативних клінічних наслідків (розвиток ГРДС або смерть) у порівнянні з лише рибавірином, що використовувався у 111 контрольних пацієнтів які отримували рибавірин та кортикостероїди [189]. У скринінгу з високою пропускною здатністю на антивірусні компоненти, лопінавір інгібував реплікацію MERS-CoV in vitro [190]. У тваринній моделі MERS-CoV лікування лопінавіром/ритонавіром або IFN-β1b було пов’язане з вірусологічним, гістологічним та клінічним покращенням у порівнянні з плацебо [191]. Лопінавір/ритонавір у поєданні з інтерфероном 1-b тестували у РКД для пацієнтів з MERS- CoV [192]. Ця комбінація була розглянута як другий претендент у списку пріоритизації досліджень ВООЗ з приводу терапевтичних агентів [193]. Цей препарат має загалом добрий профіль безпеки, але може вступати у взаємодію з іншими препаратами, що часто використовуються у критично хворих пацієнтів ().
Нещодавнє РКД порівнювали використання лопінавіру/ритонавіру зі звичайним лікуванням у 199 пацієнтів з COVID-19 у Китаї [194]. У цьому дослідженні лопінавір/ритонавір не зменшували значно 28-денну смертність (RD, -5.8%; 95% ДІ, від -17.3 до 5.7) або час до покращення стану (медіана 1.31 днів, 95% ДI від 0.95 до 1.80). До того ж використання лопінавіру/ритонавіру було пов’язане з більшою кількістю побічних ефектів [194]. Це дослідження є єдиним наявним прямим джерелом доказових даних з приводу використання лопінавіру/ритонавіру у пацієнтів з COVID-19, однак воно має деякі недоліки. Це дослідження не було сліпим та до нього було залучена невелика кількість пацієнтів (199) з малою кількістю подій (44 смерті загалом), що обмежує нашу впевненістю в результатах. Таким чином рутинне використання лопінавіру/ритонавіру у критично хворих пацієнтів не є виправданим, тому створення слабких рекомендацій проти рутинного використання лопінавіру/ритонавіру у критично хворих пацієнтів з COVID-19 має сенс. Лопінавір/ритонавір є одним зі способів лікування у запланованому ВООЗ ключовому протоколі лікування для госпіталізованих з COVID-19, та у REMAP-CAP (рандомізоване, інтегроване, мультифакторіальне, адаптивне, платформне дослідження для внутрішньолікарняної пневмонії) дослідженні (NCT02735707). Результати поточних досліджень допоможуть підвищити точність оцінки якості доказових даних.
Ремдесівір це проліки з аналогу, аденозину, який вбудовується до ланцюгів вірусної РНК, що знаходяться в процесі утворення та призводить до передчасного переривання їх утворення. Він вважається найбільш багатообіцяючим препаратом згідно з неформальним консультуванням ВООЗ з приводу пріоритизації досліджень потенційних терапевтичних агентів[195]. На сьогоднішній час існують опубліковані клінічні випадки, але немає опублікованих досліджень з приводу використання ремдесівіру при COVID-19. Ремдесівір продемонстрував ефективне інгібування SARS-CoV-2, MERS-CoV, та SARS-CoV під час досліджень in vitro [196]. Також дослідження на тваринних моделях MERS-CoV показало, що він був більш ефективним у порівнянні з контрольною групою та більш ефективним ніж лопінавір/ритонавір у поєднанні з системним IFN-β [197, 198]. Незважаючи на те, що внутрішньовенний ремдесівір здається адекватно толерованим живими організмами, нещодавнє РКД показало, що він був менш ефективним ніж терапія антитілами при вірусі Ебола [199]. Наразі відбуваються декілька РКД, метою яких є дослідити ефективність та безпеку внутрішньовенного ремдесівіру при важкому COVID-19 (clinicaltrials.gov NCT04257656) та при середній та легкій формах COVID-19 (clinicaltrials.gov NCT04252664). Ще одне дослідження, за підтримки Національного інституту алергії та інфекційних хвороб знаходиться на стадії набору пацієнтів у США (clinicaltrials.gov NCT04280705). Ми оновимо цю клінічну настанову як тільки з’являться нові доказові дані.
Рекомендація:
- Відсутні суттєві дані для створення рекомендації з використання рекомбінантних інтерферонів самостійно або в комбінації з противірусними препаратами у критично хворих дорослих пацієнтів з COVID-19.
Обґрунтування:
Рекомбінантний інтерферон часто поєднується з терапією рибавірином, використовувався у пацієнтів з MERS та SARS [179, 200–202]. Різноманітні варіанти рекомбінантного інтерферону (rIFN-α2a, rIFN-α2b, rIFN-β1a та rIFN-β1b) показали активність проти MERS-CoV in Vero та на популяції LLC-MK2 клітин та на моделі MERS-CoV-інфекції у макаки-резус [200, 201, 203]. Найбільша досліджена група важкохворих пацієнтів з MERS показала, що rIFN-α2a, rIFN-α2b, rIFN-β1a та рибавірин не були пов’язані зі зменшенням смертності (OR 1.03, 95% ДІ від 0.73 до 1.44) або зменшення виділення вірусу при регулюванні тривалості прийому на різні часові проміжки [204]. Відносна ефективність різноманітних інтерферонів проти SARS-CoV-2 на сьогодні є невідомою. Дані досліджень іп vitro показали, що rIFN-β виявив найбільший ступінь інгібування MERS-CoV між різних форм інтерферонів (rIFN-α2b, rIFN-γ, rIFN-універсального, та rIFN-α2a, rIFN-β), та в 41 нижчу 50% інгібуючу концентрацію (IC50) ніж у rIFN-α2b [203, 205]. РКД дослідження ефекту комбінації лопінавіра/ритонавіру та rIFN-β-1b на зниження смертності пацієнтів з MERS зараз знаходиться на стадії відбору пацієнтів [206]. Неопубліковані дані вказують на те, що IFN-β пригнічує SARS-C0V-2 у клітинній культурі, і інтерферони були пріоритизовані для досліджень при COVID-19 ВООЗ.
Рекомендація:
- Відсутні істотні дані для створення рекомендації з використанні хлорохіну або гідроксихлорохіну у важкохворих дорослих пацієнтів з COVID-19.
Обґрунтування:
Хлорохін та його метаболіт, гідроксихлорохін, є протималярійними препаратами, які продемонстрували противірусну дію на SARS-CoV та SARS-CoV-2 in vitro [207–209]. Попередні дослідження виявили інгібуючий ефект хлорохіну на віруси з множинною РНК in vitro, але РКД з лікування лихоманок Денге та чікунгунья та з профілактики вірусу грипу не змогли продемонструвати противірусних або клінічних переваг [210]. В одній моделі лихоманки чікунгунья на нижчих приматах, було отримано дані про імуномодуляторні ефекти хлорохіну, що викликало відтермінування імунної відповіді, вищими рівнями реплікації вірусу та погіршенням перебігу захворювання [211]. За результатами брифінгу стало відомо, що його використання у більше ніж 100 пацієнтів «краще за контроль пригнічувало розвиток пневмонії, призводило до покращення радіологічної картини та стимулювало сероконверсію антивірусних антитіл та зменшення часу перебігу захворювання», але дані з цього приводу ще не були опубліковані [212]. Нещодавній консенсус рекомендував призначення хлорохіну по 500 мг двічі на день протягом щонайменше 5 днів з модифікацією дозування при виникненні важких побічних ефектів з боку ШКТ [213]. Оскільки хлорохін не є доступним у деяких країнах, гідрохлорохін може бути його альтернативою. Нещодавнє дослідження в Китаї вивчало різні режими дозування хлорохіну та гідрохлорохіну з використанням фармакокінетичних моделей, що спирались на фізіологічні характеристики людського організму [209]. За результатами дослідження гідрохлорохін потенціює пригнічення SARS- CoV-2 in vitro у більшій мірі ніж хлорохін. Виходячи з цих моделей, рекомендованою дозою насичення гідрохлорохіном є 400 мг двічі на добу, потім по 200 мг двічі на добу протягом 4 днів [209]. Нещодавній систематичний огляд не виявив опублікованих досліджень у пацієнтів з COVID19 [214]. В очікуванні результатів поточних досліджень, ми не в змозі створити рекомендацію за чи проти використання хлорохіну.
Рекомендація:
50. Відсутні суттєві доказові дані для створення рекомендації з використання тоцилізумабу у важкохворих пацієнтів з COVID-19.
Обґрунування:
Тоцилізумаб це гуманізований імуноглобулін, що приймає участь в імунній відповіді та блокує зв’язування рецептору ІЛ-6 з ІЛ-6. Він був одобрений для синдрому вивільнення цитокінів та інших запальних станів, пов’язаних з запальними процесами у які залучений ІЛ-6, такими як ревматоїдний артрит та ювенільний ідіопатичний артрит [215-218]. Важкохворі пацієнти з COVID-19 можуть мати надмірну імунну відповідь, що призводить до важкої дихальної недостатності . У таких випадках, пригнічення ІЛ-6 може допомогти послабити синдром вивільнення цитокінів шляхом зменшення концентрації цитокінів та продукції гострофазових білків [219]. Поточні дослідження тоцилізумабу допоможуть розібратись з безпекою та ефективністю цієї терапії при COVID-19.
З літератури що стосується ревматоїдного артриту, систематичний огляд та метааналіз 6 РКД (3 з дозуванням 8 мг/кг та 3 з дозуванням 4 мг/кг) показали підвищення ризику побічних ефектів у порівнянні з контрольною групою (OR 1.53, 95% ДІ від 1.26 до 1.86), та підвищеним ризиком інфекцій (OR 1.30, 95% ДІ від 1.07 до 1.58) [220]. Інший систематичний огляд та метааналіз РКД з приводу використання тоцилізумабу при ревматоїдному артриті виявив підвищений ризик побічних ефектів у вигляді респіраторних інфекції (RR 1.53, 95% ДІ від 1.04 до 2.25) [221]. Оскільки нам невідомі дані з безпеки та ефективності тоцилізумабу при COVID-19, ми не в змозі створити рекомендацію.
Інші агенти:
Нафамостат — це синтетичний інгібітор серинової протеази та сильний інгібітор MERS CoV. Нітазоксанід — це антипротозойний препарат з противірусним потенціалом проти багатьох респіраторних вірусів включно з грипом, парагрипом, РС-вірусом та риновірусом. Як показало дослідження in vitro, і нафамостат і нітазоксанід пригнічували SARS CoV-2 [196]. РКД, в якому приймали участь пацієнти з гострим неускладненим грипом, продемонструвало, що вживання нітазоксаніду зменшувало тривалість симптомів [222]. Однак у пацієнтів, госпіталізованих з гострою важкою респіраторною інфекцією у Мехіко, нітазоксанід не був кращим за плацебо [223].
Фінансування: ця клінічна настанова не мала визначеного фінансування.
Подяка: Ми б хотіли подякувати Др. Zainab Al duhailib, Kimberly Lewis, Malik Farooqi, та Jessica Batoszko за їх підтримку у створенні систематичних оглядів та метааналізів для деяких питань клінічної настанови.
Конфлікт інтересів:
Dr. Yaseen Arabi — головний дослідник у клінічному дослідженні лопінавіру,ритонавіру та інтерверону при Середньосхідному респіраторному синдромі (MERS) і він був неоплачуваним консультантом з противірусної активності для MERS-коронавірусу для Gilead Sciences та SAB Biotherapeutics. Він є дослідником у REMAP-CAP та є членом правління Міжнародного консорціуму з важких гострих респіраторних та нових інфекцій (ISARIC).
Dr. Eddy Fan задекларував отримання доходів за консультування ALung Technologies та MC3 Cardiopulmonary.
Dr. Maurizio Cecconi задекларував консультативну роботу з Edwards Lifesciences, Directed Systems, та Cheetah Medical.
Dr. Lennie Derde — голова Цільової робочої групи з інфекційних захворювань (постійний комітет) при NVIC (Національній асоціації інтенсивної терапії Нідерландів) , член Цільової робочої групи з коронавірусу ESICM (розпочала роботу з розвитком спалаху) та голова Комітету клінічної підготовки ESICM, усі позиції є неоплачуваними.
Dr. Frederick Hyden — неоплачуваний консультант Gilead Sciences (антивірусні для РНК- вірусних інфекцій включно з ремдесівіром), Regeneraon (моноклональні антитіла для РНК- вірусних інфекцій включно з MERS), та SAB Biotherapeutics (поліклональні антитіла для РНК- вірусних інфекцій включно з MERS).
Інші автори не задекларували конфлікту інтересів.
Таблиця 1. Застосування різних видів рекомендацій для ключових дійових осіб
| Рекомендація | Значення | Застосування для пацієнтів | Застосування для клініцистів | Застосування
для посадовців |
| Сильна рекомендація або викладення найбільш апробованої практики | Необхідно дотримуватись або необхідно уникати | Майже всі особи у даній ситуації будуть схильні до вибору застосування рекомендованих для них втручань і лише мала кількість не бажатиме | Більшість осіб хотітиме отримати рекомендований алгоритм дій | Може бути адаптованим у вигляді інструкції (наказу, плану дій), включно з її використанням як індикатору діяльності |
| Слабка рекомендація | Розглядається виконання або не виконання | Більшість осіб у даній ситуації буде схильна до вибору застосування рекомендованих для них втручань, але деяка кількість не бажатиме | Різні варіанти вибору з великою ймовірністю будуть підходити різним пацієнтам, також рекомендація має бути підлаштованою під індивідуальні обставини пацієнта. Такі як рішення родини пацієнта або опікуна, цінності та уподобання лікаря | Інструкції з великою ймовірністю будуть варіабельними |
*РІСО — Популяція, втручання, контроль та результати.
Рис. 1. Методологічні процеси, що використовувались для формулювання рекомендацій
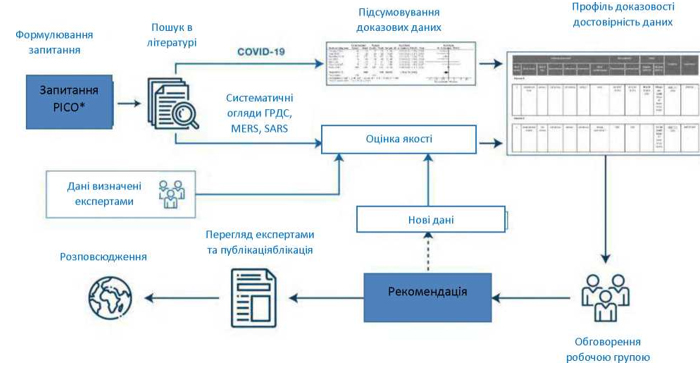
Рис. 2. Алгоритм ведення пацієнтів з важкою дихальною недостатністю, що розвинулась внаслідок коронавірусної хвороби.
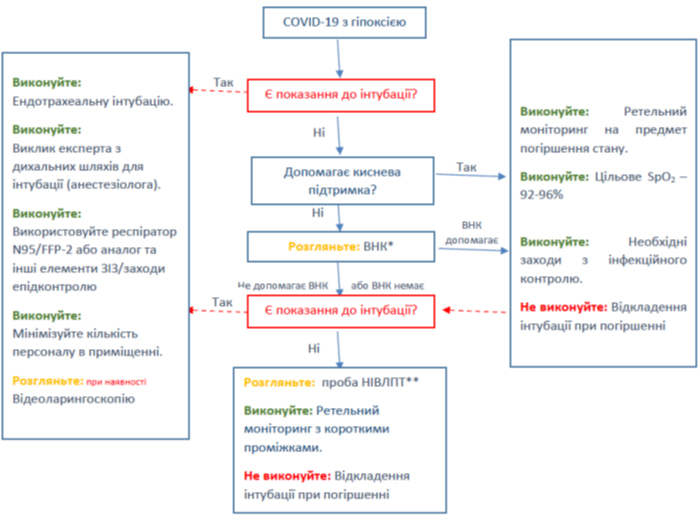
*ВНК — високопотокова носова канюля;
**НІВЛПТ — неінвазивна вентиляція легень під позитивним тиском.
Рис. 3. Загальне викладення рекомендацій з ведення пацієнтів з коронавірусною хворобою 2019
| COVID-19 з легким ГРДС | COVID-19 з ГРДС середньої важкості та важким ГРДС | Реанімаційна/додаткова терапія |
| Виконуйте: Дихальний об’єм 4-8 мл/кг при тиску плато менше 30 см ртутного стовпчика | Розгляньте: вищий РЕЕР | Неоднозначно:
противірусні, хлорохін, анти-ІЛ-6 |
| Виконуйте: Дослідження на наявність бактеріальної інфекції | Розгляньте: застосування м’язових релаксантів болюсно для досягнення цільових показників вентиляції | Розгляньте: при ШВЛ в положенні на животі, високому тиску плато, десинхронізації
Інфузія міорелаксантів протягом 24 г |
| Виконуйте: Цільова SPO2 92–96% | Розгляньте: якщо відповідає на РЕЕР Рекрутмент маневр | Розгляньте: вентиляція в положенні на животі протягом 12–16 годин |
| Розгляньте: Консервативну Стратегію підтримання водного балансу | Розгляньте: вентиляція в положенні на животі протягом 12–16 годин | Розгляньте: ЗУПИНІТЬСЯ при відсутності швидкої відповіді
Пробна інгаляція закису азоту |
| Розгляньте: Емпіричну антибіотикотерапію | Розгляньте: при ШВЛ в положенні на животі, високому тиску плато, асинхронії
Інфузія нервово-м’язових релаксантів протягом 24 г |
Розгляньте: дотримуйтесь локальних критеріїв для ЕКМО Вено-венозну ЕКМО або направлення до центру, де є ЕКМО. |
| Неоднозначно: Системні кортикостероїди | Не виконуйте: Мобілізаційні маневри поступовим (драбинчастим) методом | |
| Розгляньте: Короткий курс системних кортикостероїдів | ||
| Неоднозначно: противірусні, хлорохін, анти-ІЛ-6. |
Таблиця 2. Рекомендації та твердження
| Рекомендації | Сила | |
| Інфекційний контроль та тестування | ||
| 1. | Медичним працівникам, які проводять пацієнтам з COVID-19 у ВІТ процедури, пов’язані з утворенням аерозолів*, ми рекомендуємо використовувати респіраторні маски (респіратор N95, FFP2 або інші, еквівалентні за ступенем захисту), на відміну від хірургічних/медичних масок, на додачу до інших індивідуальних захисних засобів (тобто, рукавички, халат і захист для очей, такий як щиток на обличчя або захисні окуляри). | Ствердження на основі найкращої практики |
| 2. | Ми рекомендуємо проводити процедури, пов’язані з утворенням аерозолів, пацієнтам з COVID-19 у ВІТ в палаті з негативним тиском. | Ствердження на основі
найкращої практики |
| 3. | Медичним працівникам, які здійснюють догляд за пацієнтами з COVID-19, які не знаходяться на вентиляційній підтримці, ми пропонуємо використовувати хірургічні/медичні маски, на відміну від респіраторних масок, на додаток до інших засобів індивідуального захисту (наприклад, рукавичок, халату та засобів захисту очей, таких як щиток для обличчя або захисні окуляри). | Слабка |
| 4. | Медичним працівникам, які проводять процедури без утворення аерозолів пацієнтам із COVID-19 на механічній вентиляції легень (з закритим контуром), ми пропонуємо використовувати хірургічні/медичні маски, на відміну від респіраторних масок, на додаток до інших засобів індивідуального захисту (наприклад, рукавичок, халату та захисту очей, таких як щиток для обличчя або захисні окуляри). | Слабка |
| 5. | Медичним працівникам, які проводять ендотрахеальну інтубацію пацієнтам з COVID-19, ми пропонуємо за наявності використання відеоларингоскопії замість прямої ларингоскопії. | Слабка |
| 6. | Ми рекомендуємо проведення ендотрахеальної інтубації медичним працівником, який має найбільший досвід з відновлення прохідності дихальних шляхів, щоб мінімізувати кількість спроб та ризик передачі. | Ствердження на основі найкращої практики |
| 7.1 | Для інтубованих та тих, що перебувають на ШВЛ, дорослих з підозрою на COVID-19: для діагностичного тестування ми пропонуємо надавати перевагу отриманню зразків з нижніх дихальних шляхів перед отриманням зразків з верхніх дихальних шляхів (назофарингеальні або орофарингеальні зразки). | Слабка |
| 7.2 | Для інтубованих та тих, що перебувають на ШВЛ, дорослих з підозрою на COVID-19: при проведенні забору матеріалу з нижніх дихальних шляхів ми пропонуємо надавати перевагу забору ендотрахеального аспірату перед матеріалом з бронхіальних змивів або бронхоальвеолярного лаважу. | Слабка |
| Гемодинаміка | ||
| 8. | Дорослим з COVID-19, що перебувають у стані шоку, ми пропонуємо контролювати такі динамічні параметри, як температура шкіри, час наповнення капілярів та/або вимірювання рівня лактату сироватки, замість статичних параметрів для оцінки відповіді на інфузійну терапію. | Слабка |
| 9. | Для реанімації дорослих хворих з COVID-19 та шоком ми пропонуємо використовувати консервативну стратегію інфузійної терапії замість вільної стратегії. | Слабка |
| 10. | Для реанімації дорослих хворих на COVID-19 з шоком ми рекомендуємо використовувати кристалоїдні розчини над колоїдними. | Слабка |
| 11. | Для гострої реанімації дорослих з COVID-19 та шоком ми пропонуємо використовувати буферні/збалансовані кристалоїдні розчини над незбалансованими кристалоїдними розчинами. | Слабка |
| 12. | Для реанімації дорослих хворих на COVID-19 з шоком ми рекомендуємо не застосовувати гідроксиетилкрохмаль. | Сильна |
| 13. | Для реанімації дорослих хворих на COVID-19 з шоком ми пропонуємо не застосовувати желатини. | Слабка |
| 14. | Для реанімації дорослих хворих на COVID-19 з шоком ми пропонуємо не застосовувати декстрани. | Слабка |
| 15. | Для реанімації дорослих хворих на COVID-19 з шоком ми пропонуємо не застосовувати рутинно розчини альбумінів для початкових реанімаційних заходів. | Слабка |
| 16. | Для дорослих з COVID-19 та шоком ми пропонуємо надавати перевагу норадреналіну як вазоактивному засобу першої лінії над іншими засобами. | Слабка |
| 17. | Якщо норадреналін недоступний, ми пропонуємо використовувати або вазопресин, або епінефрин для дорослих із COVID-19 та шоком як вазоактивний засіб першої лінії, порівняно з іншими вазоактивними засобами. | Слабка |
| 18. | Для дорослих із COVID-19 та шоком ми рекомендуємо не застосовувати дофамін за доступності норадреналіну. | Сильна |
| 19. | Дорослим із COVID-19 та шоком ми пропонуємо додавати вазопресин як препарат 2 лінії замість титрування дози норепінефрину, якщо цільового середнього артеріального тиску не вдається досягнути завдяки лише епінефрину. | Слабка |
| 20. | Для дорослих із COVID-19 та шоком ми пропонуємо титрувати вазоактивні агенти для досягнення середнього АТ в межах 60–65 мм рт. ст., а не вище. | Слабка |
| 21. | Для дорослих із COVID-19 та шоком з ознаками серцевої недостатності та персистуючою гіпоперфузією, незважаючи на інфузійну терапію та норепінефрин, ми пропонуємо надати перевагу додаванню добутаміну над підвищенням дози норепінефрину. | Слабка |
| 22. | Для дорослих із COVID-19 та рефрактерним шоком ми пропонуємо надати перевагу використання низькодозової терапії кортикостероїдами (протишокової) над невикористанням кортикостероїдів. | Слабка |
| Вентиляційна підтримка | ||
| 23. | Для дорослих з COVID-19 ми пропонуємо починати кисневу підтримку, якщо периферична сатурація киснем (SPO2) менше 92% і рекомендуємо починати кисневу підтримку якщо SPO2 <90%. | Слабка
Сильна |
| 24. | У дорослих з COVID-19 та гострою гіпоксемічною дихальною недостатністю, що перебувають на кисневій підтримці, ми пропонуємо підтримувати SPO2 на рівні не вище 96%. | Слабка |
| 25. | Для дорослих із COVID-19 та гострою гіпоксемічною дихальною недостатністю, незважаючи на традиційну терапію киснем, ми пропонуємо використовувати високопотокову оксигенотерапію через назальну канюлю (HFNC) у порівнянні зі звичайною терапією киснем. | Слабка |
| 26. | У дорослих із COVID-19 та гострою гіпоксемічною дихальною недостатністю ми пропонуємо використовувати HFNC замість неінвазивної вентиляції легень з позитивним тиском (NIPPV ). | Слабка |
| 27. | У дорослих із COVID-19 та гострою гіпоксемічною дихальною недостатністю, якщо HFNC недоступний та немає термінових показань до ендотрахеальної інтубації, ми пропонуємо пробу на NIPPV з ретельним моніторингом та частою оцінкою для виявлення посилення дихальної недостатності. | Слабка |
| 28. | Ми не змогли дати рекомендацію щодо використання шолому для NIPPV на противагу використання маски для NIPPV. Це можливий варіант, але ми не впевнені в його безпечності та ефективності при COVID-19. | Відсутність рекомендації |
| 29. | Дорослим із COVID-19, які знаходяться на NIPPV або HFNC, ми рекомендуємо ретельно контролювати стан для вчасного виявлення погіршення респіраторного статусу та ранню інтубацію в контрольованих умовах у разі погіршення. | Ствердження на основі найкращої практики |
| 30. | У дорослих з механічною вентиляцією з COVID-19 та ГРДС ми рекомендуємо надавати перевагу використанню вентиляції з низьким дихальним об’ємом (Vt 4–8 мл/кг передбачуваної маси тіла) над використанням більших дихальних об’ємів (Vt >8 мл/кг). | Сильна |
| 31. | Для дорослих із COVID-19 та ГРДС на механічній вентиляції легень ми рекомендуємо, щоб цільовий тиск плато (Pplat) становив <30 см H2O. | Сильна |
| 32. | Для дорослих із COVID-19 та середньотяжким та важким ГРДС, що перебувають на механічній вентиляції легень, ми пропонуємо використовувати стратегію вищого PEEP, порівняно із стратегією нижчого PEEP.
Зауваження: Якщо використовується стратегія вищого PEEP (тобто PEEP >10 см H2O), клініцисти повинні контролювати пацієнтів на предмет розвитку баротравми. |
Сильна |
| 33. | Для дорослих пацієнтів з COVID-19 та ГРДС, що перебувають на механічній вентиляції легень, ми пропонуємо використовувати консервативну інфузійну стратегію замість ліберальної стратегії інфузійної терапії. | Слабка |
| 34. | Для дорослих пацієнтів з COVID-19 та середньотяжким та важким ГРДС, що перебувають на механічній вентиляції легень, ми пропонуємо вентиляцію у положенні на животі від 12 до 16 годин, замість вентиляції у звичайному положенні. | Слабка |
| 35.1 | Для дорослих пацієнтів з COVID-19 та середньотяжким та важким ГРДС, що перебувають на механічній вентиляції легень, ми пропонуємо за необхідності надавати перевагу інтервальному болюсному введенню міореласантів над тривалою їх інфузією для покращення вентиляції легень. | Слабка |
| 35.2 | У разі стійкої дисинхронізації апарату ШВЛ, необхідності постійної глибокої седації, вентиляції в положенні на животі або постійного високого тиску плато ми пропонуємо використовувати безперервну інфузію нервово-м’язових релаксантів тривалістю до 48 годин. | Слабка |
| 36. | У дорослих із COVID-19 та ГРДС, що перебувають на механічній вентиляції легень, ми не рекомендуємо рутинно застосовувати інгаляційний оксид азоту. | Слабка |
| 37. | У дорослих із COVID-19 та важким ГРДС і гіпоксемією, що перебувають на механічній вентиляції легень, незважаючи на оптимізацію вентиляції та інші стратегії порятунку, ми пропонуємо пробу інгаляційного легеневого вазодилататора як рятувальну терапію; якщо не спостерігається швидкого поліпшення оксигенації, слід звузити лікування. | Слабка |
| 38. | Для дорослих з COVID-19, що перебувають на ШВЛ і мають гіпоксемію, незважаючи на оптимізацію вентиляції, ми рекомендуємо надавати перевагу проведенню мобілізаційних маневрів над не проведенням мобілізаційних маневрів. | Слабка |
| 39. | Якщо мобілізаційні маневри проводяться, ми не рекомендуємо застосування покрокового методу (поступове наростання РЕЕР) для рекрутмент маневру | Сильна |
| 40. | У дорослих з COVID-19, що знаходяться на ШВЛ та мають рефрактерну гіпоксемію, незважаючи на оптимізацію вентиляції, ми пропонуємо використання вено-венозної ЕКМО, якщо є така можливість, або направлення пацієнта до центру, де наявна ЕКМО. | Слабка |
| Зауваження: Через ресурсомістку природу ЕКМО та потребу у медичних центрах та працівниках з досвідом проведення цієї процедури, ЕКМО має розглядатись лише у ретельно відібраних пацієнтів з COVID-19 та важким ГРДС. | ||
| 41. | У дорослих пацієнтів з COVID-19 та дихальною недостатністю, що знаходяться на ШВЛ (без ГРДС), ми не рекомендуємо рутинно використувати системні кортикостероїди | Слабка |
| Медикаментозна терапія | ||
| 42. | У пацієнтів з COVID-19 та ГРДС ми пропонуємо надавати перевагу використанню системних кортикостероїдів над невикористанням системних кортикостероїдів | Слабка |
| 43. | У пацієнтів з COVID19, які знаходяться на ШВЛ, та мають дихальну недостатність, ми рекомендуємо надавати перевагу використанню антибактеріальних/протимікробних агентів над їх невикористанням. | Слабка |
| Зауваження:
Якщо команда, яка лікує пацієнта, починає емпіричну антибіотикотерапію, вони мають проводити щоденну оцінку на предмет деескалації та повторно оцінювати тривалість терапії та спектр покриття антибіотика за результатами лабораторних досліджень та стану пацієнта. |
||
| 44. | Для критично хворих пацієнтів з COVID-19, які мають лихоманку, ми пропонуємо надавати перевагу використанню ацетамінофену/парацетамолу для контролю температури над їх невикористанням. | Слабка |
| 45. | У критично хворих пацієнтів з COVID-19 ми пропонуємо НЕ використовувати рутинно стандартні внутрішньовенні імуноглобуліни (ВВІГ). | Слабка |
| 46. | У критично хворих пацієнтів з COVID-19 ми не пропонуємо використовувати рутинно плазму тих, хто одужав. | Слабка |
| 47.1 | У критично хворих дорослих з COVID-19 ми пропонуємо НЕ використовувати лопінавір/ритонавір рутинно. | Слабка |
| 47.2 | Відсутні достатні дані для створення рекомендації з використання інших противірусних агентів у критично хворих дорослих з COVID-19. | Відсутність рекомендації |
| 48. | Відсутні суттєві дані для створення рекомендації з використання рекомбінантних інтерферонів самостійно або в комбінації з противірусними препаратами у критично хворих дорослих пацієнтів з COVID-19. | Відсутність рекомендації |
| 49. | Відсутні істотні дані для створення рекомендації з використання хлорохіну або гідроксихлорохіну у важкохворих дорослих пацієнтів з COVID-19. | Відсутність рекомендації |
| 50. | Відсутні суттєві доказові дані для створення рекомендації з використання тоцилізумабу у важкохворих пацієнтів з COVID19. | Відсутність рекомендації |
Таблиця 3. Епідеміологічна характеристика нещодавніх звітів по COVID-19
| Дослідження | Кількість | Гостпіталізація у ВРІТ | Ураження серця | ШОК | Неінвазивна вентиляція легень під ПТ | Інвазивна ШВЛ | Кількість летальних випадків |
| Huang et al. [44] | 41 | 32% | 12% | 7% | 24% | 5% | 15% |
| Chen et al. [65] | 99 | 23% | 4% | 13% | 4% | 11% | |
| Wang et
al. [43] |
138 | 26% | 7% | 9% | 11% | 12% | |
| Guan et al. [1] | 1099 | – | – | 1% | 5,1% | 2,3% | 1% |
| Yang et al. [42] | 52 | 100% | 23% | 35% | 55,8% | 42,3% | 62% |
| Zhou et al. [45] | 191 | 26% | 17% | 20% | 14% | 17% | 28% |
Джерела: див. оригінальний документ ст. 43
Додатки
Зміст
- Методологія
- Питання інфекційного контролю
- Зведені доказові дані по інфекційному контролю
- Питання лабораторної діагностики та забору зразків
- Питання гемодинамічної підтримки
- Зведені доказові дані з гемодинамічної підтримки
- Питання з вентиляції
- Зведені доказові дані з вентиляції
- Питання з груп терапії
- Зведені доказові дані з медикаментозної терапії
Методологія
Рис. S1. Алгоритм з використання непрямих даних
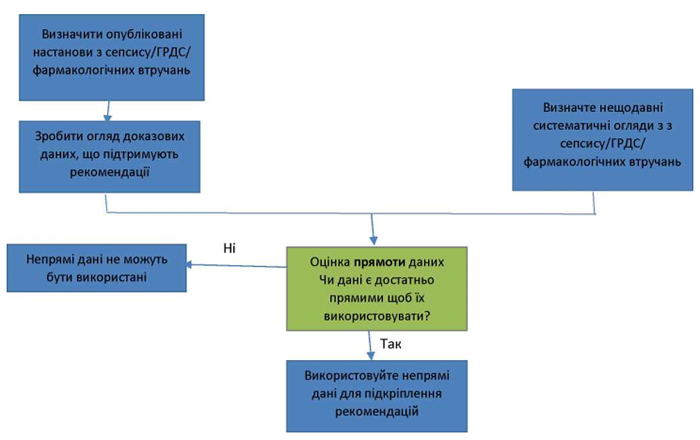
Рис. S2. Алгоритм взаємодії між непрямотою та якістю доказових даних
Рис. S3. Оцінка непрямоти популяції
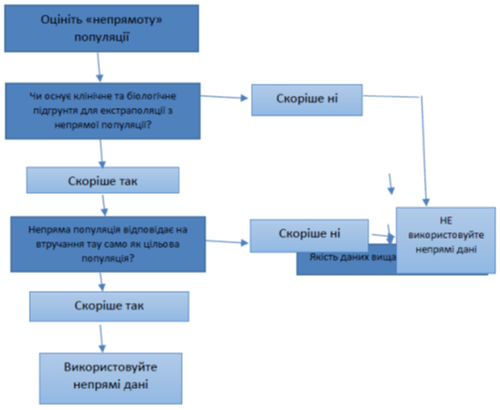
Запитання з інфекційного контролю
Таблиця S1. Запитання РІСО: Рекомендація 1
| Запитання: Чи повинні ми рекомендувати використання респіратора замість хірургічних/медичних масок серед співробітників медичного закладу, які проводять аерозоль-утворюючі процедури у пацієнтів з COVID-19 у ВРІТ? | |||
| Популяція | Втручання | Контроль | Результати |
| Співробітники медичного закладу, які проводять аерозольутворюючі процедури | Респіраторна маска, що щільно прилягає до обличчя (N95/FFP2 або еквівалент) | Хірургічні/медичні маски | 1. Передача захворювання |
Таблиця S2. Запитання РІСО: Рекомендація 2
| Запитання: Чи повинні ми рекомендувати співробітникам медичного закладу, які проводять аерозоль-утворюючі процедури у пацієнтів з COVID-19 у ВРІТ, використання палати з негативним тиском замість проведення процедур у звичайній палаті? | |||
| Популяція | Втручання | Контроль | Результати |
| Співробітники медичного закладу, які проводять аерозоль-утворюючі процедури | Кімната з негативним тиском | Звичайна кімната | 1. Передача захворювання |
Таблиця S3. Запитання РІСО: Рекомендація 3
| Запитання: Чи повинні ми рекомендувати співробітникам медичного закладу, які доглядають за пацієнтами з COVID-19, що НЕ знаходяться на механічній вентиляції легень, рекомендувати використання респіратора замість хірургічних/медичних масок? | |||
| Популяція | Втручання | Контроль | Результати |
| Співробітники медичного закладу, які доглядають за пацієнтами з СОVID-19, що НЕ знаходяться на механічній вентиляції легень (не на НІВЛПТ, інвазивній ШВЛ або оксигенації через високопотокову носову канюлю) | Респіраторна маска що щільно прилягає до обличчя (N95/FFP2 або еквівалент) | Хірургічні/медичні маски | 1. Передача захворювання |
Таблиця S4. Запитання РІСО: Рекомендація 4
| Запитання: Чи повинні ми рекомендувати використання респіратора замість хірургічних/медичних масок серед співробітників медичного закладу, які проводять НЕ аерозоль-утворюючі процедури у пацієнтів з СОVID-19 у ВРІТ? | |||
| Популяція | Втручання | Контроль | Результати |
| Співробітники медичного закладу, які проводять НЕ аерозоль-утворюючі процедури | Респіраторна маска, що щільно прилягає до обличчя | Хірургічні/медичні
маски |
1. Передача захворювання |
Таблиця S5. Запитання РІСО: Рекомендації 5–6
| Запитання: Чи повинні ми рекомендувати серед співробітників медичного закладу, які проводять ендотрахельну інтубацію у пацієнтів з СОVID-19 у ВРІТ, використання ларингоскопії під відео-контролем замість прямої ларингоскопії? | |||
| Популяція | Втручання | Контроль | Результати |
| Співробітники медичного закладу, які проводять ендотрахельну інтубацію | Відео ларингоскопія | Пряма ларингоскопія | 1. Передача захворювання |
Підсумки досліджень інфекційного контролю:
Рис. 4. Рекомендація 3: N-95 vs хірургічна маска: Лабораторно підтверджений Грип
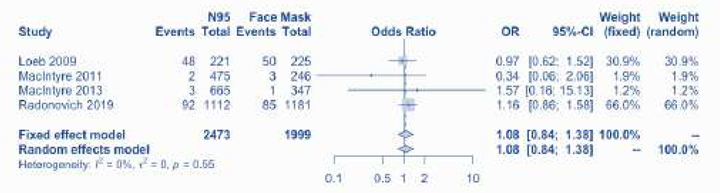
Рис. 5. Рекомендація 3: N-95 vs хірургічна маска: Лабораторно підтверджене ГРЗ
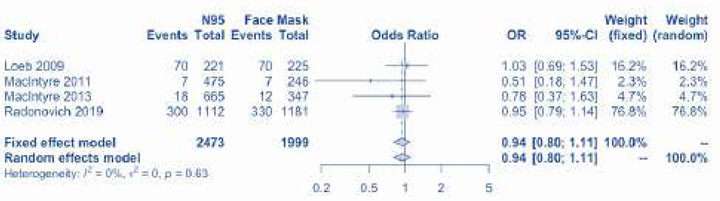
Рис. 6. Рекомендація 3: N-95 vs хірургічна маска: грипоподібні захворювання
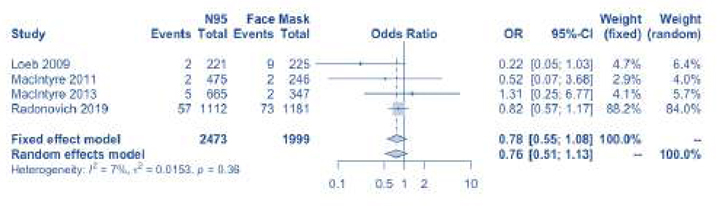
Табл. 6. Рекомендація 3: Докази
| Результати | Кількість учасників (досліджень) | Relative effect (95% СІ) | Сила доказів (GRADE) |
| Лабораторно підтверджений грип | (4 RCTta) | ORUOB (0.34 to 1.33) | Низька |
| Лабораторно підтверджені ГТЗ | (4 RCTa) | OR 0.94 (0.30 to 1.11) | Низька |
| Грипоподібні захв. | (4 RCTa) | OR 0.76 (0.51 to 1,13) | Низька |
| Клінічні респіраторні інфекції | (3 RCTs) | OR 0.67 (0.44 to 1.02) | Дуже низька |
Висновки лабораторних діагнозів та досліджень
Таблиця S7. Питання РІСО: Рекомендація 7.1
| У пацієнтів на ШВЛ з підозрою на COVID-19. чи маємо ми надсилати зразки з верхніх дихальних шляхів замість зразків з нижніх дихальних шляхів? | |||
| Популяція | Втручання | Порівняння | Висновки |
| Пацієнти на ШВЛ з підозрою на COVID-19 | Зразок матеріалу з верхніх дихальних шляхів | Зразок матеріалу з нижніх дихальних шляхів | 1. Діагностична точність
2. Шкода пацієнту 3. Ризик інфікування медичних працівників |
Таблиця S8. Питання РІСО: Рекомендація 7.2
| У пацієнтів на ШВЛ з підозрою на COVID-19 , чи повинні ми рекомендувати дослідження ендотрахеального аспірату замість зразків бронхоскопії? | |||
| Популяція | Втручання | Порівняння | Висновки |
| Пацієнти на ШВЛ з підозрою на COVID-19 | Ендотрахеаль ний аспірат | Зразок.
отриманий при бронхоскопії |
1. Діагностична точність
2. Шкода пацієнту 3. Ризик інфікування .медичних працівників |
Питання гемодинамічної підтримки
Таблиця S9. Питання РІСО: Рекомендація 8
| У дорослих з COVID-19 та шоком, чи повинні ми оцінювати відповідь на інфузійну терапію за динамічними чи статичними показниками? | |||
| Популяція | Втручання | Порівняння | Висновки |
| Дорослі з COVID-19 та шоком | Динамічні показники | Статичні показники | 1. Смертність
2. Тривалість перебування у ВРІТ 3. Тривалість ШВЛ |
Таблиця S10. Питання РІСО: Рекомендація 9
| У дорослих з COVID-19 та шоком, чи: повинні ми використовувати консервативну’ або ліберальну інфузійну стратегію? | |||
| Популяція | Втручання | Порівняння | Висновки |
| Консервативна стратегія | Ліберальна стратегія | 1. Смертність
2. Серйозні важкі ефекти 3. Дні без ШВЛ; Тривалість перебування у ВРІТ |
|
Таблиця S11. Питання РІСО: Рекомендація 10
| У дорослих з СOVID-19 та шоком, чи повинні ми використовувати внутрішньовенні кристалоїди чи колоїди для інфузійної терапії? | |||
| Популяція | Втручання | Порівняння | Висновки |
| Дорослі з COVID-19 та шоком | Внутрішньовенні кристалоїди | Внутрішньовенні колоїди | 1. Смертність
2. Серйозні важкі випадки |
Таблиця S12. Питання PICO: Рекомендація 11
| У дорослих з СOVID-19 та шоком, чи повинні ми використовувати буферні збалансовані кристалоїди або незбалансовані кристалоїди для інфузійної терапії? | |||
| Популяція | Втручання | Порівняння | Висновки |
| Дорослі з COVID-19 та шоком | Збалансовані буферні кристалоїди | Незбалансовані кристалоїди | 1. Смертність
2. Серйозні важкі випадки |
Таблиця S13. Питання PICO: Рекомендація 12
| У дорослих з COVID-19 та шоком, чи повинні ми використовувати гідроксиетилкрохмаль для інфузійної терапії? | |||
| Популяція | Втручання | Порівняння | Висновки |
| Дорослі з COVID-19 та шоком | Гідроксиетилкрохмаль | Кристалоїди | 1. Смертність
2. Замісна ниркова терапія 3. Трансфузія крові |
Таблиця S14. Питання РІСО: Рекомендації 13
| У дорослих з СOVID-19 та шоком, чи повинні ми використовувати желатини для інфузійної терапії? | |||
| Популяція | Втручання | Порівняння | Наслідки |
| Дорослі з COVID-19 | Желатини | Кристалоїди | 1. Смертність |
Таблиця S15. Питання РІСО: Рекомендації 14
| У дорослих з СOVID-19 та шоком: чи повинні ми використовувати декстрани для інфузійної терапії? | |||
| Популяція | Втручання | Порівняння | Висновки |
| Дорослі з COVID-19 та шоком | Декстрани | Кристалоїди | 1. Смертність
2. Трансфузія крові |
Таблиця S16. Питання PICO: Рекомендація 15
| У дорослих з СOVID-19 та шоком: чи повинні ми використовувати декстрани для інфузійної терапії? | |||
| Популяція | Втручання | Порівняння | Наслідки |
| Дорослі з СOVID-19 та шоком | Декстрани | Кристалоїди | 1. Смертність
2. Трансфузія крові |
Таблиця S17. Питання РІСО: Рекомендації 16
| У дорослих з COVID-19 та шоком: чи повинні ми використовувати норепінефрин чи інші вазоактивні агенти як першу лінію лікування? | |||
| Популяція | Втручання | Порівняння | Висновки |
| Дорослі з COVID-19 та шоком | Норепінефрин | Інші вазоактивні агенти | 1. Смертність
2. Серйозні важкі наслідки |
Таблиця S18. Питання PICO: Рекомендація 17
| У дорослих з C0VID-19 та. шоком= чи повинні ми використовувати вазопресин або епінефрин якщо норепінефрин недоступний? | |||
| Популяція | Втручання | Порівняння | Висновки |
| Дорослі з COVID-19 та шоком | Вазопресин | Епінефрин | 1. Смертність
2. Серйозні важкі наслідки |
Таблиця S19. Питання PICO: Рекомендація 18
| У дорослих з СOVID-19 та шоком: чи маємо ми використовувати допамін чи норепінефрин? | |||
| Популяція | Втручання | Порівняння | Висновки |
| Дорослі з COVID-19 та шоком | Допамін | Норепінефрин | 1. Смертність
2. Аритмії |
Таблиця S20. Питання PICO: Рекомендація 19
| У дорослих з СOVID-19 та шоком, чи повинні ми додавати вазопресин як терапію другої лінії або ми повинні титрувати норепінефрин, якщо цільові рівні CAT не можуть бути досягнуті норепінефрином? | |||
| Популяція | Втручання | Порівняння | Наслідки |
| Дорослі з COVID-19 та шоком | Вазопресин | Норепінефрин | 1. Смертність
2. Фібриляція передсердь 3. Ішемія кінцівок |
Таблиця S21. Питання PICO: Рекомендація 20
| У дорослих з СOVID-19 та шоком, чи повинні ми титрували вазоактивні агенти до CAT 60–65 mmHg або використовувати вищі цільові показники CAT? | |||
| Популяція | Втручання | Порівняння | Наслідки |
| Дорослі з COVID-19 та шоком | CAT 60–65 mmHg | CAT вище 65 mmHg | 1. Смертність
2. Аритмії 3. Ураження міокарду 4. Ішемія кінцівок |
Таблиця S22. Питання PICO: Рекомендація 21
| У дорослих з COVID-19 та шоком з доказами серцевої дисфункції та персистуючою гіпоперфузією, незважаючи на ін фузійну терапію та норепінефрин, чи повинні ми додати добутамін або підвищити дозу норепінефрину? | |||
| Популяція | Втручання | Порівняння | Висновки |
| COVID-19 та шок з доказати серцевої дисфункції та переметуючої гіпоперфузії | Добутамін | Без добутаміну | 1. Смертність
2. Серйозні важкі випадки |
Таблиця S23. Питання PICO: Рекомендація 22
| У дорослих з C0VID-19 та рефракторним шоком: чи: повинні ми використовувати низькодозові кортикостероїди? | |||
| Популяція | Втручання | Порівняння | Висновки |
| СOVID-19 та рефракторний шок | Низькодозові кортикостероїди | Без низькодозових кортикостероїдів | 1. Смертність
2. Серйозні важкі випадки |
Висновки досліджень щодо гемодинамічної підтримки:
Таблиця S23. Рекомендація 9: Профайл доказів: консервативна vs ліберальна стратегія
| Наслідки | № учасників (досліджень) | Relative effect
(95% CI) |
Сила доказів |
| Загальна смертність | 637
(9 RCTs) |
RR 0.87 (0.69–1.10) | Дуже низька |
| Серйозні важкі випадки | 637
(9 RCTs) |
RR 0.91
(0.78–1.05) |
Дуже низька |
Meyhoff TS, Møller MН, Hjortrup PB, Cronhjort M, Pemer A, Wetterslev J. Lower versus higher fluid volumes doing initial management of sepsis — a systematic resievvithmeta-analysis and trial sequental analysis. Chest. 2020 Jan. 23. pii SOO12-3692f20; 3O123-9. doi: 10.1016/j.chest2019.11.050. [Epub. ahead of print] PubMed PMID: 31982391.
Таблиця S24. Профайл доказів: Рекомендація 11: буферні/збалансовані кристалоїди vs незбалансовані кристалоїди
| Наслідки | № учасників (досліджень) | Relative effect (95% CI) | Сила доказів |
| Внутрішньолікарняна
смертність |
19,664
(14 RCTs) |
OR 0.91
(0.83–1.01) |
Висока |
| Гостре ураження нирок | 18,701
(9 RCTs) |
RR0.91
(0.78–1.05) |
Низька |
Antequera Martin AM, Вarea Mendoza JA, Muriel A, Saéz I, Chiko-Femández M, Estrado-Lorenzo JM, Plana MN. Buffered solutions versus 0.9% saline for resuscitadon in critically ill adults and children. Cochrane Database Syat Rev. 2019 Jul 19;7: CD012247. doi. 10.1002/1465 l858.CD01224.pub2. PubMed PMID: 31334842: PubMed Central PMCID: PMC 6647932.
Таблиця S25. Профіль доказових даних: Рекомендація 12: кристалоїди vs гідроксиетилкрохмаль
| Результати | Кількість учасників (Досліджень) | Відносний ефект (ДІ 95%) | Достовірність доказів |
| Загальна летальність
(вкінці спостереження) |
11,177 (24 РКД*) | RR 0.97 (0.8–1.09) | помірна |
| Загальна летальність (протягом 90 днів) | 10,415 (15 РКД) | RR 1.01 (0.9–1.14) | помірна |
| Загальна летальність (протягом 30 днів) | 10,135 (11 РКД) | RR 0.99 (0.9–1.09) | помірна |
| Замісна ниркова терапія | 8,527 (9 РКД) | RR 1.30 (1.14–1.48) | помірна |
| Переливання крові | 1,917 (8 РКД) | RR 1.19 (1.02–1.39) | помірна |
Колоїди vs кристалоїди для реанімації рідини у важкохворих людей. Cochrane Database Syst
Rev. 2018 3 серп; PubMed Central
*РКД — рандомізоване контрольоване дослідження.
Таблиця S26. Профіль доказових даних: Рекомендація 13: кристалоїди vs желатини
| Результати | Кількість учасників (Досліджень) | Відносний ефект (ДІ 95%) | Достовірність доказів |
| Загальна летальність (в кінці спостереження) | 1,698 (6 РКД) | RR 0.89 (0.74–1.08) | низька |
| Загальна летальність (протягом 90 днів) | 1,388 (1 РКД) | RR 0.89 (0.73–1.09) | низька |
| Загальна летальність (протягом 30 днів) | 1,388 (1 РКД) | RR 0.92 (0.74–1.16) | низька |
Колоїди vs кристалоїдів для реанімації рідини у важкохворих людей. Cochrane Database Syst Rev. 2018 3 серп; PubMed Central
Таблиця S27. Профіль доказових даних: Рекомендація 14: кристалоїди vs декстрани
| Результати | Кількість учасників (досліджень) | Відносний ефект (ДІ 95%) | Достовірність доказів |
| Загальна летальність (в кінці спостереження) | 4,736 (19 РКД) | RR 0.99 (0.88–1.11) | помірна |
| Загальна летальність (протягом 90 днів) | 3,353 (10 РКД) | RR 0.99 (0.87–1.12) | помірна |
| Переливання крові | 1,272 (3 РКД) | RR 0.92 (0.7–1.10) | дуже низька |
Колоїди vs кристалоїдів для реанімації рідини у важкохворих людей. Cochrane Database Syst Rev. 2018 3 серп; PubMed Central
Таблиця S28. Профіль доказових даних: Рекомендація 15: кристалоїди vs альбумін
| Результати | Кількість учасників (досліджень) | Відносний ефект (ДІ 95%) | Достовірність доказів |
| Загальна летальність (в кінці спостереження) | 13,047 (20 РКД) | RR 0.98 (0.92–1.06) | помірна |
| Загальна летальність
(протягом 90 днів) |
12,492 (10 РКД) | RR 0.98 (0.92–1.04) | помірна |
| Загальна летальність
(протягом 30 днів) |
12,506 (10 РКД) | RR 0.99 (0.93–1.06) | помірна |
| Замісна ниркова терапія | 290 (2 РКД) | RR 1.11 (0.96–1.27) | дуже низька |
| Переливання крові | 1,917 (3 РКД) | RR 1.31 (0.95–1.80) | дуже низька |
Колоїди vs кристалоїдів для реанімації рідини у важкохворих людей. Cochrane Database Syst Rev. 2018 3 серп; PubMed Central
Таблиця S29. Профіль доказових даних: Рекомендація 18: норепінефрин vs допамін
| Результати | Кількість учасників (досліджень) | Відносний ефект (ДІ 95%) | Достовірність доказів |
| Загальна летальність (в кінці спостереження) | 1,400 (6 РКД) | RR 1.07 (0.99–1.16) | висока |
| Аритмії | 1,931 (2 РКД) | RR 2.34 (1.46–3.78) | висока |
| Вазопресори при гіпотензивному шоці. Cochrane Database Syst Rev. 2016, 15 лют; PubMed Central | |||
| Таблиця S30. Профіль доказових даних: Рекомендація 19: вазопресин додатково vs норепінефрин | |||
| Результати | Кількість учасників (досліджень) | Відносний ефект (ДІ 95%) | Достовірність доказів |
| Загальна летальність (в кінці спостереження) | 3,430 (18 РКД) | RR 0.91 (0.85–0.99) | низька |
| Фібриляція передсердь | 1,358 (13 РКД) | RR 0.77 (0.67–0.88) | висока |
| Дигітальна ішемія | 2,489 (10 РКД) | RR 2.56 (1.24–5.25) | помірна |
Canadian Critical Care Society clinical practice guideline: The use of vasopressin and vasopressin analogues in critically ill adults with distributive shock. Can J Anaesth. 2020 Mar
Таблиця S31. Профіль доказових даних: Рекомендація 20: вищі vs нижчі показники середнього артеріального тиску (MAP)
| Результати | Кількість учасників (досліджень) | Відносний ефект (ДІ 95%) | Достовірність доказів |
| 28-Денна летальність | 894 (2 РКД) | OR 1.15 (0.87 до 1.52) | низька |
| 90-Денна летальність | 894 (2 РКД) | OR 1.08 (0.84 до 1.44) | низька |
| Суправентрикулярна
аритмія |
894 (2 РКД) | OR 2.50 (1.35–4.77) | помірна |
| Пошкодження міокарду | 894 (2 РКД) | OR 1.47 (0.64–
3.56) |
низька |
| Ішемія кінцівок | 894 (2 РКД) | OR 0.92 (0.36–
2.10) |
низька |
Таблиця S32. Профіль доказових даних: Рекомендація 22: кортикостероїди vs без кортикостероїдів в стані шоку
| Результати | Кількість учасників (досліджень) | Відносний ефект (ДІ 95%) | Достовірність доказів |
| Короткострокова летальність (<90 днів) | 7297 (22 РКД) | RR 0.96 (0.91–1.02) | висока |
| Довгострокова летальність (>90 днів) | 5667 (5 РКД) | RR 0.96 (0.90–1.02) | помірна |
| Серйозні несприятливі події | 5908 (10 РКД) | RR 0.98 (0.90–1.08) | низька |
ПИТАННЯ ВЕНТИЛЯЦІЙНОЇ ПІДТРИМКИ
Таблиця S33. Питання PICO*: Рекомендація 23–24
| Які стратегії оксигенації ми повинні рекомендувати для дорослих з COVID-19 інфекцією та дихальною недостатністю? | |||
| Популяція | Втручання | Контроль | Результати |
| Дорослі з COVID-19 та гострою дихальною недостатністю | Консервативні стратегії оксигенації | Ліберальні стратегії оксигенації | 1. Летальність |
*PICO — population, intervention, comparator, outcomes.
Таблиця S34. Питання PICO: Рекомендація 25
| Чи слід рекомендувати дорослим з COVID-19 та гострою дихальною недостатністю оксигенацію через високопотокову назальну канюлю (ВПНК) на противагу звичайному кисню? | |||
| Популяція | Втручання | Контроль | Результати |
| Дорослі з COVID-19 та гострою дихальною недостатністю | Високопотокова оксигенація через назальну канюлю | Типова стратегія оксигенації | 1. Летальність
2. ШВЛ 3. Комфорт пацієнта |
Таблиця S35. Питання PICO: Рекомендація 26
| Чи слід рекомендувати дорослим з інфекцією COVID-19 та гострою дихальною недостатністю неінвазивну вентиляцію під позитивним тиском (NIPPV) на противагу високопотоковій оксигенації через назальну канюлю (HFNC)? | |||
| Популяція | Втручання | Контроль | Результати |
| Дорослі з COVID-19 та гострою дихальною недостатністю | Неінвазивна вентиляція під позитивним тиском (NIPPV) | Високопотокова оксигенація через назальну канюлю | 1. Летальність
2. ШВЛ 3. Комфорт пацієнта |
Таблиця S36. Питання PICO: Рекомендація 30–31
| Чи слід рекомендувати дорослим з інфекцією COVID-19 та гострою дихальною недостатністю застосування захисної вентиляції легень на противагу вентиляції з більш високим дихальним об’ємом? | ||
| Популяція | Втручання Контроль | Результати |
| Дорослі з COVID-19 та гострою дихальною недостатністю | Захисна вентиляція легень | Вентиляція з більш високим дихальним об’ємом | 1. Летальність
2. Баротравма |
Таблиця S37. Питання PICO: Рекомендація 32
| Чи варто рекомендувати дорослим з інфекцією COVID-19 та середньоважким і важким РДС застосування PEEP з високою або з низькою оксигенацією? | |||
| Популяція | Втручання | Контроль | Результати |
| Дорослі з COVID-19 та середньоважким і важким РДС | PEEP з високою оксигенацією | PEEP з низькою оксигенацією | 1. Летальність
2. Баротравма |
Таблиця S38. Питання PICO: Рекомендація 34
| Чи варто рекомендувати дорослим з інфекцією COVID-19 і важким РДС вентиляцію у прон-позиції або вентиляцію у положенні на спині? | |||
| Популяція | Втручання | Контроль | Результати |
| Дорослі з COVID-19 і важким РДС | Вентиляція у прон-позиції | Вентиляція у положенні на спині | 1. Летальність
2. Несприятливі події |
Таблиця S39. Питання PICO: Рекомендація 35
| Чи варто рекомендувати дорослим з інфекцією COVID-19 і середньоважким та важким РДС тривале введення міорелаксантів або при необхідності болюсне введення міорелаксантів (без тривалої інфузії)? | |||
| Популяція | Втручання | Контроль | Результати |
| Дорослі з COVID-19 і середньоважким та важким РДС | Тривале введення міорелаксантів | Болюсне введення міорелаксантів при необхідності | 1. Летальність
2. Баротравма 3. Набута слабкість у ВРІТ |
Таблиця S40. Питання PICO: Рекомендація 36–37
| Чи варто рекомендувати дорослим з інфекцією COVID-19, РДС та гіпоксією, незважаючи на оптимізацію вентиляції, використання інгаляційних легеневих вазодилятаторів (оксид азоту) або не використовувати їх? | |||
| Популяція | Втручання | Контроль | Результати |
| Дорослі з COVID-19, РДС та гіпоксією, незважаючи на оптимізацію вентиляції | Інгаляційні легеневі вазодилятатори (оксид азоту) | Звичайна терапія | 1. Летальність
2. Ниркова недостатність |
Таблиця S41. Питання PICO: Рекомендація 38–39
| Чи варто рекомендувати дорослим з інфекцією COVID-19, РДС та гіпоксією, незважаючи на оптимізацію вентиляції, використання маневрів «мобілізації альвеол» або не використовувати їх? | |||
| Популяція | Чинник | Порівняння | Результати |
| Дорослі з COVID-19, РДС та гіпоксією, незважаючи на оптимізацію вентиляції | Тривале введення міорелаксантів | Болюсне введення міорелаксантів при необхідності | 1. Летальність
2. Оксигенація 3. Гемодинамічний компроміс |
Таблиця S42. Запитання PICO: Рекомендації 40
| Чи слід рекомендувати ЕКМО, попри оптимізацію вентиляційної та рятувальної терапії, дорослим пацієнтам з ГРДС, спричиненою COVID-19, і гіпоксією? | |||
| Популяція | Втручання | Контроль | Результати |
| Дорослі пацієнти з ГРДС, спричиненою COVID- 19, і гіпоксією, попри оптимізацію вентиляційної та рятувальної терапії | В-В ЕКМО | Без ЕКМО | 1. Летальність
2. Ниркова недостатність |
Загальне викладення доказових даних щодо вентиляційної підтримки:
Таблиця S43. Профіль доказових даних: Рекомендація 32 високі рівні PEEP vs низькі рівні PEEP при ГРДС
| Результати | Кількість учасників (досліджень) | Відносний ефект (95% ДІ) | Достовірність доказових даних |
| Лікарняна смертність —
З покращенням оксигенації на PEEP |
2031 (6 РКД) | Відносний ризик 0.87
(0.78–0.97) |
ПОМІРНА |
| Лікарняна смертність —
Без покращення оксигенації на PEEP |
1557 (2 РКД) | Відносний ризик 1.08
(0.98–1.18) |
ПОМІРНА |
| Баротравма —
Без покращення оксигенації на PEEP |
2089 (7 РКД) | Відносний ризик 0.80
(0.48–1.35) |
ПОМІРНА |
| Баротравма —
Без покращення оксигенації на PEEP |
1559 (2 РКД) | Відносний ризик 2.50
(1.64–3.79) |
ПОМІРНА |
Таблиця S44. Профіль доказових даних: Рекомендація 34: вентиляція в положенні на животі vs вентиляція в положенні на спині
| Результати | Кількість учасників (досліджень) | Відносний ефект (95% ДІ) | Достовірність доказових даних |
| Летальність
>12 год вентиляції в положенні на животі |
1,002 (5 РКД) | Відносний ризик 0.71
(0.52–0.97) |
ПОМІРНА |
| Летальність
<12 год вентиляції в положенні на животі |
1,135 (3 РКД) | Відносний ризик 1.04
(0.89–1.21) |
ПОМІРНА |
| Летальність — Середньоважкий або важкий ГРДС | 1,002 (5 РКД) | Відносний ризик 0.71
(0.52–0.97) |
ПОМІРНА |
| Летальність — Всі ГРДС | 1,135 (3 РКД) | Відносний ризик 1.04
(0.89–1.21) |
ПОМІРНА |
| Випадкове зміщення
центрального венозного катетера |
635 (2 РКД) | Відносний ризик 1.72
(0.43–6.84) |
ДУЖЕ НИЗЬКА |
| Пролежні | 1087 (3 РКД) | Відносний ризик 1.22
(1.06–1.41) |
ВИСОКА |
| Ускладнення з боку дихальних шляхів — Незапланована екстубація | 2067 (6 РКД) | Відносний ризик 1.14
(0.78–1.67) |
НИЗЬКА |
| Ускладнення з боку дихальних шляхів — обструкція ендотрахеальної трубки | 1594 (3 РКД) | Відносний ризик 1.76
(1.24–2.50) |
ПОМІРНА |
Таблиця S45. Профіль доказових даних: Рекомендація 35: постійне введення міорелаксантів vs періодичне введення міорелаксантів за потреби при ГРДС
| Результати | Кількість учасників (досліджень) | Відносний ефект (95% ДІ) | Достовірність доказових даних |
| Лікарняна смертність — (глибока седація в контрольній руці) | 431 (3 РКД) | Відносний ризик 0.72
(0.58–0.91) |
НИЗЬКА |
| Лікарняна смертність — (легка седація в контрольній руці) | 1006 (1 РКД) | Відносний ризик 0.99
(0.86–1.15) |
ПОМІРНА |
| Баротравма | 1437 (4 РКД) | Відносний ризик 0.55
(0.35–0.85) |
ПОМІРНА |
| Слабкість, набута внаслідок інтенсивної терапії (ICUAW) | 885 (4 РКД) | Відносний ризик 1.16
(0.98–1.37) |
ПОМІРНА |
Таблиця S46. Профіль доказових даних: Рекомендації 38–39: проведення мобілізаційних маневрів vs відсутність мобілізаційних маневрів при ГРДС
| Результати | Кількість учасників (досліджень) | Відносний ефект (95% ДІ) | Достовірність доказових даних |
| Лікарняна смертність | 2544 (8 РКД) | Відносний ризик 0.90
(0.78–1.04) |
ПОМІРНА |
| Лікарняна смертність —
Традиційні мобілізаційні маневри |
1345 (4 РКД) | Відносний ризик 0.85
(0.75–0.97)
|
ПОМІРНА |
| Лікарняна смертність —
Поступова мобілізація PEEP |
1199 (4 РКД) | Відносний ризик 1.06
(0.97–1.17)
|
ПОМІРНА |
| Летальність протягом 28 днів —
Традиційні мобілізаційні маневри |
1346 (4 РКД) | Відносний ризик 0.79
(0.64–0.96)
|
ПОМІРНА |
| Летальність протягом 28 днів — Поступова мобілізація PEEP | 1200 (4 РКД) | Відносний ризик 1.12
(1.00–1.25) |
ПОМІРНА |
| Баротравма | 1407 (5 РКД) | Відносний ризик 0.79
(0.46–1.37)
|
НИЗЬКА |
Таблиця S47. Профіль доказових даних: Рекомендація 40: ВВ ЕКМО vs без ЕКМО при ГРДС
| Результати | Кількість учасників (досліджень) | Відносний ефект (95% ДІ) | Достовірність доказових даних |
| 60-денна летальність | 429 (2 РКД) | Відносний ризик 0.73
(0.57–0.92) |
НИЗЬКА |
| Кровотеча — Масивна трансфузія | 249 (1 РКД) | Відносний ризик 3.02
(0.32–28.68) |
НИЗЬКА |
| Кровотеча — що потребує трансфузії | 249 (1 РКД) | Відносний ризик 1.64
(1.17–2.31) |
НИЗЬКА |
Запитання щодо терапії:
Таблиця S48. Запитання PICO: Рекомендація 41
| Чи повинні ми рекомендувати застосування системних кортикостероїдів, на противагу відсутності використання кортикостероїдів, у дорослих пацієнтів з COVID-19 і дихальною недостатністю (без ГРДС), які перебувають на механічній вентиляційній підтримці? | |||
| Популяція | Втручання | Контроль | Результат(и) |
| Пацієнти, які перебувають на механічній вентиляційній підтримці, з COVID-19 і дихальною недостатністю
(Без ГРДС) |
Системні кортикостероїди | Без системних кортикостероїдів | 1. Летальність
2. Органна недостатність 3. Інфекція 4. Нервово- м’язова слабкість 5. Шлунково- кишкова кровотеча 6. Гіперглікемія 7. Вірусне навантаження |
Таблиця S49. Запитання PICO: Рекомендація 42
Чи повинні ми рекомендувати застосування системних кортикостероїдів, на противагу відсутності їх використання, у дорослих пацієнтів з COVID-19 і ГРДС, які перебувають на механічній вентиляційній підтримці?
| Популяція | Втручання | Контроль | Результат(и) |
| Пацієнти, які перебувають на механічній вентиляційній підтримці, з COVID-19 і ГРДС | Системні кортикостероїди | Без системних кортикостероїдів | 1. Летальність
2. Органна недостатність 3. Інфекція 4. Нервово- м’язова слабкість 5. Шлунково- кишкова кровотеча 6. Гіперглікемія 7. Вірусне навантаження |
Таблиця S50. Запитання PICO: Рекомендація 43
| Чи повинні ми рекомендувати використання емпіричного антимікробного (антибактеріального) лікування, на противагу відсутності такого лікування, у пацієнтів з COVID-19 і дихальною недостатністю, що перебувають на механічній вентиляційній підтримці? | |||
| Популяція | Втручання | Контроль | Результат(и) |
| Пацієнти, які перебувають на механічній вентиляційній підтримці, з COVID-19 і дихальною недостатністю | Емпірична антимікробна (антибактеріальна) терапія | Без антибіотиків | 1.Летальність
2. Побічна дія |
Таблиця S51. Запитання PICO: Рекомендація 44
Чи повинні ми рекомендувати засоби для боротьби з лихоманкою, на противагу відсутності якихось втручань з цього приводу, тяжкохворим пацієнтам з COVID-19?
| Популяція | Втручання | Контроль | Результат(и) |
| Тяжкохворі дорослі пацієнти з COVID-19 і лихоманкою | Заходи для боротьби з лихоманкою management | Відсутність втручань | 1. Летальність
2. Побічна дія 3. Комфорт пацієнта 4. Шок |
Таблиця S53. Запитання PICO: Рекомендація 45
| Чи повинні ми рекомендувати використання в/в імуноглобуліну, на противагу не використанню в/в імуноглобуліну, у дорослих пацієнтів з COVID-19, які перебувають на механічній вентиляційній підтримці? | ||||
| Популяція | Втручання | Контроль | Результат(и) | |
| Дорослі пацієнти, які перебувають на механічній вентиляційній підтримці, з COVID-19 | в/в імуноглобулін | без в/в імуноглобуліну | 1. Летальність
2. Побічні ефекти |
|
Таблиця S54. Запитання PICO: Рекомендація 46
| Чи повинні ми рекомендувати використання плазми від реконвалесцента, на противагу не використанню плазми від реконвалесцента, у дорослих пацієнтів з COVID-19, які перебувають на механічній вентиляційній підтримці? | |||
| Популяція | Втручання | Контроль | Результат(и) |
| Пацієнти, які перебувають на вентиляційній підтримці, з COVID-19 | плазма від реконвалесцента | без плазми від реконвалесцента | 1. Летальність 2. Побічні дії |
Таблиця S55. Запитання PICO: Рекомендація 47
| Чи повинні ми рекомендувати використання противірусних препаратів, на противагу не використанню противірусних препаратів, у тяжкохворих пацієнтів з COVID-19? | |||
| Популяція | Втручання | Контроль | Результат(и) |
| Тяжкохворі пацієнти з COVID-19 | Противірусні препарати | Без противірусних препаратів | 1. Летальність
2. Побічні дії |
Таблиця S56. Запитання PICO: Рекомендація 48
| Чи повинні ми рекомендувати використання інтерферон, на противагу не використанню інтерферону, у дорослих пацієнтів з COVID-19, які перебувають на механічній вентиляційній підтримці? | |||
| Популяція | Втручання | Контроль | Результат(и) |
| Дорослі пацієнти, що перебувають на механічній вентиляційній підтримці, з COVID-19 | Інтерферон | Без
інтерферону |
1.Летальність
2. Побічні ефекти |
Таблиця S57. Запитання PICO: Рекомендація 49
Чи повинні ми рекомендувати використання хлорохіну, на противагу не використанню хлорохіну, у критично хворих пацієнтів з COVID-19?
| Популяція | Втручання | Контроль | Результат(и) |
| критично хворі пацієнти з COVID-19 | Хлорохін | Без хлорохіну | 1. Летальність
2. Побічні ефекти |
Загальне викладення доказових даних щодо терапії:
Рис. S7. Летальність: рекомендація 41: обсерваційне дослідження по вірусних пневмоніях
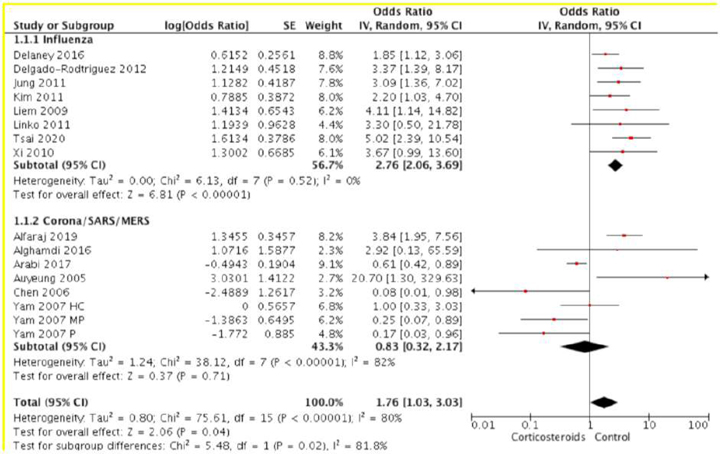
Таблиця S58. Профіль доказових даних: Рекомендація 41: Кортикостероїди vs Без кортикостероїдів у пацієнтів з COVID-19 без ГРДС
| Результати | Кількість учасників (досліджень) | Відносний ефект (95% ДІ) | Достовірність доказових даних (GRADE) | |
| Летальність обсерваційні по грипу) | (непрямі дослідження | (8 обсерваційних досліджень) | OR 2.76
(2.06–3.69) |
⨁ООО ДУЖЕ
НИЗЬКА |
| Летальність обсерваційні по коронавірусу) | (непрямі дослідження | (8 обсерваційних досліджень) | OR 0.83
(0.32–2.17) |
⨁ООО ДУЖЕ НИЗЬКА |
Рис. S8. Летальність: рекомендація 41: обсерваційне дослідження по вірусних ГРДС
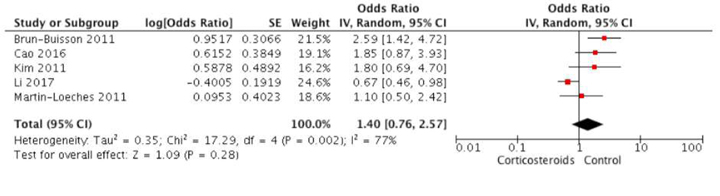
Рис. S9. Летальність: рекомендація 41: РКД по ГРДС (не обов’язково вірусних)
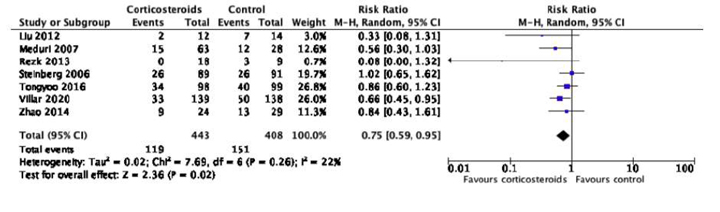
Таблиця S59. Профіль доказових даних: Рекомендація 42: Кортикостероїди vs Відсутність кортикостероїдів в пацієнтів з ГРДС, спричиненим COVID-19
| Результати | Кількість
учасників (досліджень) |
Відносний ефект (95% ДІ) | Достовірність доказових даних (GRADE) |
| Летальність (Непрямі доказові дані з РКД по ГРДС) | (7 РКД) | RR 0.75
(0.59–0.95) |
НИЗЬКА |
| Летальність (Непрямі доказові дані з обсерваційних досліджень щодо ГРДС внаслідок грипу) | (5 обсерваційні дослідження) | OR 1.40
(0.76–2.57) |
ДУЖЕ НИЗЬКА |
| Летальність (Прямі доказові дані — Wu et al.) | (1 обсерваційне дослідження) | HR 0.38
(0.20–0.72) |
ДУЖЕ НИЗЬКА |
Таблиця S60. Профіль доказових даних: Рекомендація 47: лопінавір/ритонавір vs без лопінавіру/ритонавіру в критично хворих пацієнтів з COVID-19
| Результати | Кількість учасників (досліджень) | Відносний ефект (95% ДІ) | Достовірність доказових даних (GRADE) |
| 28-денна
смертність |
(1 РКД) | RD -5.8%
(-17.3–5.7) |
НИЗЬКА |
| Час покращення симптомів | (1 РКД) | MD 1.31 днів
(0.95–1.80) |
НИЗЬКА |
Над перекладом працювала команда лікарів медичної мережі «Добробут»:
Летичевська Вероніка, Джус Марія, Пилипко Марія, Бецько Ніна, Зеленчук Олександра, Кулянков Олександр.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим