 В предыдущей нашей публикации мы обосновали необходимость организации и проведения клинических исследований (КИ) в детской популяции, оставив открытыми вопросы практической их реализации. Однако очевидно, что особенности детских КИ не ограничиваются особенностями детского организма. Ведь необходимо говорить и о правильном выборе возрастных групп, и о сложностях обсуждения информации для пациентов и процесса подписания информированного согласия, и об адекватном выборе способа оценки эффективности препарата, и о многом другом.
В предыдущей нашей публикации мы обосновали необходимость организации и проведения клинических исследований (КИ) в детской популяции, оставив открытыми вопросы практической их реализации. Однако очевидно, что особенности детских КИ не ограничиваются особенностями детского организма. Ведь необходимо говорить и о правильном выборе возрастных групп, и о сложностях обсуждения информации для пациентов и процесса подписания информированного согласия, и об адекватном выборе способа оценки эффективности препарата, и о многом другом.Начнем же мы обсуждение практических рекомендаций по педиатрическим КИ с определения детского возраста, так как при чтении различных документов необходимо четко понимать рамки их приложения. Итак, например, в различных руководствах Международной конференции по гармонизации, к примеру в документе «Клинические исследования лекарственных средств в педиатрической популяции» [1], термин «дети» относится к лицам в возрасте от 2 до 11 лет, а в европейских нормативных документах (например Директиве ЕС/2001/20 [2]) — к лицам от рождения и до достижения совершеннолетия (в зависимости от национального законодательства это может быть 16 или 18 лет).
Когда следует инициировать педиатрические КИ?
Поскольку разработка лекарственных форм для детей обычно занимает достаточно много времени, важно рассматривать ее необходимость и начинать работу в этом направлении уже на ранних этапах исследования лекарственного средства (ЛС). Однако в то же время следует помнить, что многие новые ЛС показывают недостаточную эффективность или неприемлемый профиль безопасности по результатам КИ І и ІІ фаз (что влечет за собой прекращение их разработки). Поэтому чересчур раннее начало исследований с участием детей может подвергнуть их ненужному воздействию бесполезного (или даже вредного) ЛС.
Практически необходимость в разработке программы КИ в детской популяции (а также степень ее срочности) зависит от многих факторов, включая (1) распространенность заболевания, для лечения которого разрабатывается ЛС, в детской популяции, (2) серьезность заболевания, для лечения которого разрабатывается ЛС, (3) существование и пригодность альтернативных методов лечения этого заболевания у детей, включая их эффективность и профиль безопасности (в том числе вопросы безопасности уникальные для детского возраста), (4) принципиальную новизну разрабатываемого ЛС (или принадлежность его к классу с уже изученными свойствами), (5) существование уникальных педиатрических показаний для назначения изучаемого ЛС, (6) необходимость разработки конечных точек, специфичных для детского возраста, (7) возраст детей, для лечения которых предназначено ЛС, (8) уникальные педиатрические (связанные с развитием) вопросы безопасности ЛС, (9) потенциальные нужды в разработке препаратов и лекарственных форм для детской практики [1].
Очевидно, что прежде чем начинать КИ у детей, необходимо располагать достаточными доклиническими, а также клиническими данными, полученными в КИ у взрослых. Необходимому объему доклинических (или, как сейчас принято говорить, неклинических) исследований посвящен документ ICH M3 [3]. Согласно этому руководству до начала КИ в детской популяции должны быть известны результаты исследований токсичности повторных доз, исследований влияния на репродуктивную функцию, а также стандартного набора тестов на генотоксичность. Необходимость в исследованиях с использованием животных подросткового возраста должна оцениваться в каждом отдельном случае. До начала КИ, предусматривающего долгосрочное назначение исследуемого ЛС, должны быть проведены тесты на канцерогенность, с учетом длительности лечения и наличия подозрений в канцерогенности препарата [3]. Вопрос о необходимом минимальном объеме КИ у взрослых немного сложнее, т.к. по сути типы КИ во взрослой популяции, результаты которых необходимо иметь до начала исследований у детей, во многом зависят от особенностей фармакокинетики исследуемого ЛС, показаний, возраста целевой детской популяции и многих других факторов, то есть должны оцениваться в каждом конкретном случае.
Так, для некоторых ЛС все КИ, включая самые ранние фазы, могут и должны проводиться с привлечением исключительно детей соответствующего возраста, так как назначение препаратов взрослым не позволит получить значимую информацию или даже подвергнет их необоснованному риску. Это касается таких ЛС как, например, сурфактанты для лечения дистресс-синдрома новорожденных, или препараты, направленные на коррекцию метаболических нарушений при генетически обусловленных заболеваниях, уникальных для педиатрической практики. Бывают случаи, когда оправдано назначение пациентам, в том числе и детям, почти неизученного ЛС.
Ярким примером может служить недавняя апробация разрабатываемого препарата для лечения недостаточности кофактора молибдена (molybdenum cofactor deficiency — MoCD) — редкого наследственного заболевания, сопровождающегося нарушением метаболизма метионина и цистеина, выраженным поражением ЦНС, с летальным исходом (в большинстве случаев) в раннем детстве. В 2004 г. была опубликована работа немецкого ученого доктора Шварца [4], в которой он на основании неклинического исследования на нескольких десятках мышей предположил, что циклический монофосфат пираноптерина (cyclic pyranopterin monophosphate), может быть эффективным в лечении MoCD у людей. В мае 2008 г. доктор одной из клиник Австралии поставил диагноз MoCD новорожденной девочке, у которой судорожный синдром развился в возрасте 3 дней. Девочке было бы суждено умереть, если бы не отчаянная попытка врачей и родителей, — за 2 нед была достигнута договоренность с д-ром Шварцем, получено одобрение этического комитета клиники, доставлен имеющийся запас препарата из Кёльна в Мельбурн. По словам очевидцев, состояние пациентки (до того находящейся в коме) разительно улучшилось в течение 3 дней после начала лечения. Девочка получает лечение до сих пор, хорошо развивается и в возрасте 18 мес уже говорит и ходит. Осенью 2009 г. этот препарат был также назначен новорожденному мальчику с MoCD в Германии [4, 5].
Конечно же, этот случай является редчайшим исключением из обычной практики проведения КИ, но в случае разработки препаратов-сирот (orphan drugs) для лечения редких заболеваний возможны и такие варианты (подробнее об исследовании и регистрации препаратов-сирот в наших следующих публикациях).
| РИСУНОК | |
 |
|
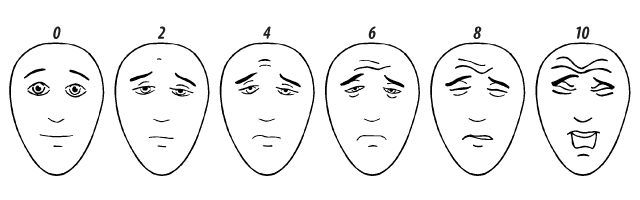
| Визуальная шкала оценки боли у детей
«На картинках изображен человечек, который поможет нам узнать, насколько тебе больно. Сейчас ему (покажите изображение слева) совсем не больно. А вот теперь ему становится все больнее и больнее (покажите каждое изображение слева направо). На последней картинке (покажите изображение справа) человечку очень-очень больно. Теперь покажи мне на этом человечке, как больно тебе». Баллы, оценивающие степень боли, расположены слева направо: 0, 2, 4, 6, 8, 10, где 0 баллов — это «совсем не больно», а 10 — «очень-очень больно». Примечания:
|
|
На что необходимо ориентироваться при выборе целевой возрастной группы?
Детская популяция, включающая детей от периода новорожденности до подросткового возраста, безусловно, очень разнородна по физиологическим и психологическим характеристикам. Дозы назначаемых в клинической практике и исследуемых ЛС могут колебаться в сотни раз; зависят от возраста и выбора оптимальной лекарственной формы. В соответствии с документом EMEA/CHMP/PEG/194810/2005 («Лекарственные формы выбора для педиатрической популяции») в детском возрасте выделяют следующие возрастные периоды:
- недоношенные новорожденные;
- доношенные новорожденные (от рождения до 1 мес);
- младенцы (от 1 до 23 мес);
- дети (от 2 до 11 лет);
- подростки (от 12 до 18 лет).
Такие рамки отражают биологические изменения — изменения после рождения, ранний рывок роста, постепенный рост между 2 и 12 годами, пубертатный рывок и развитие. Возрастная группа от 2 до 11 лет может быть еще разделена по способности детей принимать и использовать различные лекарственные формы — на детей дошкольного возраста (от 2 до 5 лет) и детей школьного возраста (от 6 до 11 лет). В категории «недоношенные новорожденные» особые сложности представляют дети, родившиеся на 23–24-й неделе гестации с массой тела менее 1000 г.
Кроме возраста, при определении целевых групп КИ нужно оценивать также возможность и необходимость включения в КИ определенных этнических подгрупп, или подгрупп с определенными генетическими характеристиками (например недостаточностью глюкозо-6-фосфат дегидрогеназы). Генетические отклонения могут существенно изменять пути метаболизма ЛС, а следовательно влиять на клиническую эффективность и профиль безопасности ЛС [6–8].
Особенности дизайна КИ с привлечением детей в качестве испытуемых
Оптимальный дизайн КИ в детской популяции зависит от целей исследования и поставленных научных вопросов, а также должен учитывать требования ICH GCP и других применимых руководств. При подготовке протокола КИ у детей следует безусловно учитывать как научные, так и этические аспекты. Соответствующий документ ЕМЕА [8] рекомендует членам этических комитетов при рассмотрении педиатрических КИ обращать внимание в том числе и на следующие позиции (полный список представлен в [8], раздел 8.2 и Приложение 2): не повторяет ли КИ подобные, основанные на той же гипотезе; обеспечены ли защита и безопасность детей (включая минимизацию рисков, страхов, боли и стресса), а также присутствие квалифицированного в педиатрии персонала в каждом исследовательском центре; предоставлено ли обоснование включения детей конкретных возрастных групп и используется ли соответствующая возрасту лекарственная форма исследуемого препарата и др.
Поскольку дети являются уязвимой популяцией, КИ с их участием требуют особых предосторожностей в дизайне. Так, например, плацебо лучше использовать как дополнение к стандартной терапии или же в тех ситуациях, когда не существует альтернативного лечения. И в том, и в другом случае необходимо предпринять все возможные меры по минимизации периода приема плацебо и не допустить нанесения необратимого ущерба здоровью детей (особенно при заболеваниях, для которых характерно стремительное ухудшение состояния). Кроме того, протоколом должно быть предусмотрено лечение в случае ухудшения, а также процедура экстренного выхода из исследования.
При планировании КИ в детской практике следует также уделять особое внимание степени инвазивности и/или некомфортности диагностических и лечебных мероприятий, а также адекватному применению седации или анальгезии при необходимости — боль и стресс, которым подвергается ребенок, принимающий участие в КИ, должны быть сведены к минимуму. Примерами процедур, доставляющих физическое или психическое страдание, могут служить венепункция, люмбарная пункция, биопсия, повторные осмотры поврежденных частей тела, эндотрахеальная интубация, воздействие холода или шума, иммобилизация и др. [6, 8]. Расчет необходимого объема забираемой крови должен проводиться с учетом физиологических особенностей детского организма и общего объема крови в соответствующем возрасте — особенно у доношенных и недоношенных новорожденных (для последних часто характерна анемия) и младенцев. Так, документ ЕМЕА [8] рекомендует, чтобы потери крови (включая потери при выполнении манипуляции) в КИ не превышали 3% общего объема крови (рассчитывается как 2,4 мл на килограмм массы тела) в течение 4 нед и не превышали 1% общего объема крови за один забор.
Особое внимание нужно уделять вопросу привлечения здоровых детей в качестве испытуемых. По этическим соображениям это допустимо только в редких случаях (например в случае КИ профилактических вакцин), а изучение воздействия ЛС на здоровый организм лучше проводить на взрослых, которые могут осознанно и самостоятельно принять решение об участии в КИ [8].
Немаловажным вопросом является определение оптимального размера выборки — с одной стороны, он должен быть как можно меньше (чтобы подвергать рискам участия в КИ минимальное количество детей), а с другой — достаточно большим для получения значимого результата (чтобы оправдать риски для участвующих в КИ детей). Для того чтобы максимально уменьшить количество набираемых пациентов, рекомендуется в каждом случае рассматривать возможность использования адаптивных дизайнов, перекрестных дизайнов и Байесовского анализа [6, 8].
При обсуждении особенностей дизайна КИ у детей нельзя не упомянуть также о трудностях в определении специфичных для детского возраста объективных и суррогатных оценок исходов (как эффективности, так и безопасности). Так, например, при проведении КИ препаратов для лечения болезни Крона у детей (в отличие от взрослых) следует прицельно изучать влияние ЛС на линейный рост, а при исследовании ЛС в младшем возрасте — обращать внимание на скорость нейропсихического развития [9]. Часто возникает необходимость в разработке специфичных для возраста оценок конечных точек, например для оценки боли используют специальную детскую визуальную шкалу с изображением различных эмоций выражения лица, соответствующего «отсутствию боли» до выражения лица «очень сильная боль» (рисунок).
Особое внимание следует уделять также процедурам, связанным с оценкой профиля безопасности исследуемого ЛС, — во-первых, дети чаще всего не могут адекватно рассказывать о нежелательных явлениях, а во-вторых, необходимо создать условия для как можно более длительного фармаконадзора и тщательной обработки данных для выявления подозрительных сигналов.
Проблемы и особенности информирования пациентов и их родителей
По данным, приведенным Викторией Пембертон (Victoria L. Pemberton ) [10], опрос почти 6 тыс. взрослых американцев показал, что 67% из них согласны с необходимостью проведения КИ у детей, однако только 25% опрошенных согласились бы обдумать возможность участия в КИ своих детей. Эти цифры подтверждают распространенное мнение о сложности привлечения детей в КИ и заставляют говорить об особенностях информирования об исследовании, связанных с ним рисках и возможных положительных моментах.
Возрастные рамки, в которых дети могут или должны давать отдельное согласие на участие в КИ, не определены такими международными руководствами, как ICH GCP, например, а зависят от законодательства конкретных стран. ЕМЕА рекомендует следующее разделение [8]:
- дети от рождения до 3 лет — невозможно получить согласие;
- дети от 3 лет (до 11) — необходимо предоставлять информацию в соответствии с возрастом, несмотря на то что в некоторых случаях невозможно оценить мнение ребенка;
- подростки — в этом возрасте дети уже способны к принятию самостоятельных решений, и эту способность необходимо уважать, то есть согласие подростка на участие в КИ почти всегда требуется. В то же время родители/опекуны несут ответственность за ребенка до его совершеннолетия, поэтому без их согласия участие ребенка в КИ недопустимо.
Кроме привлечения маленьких пациентов в КИ, проблематичным для исследователей является их удержание, и здесь основную роль играют взаимоотношения между членами исследовательской команды и родителями. Удержание испытуемых в педиатрических КИ важно как для самих испытуемых (чтобы иметь возможность отследить и своевременно отреагировать на возможные нежелательные медицинские события), так и для достижения целей КИ, ведь регуляторные органы будут требовать данные о долгосрочной безопасности, чтобы иметь возможность оценить потенциальное влияние препарата на рост и развитие. В связи с этим предполагается также, что этические комитеты должны уделять особое внимание достаточному сроку действия страховки и предусмотренности выплат в отсроченный период [8].
Заключение
Как отмечено в соответствующем руководстве ICH [1], получение знаний об эффектах ЛС у детей является важной задачей. Но при достижении этой цели нельзя ставить под угрозу благополучие пациентов детского возраста, участвующих в КИ. Ответственность за соблюдение необходимого баланса и за защиту прав и благополучия маленьких пациентов лежит на фармацевтических компаниях, регуляторных органах, специалистах в области здравоохранения и обществе в целом.
Таким образом, остается еще достаточно много нерешенных вопросов, касающихся оптимального дизайна КИ у детей, эффективных методов обработки данных, возможности проведения надежных лабораторных тестов с минимальным количеством биоматериала (в первую очередь крови), этических аспектов рассмотрения материалов исследований и т.д., однако сама необходимость проведения тщательно спланированных и научно обоснованных КИ, соответствующих всем этическим принципам, не подлежит сомнению.
Литература
1. ICH, 2000 Topic E11. Clinical Investigation of Medicinal Products in Pediatric Population. [Online] Available from Accessed on 10 Oct 2009
2. Directive 2001/20/EC OF the European Parliament and of the Council of 4 April 2001 on the approximation of the laws, regulations and administrative provisions of the Member States relating to the implementation of good clinical practice in the conduct of clinical trials on medicinal products for human use (Official Journal L 121, 1/5/2001 p. 34 — 44).
3. ICH, 2009. Topic M 3 (R1) Non-Clinical Safety Studies for the Conduct of Human Clinical Trials for Pharmaceuticals [Online] Available from Accessed on 10 Oct 2009
4. Schwarz G. et al (2004). Rescue of lethal molybdenum cofactor deficiency by a biosynthetic precursor from Escherichia coli. HMG Advance Access published April 28, 2004 [Online] Available from Accessed on 21 Nov 2009
5. Tedmanson S. (2009) Baby With Rare Disease Cured in Medical World First, at CheckOrphan website. Published on Nov 5, 2009. [Online] Available from Accessed on 21 Nov 2009
6. Smit-Marshall P. (2007) Pediatric Policies Grow Up. Applied Clinical Trials [Online] Jul 1, 2007. Available from http://appliedclinicaltrialsonline.findpharma.com/appliedclinicaltrials/Trial+Design+Articles/Pediatric-Policies-Grow-Up/ArticleStandard/Article/detail/439743 Accessed on 01 Oct 2009
7. EMEA, 2005. Reflection Paper: Formulations of Choice for the Paediatric Population EMEA/CHMP/PEG/194810/2005 [Online] Available from Accessed on 10 Oct 2009
8. EMEA (2008) Ethical Considerations for Clinical Trials on Medicinal Products Conducted with the Paediatric Population [Online] Available from http://ec.europa.eu/enterprise/pharmaceuticals/eudralex/vol-10/ethical_considerations.pdf Accessed on 15 Oct 2009
9. Ian Sinha et al. (2008) A Systematic Review of Studies That Aim to Determine Which Outcomes to Measure in Clinical Trials in Children. PLoS Medicine. Vol 5, issue 4, April 2008 [Online] Available from . Accessed on 9 Dec 2009
10.Pemberton VL (2009) No More Hands-Me-Down. Research Designed for Chilldren. ACRP Monitor Vol 23, issue 7. Dec 2009 — pp.55-59.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим