?
Генная терапия (ГТ) является новым, перспективным направлением развития различных областей медицины. Во всем мире проведено около 400 клинических исследований, в которых приняли участие немногим более 3 тыс. человек. Быстрому развитию этой области медицины способствовали результаты, полученные в ходе выполнения Проекта человеческого генома. Кстати, проведение первых клинических исследований по ГТ (1990 г.) совпало с началом реализации этого проекта.
ГТ является методом направленной регуляции экспрессии отдельных генов с целью лечения или профилактики заболеваний (экспрессия гена — высокоспецифический процесс, при котором ген включается на определенное время для продукции соответствующего белка).
Теоретически ГТ можно проводить как в отношении соматических, так и половых клеток. При соматической ГТ изменения, внесенные в геном пациента, не передаются потомству. Целью ГТ, воздействующей на половые клетки, является передача генетических изменений последующим поколениям. Этот вид ГТ сегодня не применяют, хотя широко обсуждают возможность генетической модификации половых клеток, ее последствия и связанные с этим этические проблемы.
При ГТ чаще всего используют метод внесения терапевтического гена. Разрабатывают также методы коррекции дефектных генов (при мутациях, изменяющих небольшой участок ДНК), замены дефектного гена нормальным, методы усиления экспрессии нормального гена, восстановления экспрессии блокированного гена или методы блокады экспрессии болезнетворного гена.
Для введения терапевтического гена в клетки пациента используют специальные генные носители (векторы). В некотором смысле ГТ можно рассматривать как использование генов в качестве лекарственных средств. При этом одной из самых сложных проблем является разработка подходов, обеспечивающих (аналогично лекарственным препаратам) специфическую, эффективную и безопасную доставку генетического материала (лекарства) в соответствующие клетки-мишени пациента. Проблема доставки гена значительно усложняется в тех случаях, когда необходимо перенести большой ген, особенно в клеточное ядро. Правильное внесение гена обеспечивает его функционирование в течение всей жизни человека и полное излечение пациента от соответствующего заболевания.
В качестве векторов могут быть использованы ослабленные и модифицированные вирусы (ретровирусы, аденовирусы, адено-ассоциированные вирусы, вирус герпеса и др.) или синтезированные векторы, например участки ДНК, заключенные внутри специальных липидных сфер (липосом), способных переносить гены реципиенту. Для клинического применения векторы должны обладать определенными качествами. Однако универсального вектора не существует. Любой вектор имеет свои преимущества и недостатки. Одни векторы легко проникают в делящиеся клетки, но не способны инфицировать клетки, находящиеся в состоянии покоя (ретровирусы); другие — могут вызывать иммунный ответ на вирусные белки, тем самым приводя к быстрой элиминации внесенного генетического материала из организма (аденовирусы); третьи — способны проникать в неделящиеся клетки, но могут представлять потенциальную опасность для человека (лентивирусы, например, ВИЧ); четвертые — непатогенны, могут инфицировать неделящиеся клетки и обеспечивать достаточно длительную экспрессию внесенных генов, но они не могут переносить большие участки ДНК и их трудно получить в большом количестве (адено-ассоциированные вирусы); пятые — неиммуногенны, могут доставлять большое количество генетического материала в организм человека, но значительно меньшее — внутрь клеточного ядра, к тому же относительно быстро разрушаются в организме или перенесенный ген экспрессируется кратковременно (липосомы). Выбор вектора и метода его доставки определяется конкретной целью ГТ, поскольку от характера заболевания зависит, в клетки каких тканей необходимо ввести гены, как долго и в каком количестве они должны экспрессироваться и др. При разработке ретровирусных векторов использовали природную способность вирусов проникать в инфицируемые клетки через рецепторы, обеспечивая доставку своего генетического материала внутрь клеточного ядра для последующего размножения. Вирусы подвергали специальной обработке, чтобы лишить их болезнетворных генов и встроить терапевтические гены. Поскольку ретровирусы не способны проникать внутрь клеток, находящихся в состоянии покоя, первые клинические исследования проводили ex vivo: получали клетки из тканей организма, культивировали их, затем вносили ретровирусный вектор, после чего клетки, содержащие терапевтические гены, вводили пациенту (рис. 1).
|
В качестве клеток-мишеней использовали лимфоциты, клетки костного мозга, солидных опухолей, печени, легких, сердца, скелетных мышц и др. В последующих клинических исследованиях стали применять различные подходы in vivo, используя для переноса генетического материала в организм реципиента все возможные пути введения (всего в клинических исследованиях использовано 18 разных путей введения).
Вначале разработка метода ГТ была в основном направлена на лечение заболеваний, вызванных дефектом только в одном гене (гемофилии, мышечной дистрофии Дюшенна, серповидно-клеточной анемии). Затем продолжили исследования в направлении ряда приобретенных заболеваний, развитие которых обусловлено комплексным взаимодействием генов и воздействием факторов окружающей среды. Значительная часть клинических исследований посвящена лечению больных со злокачественными новообразованиями (около 64% от числа всех исследований), с наследственными моногенными болезнями (13%) и инфекционными заболеваниями (8%), в частности СПИДом (подробнее см. сайт в Интернете http://www.wiley.co.uk/genetherapy/ clinical/index.html).
Однако в первых клинических исследованиях не удалось достичь продолжительного терапевтического эффекта (за исключением применения ГТ у больных с наследственным дефицитом фермента аденозиндезаминазы). В ходе клинических исследований часто возникали определенные проблемы: векторы не всегда достигали нужных клеток, перенос генов был неэффективен или их экспрессия недостаточно продолжительна для достижения терапевтического эффекта, часто развивался клеточный или гуморальный иммунный ответ на вирусные или трансгенные белки, что требовало введения повторных доз генетического материала, и др. Выявленные недостатки и возникшие проблемы вызвали необходимость проведения фундаментальных, более целенаправленных клинических исследований. По мере своего развития ГТ привлекала все большее внимание биотехнологических компаний, что явилось важным стимулом для ее становления, поскольку частные компании активно стремятся найти практическое применение ГТ в отношении большего контингента пациентов.
|
Когда при проведении ГТ пациенту переносят ген, который кодирует дефицитный белок, это можно рассматривать как альтернативный метод доставки терапевтических протеинов (рис. 2). Сейчас многие фармацевтические компании используют технологию рекомбинантной ДНК для получения лекарственных препаратов. Например, на фармацевтическом рынке Украины к таким препаратам относятся рекомбинантные аналоги человеческого инсулина (компаний «Eli Lilly», «Novo Nordisk», «Hoechst», «Berlin-Chemie», «Индар»), гормона роста (рекомбинантный соматропин компаний «Eli Lilly», «Pharmacia & Upjohn», «Novo Nordisk») и эритропоэтина (компаний «Lek», «Janssen-Cilag»). Это современные высококачественные препараты, однако все они предназначены для систематического или периодического парентерального введения пациентам.
Разрабатываемые методы ГТ направлены на устранение повторных инъекций лекарственных препаратов, что является существенным преимуществом для пациента, в том числе экономического характера. Так, в Институте генной терапии человека Пенсильванского университета разработан вектор (на основе адено-ассоциированного вируса), несущий ген, который кодирует продукцию фактора IX системы свертывания крови (антигемофильный глобулин В). Такой вектор можно ввести внутримышечно больным гемофилией В, благодаря чему миоциты смогут продуцировать фактор IX, что предупредит возникновение кровотечений. Результаты первых клинических исследований свидетельствуют, что после такой ГТ пациенты с гемофилией более года не испытывали необходимости в инъекциях фактора IX. В настоящее время на проведение курсов заместительной терапии для одного больного гемофилией А или В (рекомбинантными факторами VIII или IX, позволяющими остановить острое кровотечение, но не предупреждающими его развитие) в США ежегодно затрачивают 100 тыс. долларов. Если новый метод лечения позволит пациентам обходиться без инъекций в течение 5–10 лет, то экономическая выгода от проведения ГТ несомненна.
При таком методе ГТ вводимый ген постоянно «включен», поэтому протеин может продуцироваться и в тех случаях, когда организм в нем не нуждается. Сейчас разрабатывается метод ГТ, при которой вектор будет содержать ген, кодирующий продукцию какого-либо белка, а также молекулярную структуру, которая способна регулировать экспрессию гена в зависимости от приема внутрь специального лекарственного средства.
Дж. Вильсон, один из «пионеров» ГТ и директор Института генной терапии человека при Медицинском центре Пенсильванского университета (США), считает, что в ближайшие годы концепция ГТ найдет практическое применение прежде всего при лечении некоторых наследственных заболеваний, а позже — в области онкологии и кардиологии.
В кардиологии разрабатывают методы использования аденовирусных векторов для переноса генов, способных вызывать гиперплазию миоцитов в клетки миокарда пациентов, перенесших инфаркт. Однако повреждение клеток в результате прямого введения генетического материала в миокард, а также индукция клеточного иммунного ответа на антигены аденовируса пока препятствуют внедрению этих методов в клиническую практику.
Для лечения ишемической болезни сердца перспективен метод ГТ, направленный на стимуляцию образования новых кровеносных сосудов (ангиогенез). На стадии эмбрионального развития в процессах ангиогенеза может участвовать множество факторов роста. Однако у взрослого человека ангиогенные факторы в основном продуцируются при заживлении ран, а также при некоторых патологических процессах (росте злокачественных опухолей или при диабетической ретинопатии). При разработке методов ангиогенной ГТ изучают факторы роста, которые можно использовать для активации ангиогенеза (рис. 3). Для лечения больных с солидными злокачественными опухолями, наоборот, разрабатывают методы подавления ангиогенеза посредством ингибиции выработки эмбрионального фактора роста, стимулирующего ангиогенез.
|
Энтузиазм в отношении перспектив ГТ несколько «угас» в связи со значительными трудностями, возникшими на пути практической реализации метода, а также с отсутствием безусловных доказательств клинической эффективности ГТ. Отчасти некоторое разочарование в ГТ было связано с неоправданным ожиданием быстрого успеха, чему способствовало недостаточное или неточное освещение ситуации в данной области, когда недооценивались трудности и преувеличивались ближайшие перспективы ГТ. Однако это не означает, что развитие ГТ потерпело неудачу. За короткий период ее существования выполнен огромный объем экспериментальных работ, а также проведены первые клинические исследования, что значительно укрепило научную базу ГТ. Сегодня многие специалисты считают, что вопрос не в том, будут ли достигнуты значительные клинические успехи в результате проведения ГТ, а в том, когда это произойдет.
?
Андрей Спасокукоцкий

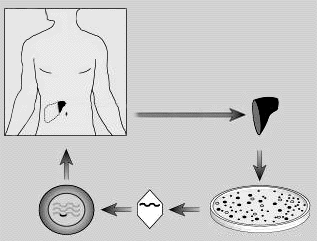
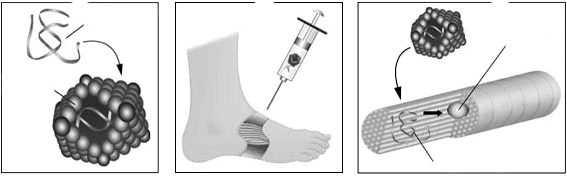
 Рис. 3. Биошунтирование с помощью ангиогенной ГТ при операции на открытом сердце. Используя инсулиновый шприц, хирург вводит в миокард аденовирусный вектор с геном, кодирующим синтез фактора роста эндотелиальных клеток сосудов
Рис. 3. Биошунтирование с помощью ангиогенной ГТ при операции на открытом сердце. Используя инсулиновый шприц, хирург вводит в миокард аденовирусный вектор с геном, кодирующим синтез фактора роста эндотелиальных клеток сосудов
Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим