І. ЗМІНИ ЩОДО ЕКСКЛЮЗИВНОСТІ ДАНИХ
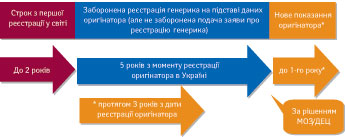
 Відповідно до закону, якщо оригінальний лікарський засіб зареєстровано в Україні вперше, державна реєстрація його генерика можлива не раніше, ніж через 5 років із дня першої реєстрації оригінального препарату. Цей строк ексклюзивності встановлюється виключно у випадку, якщо заява про державну реєстрацію в Україні оригінального лікарського засобу була подана протягом 2 років із дня його першої реєстрації в будь-якій країні світу (рисунок).
Відповідно до закону, якщо оригінальний лікарський засіб зареєстровано в Україні вперше, державна реєстрація його генерика можлива не раніше, ніж через 5 років із дня першої реєстрації оригінального препарату. Цей строк ексклюзивності встановлюється виключно у випадку, якщо заява про державну реєстрацію в Україні оригінального лікарського засобу була подана протягом 2 років із дня його першої реєстрації в будь-якій країні світу (рисунок).
П’ятирічний строк ексклюзивності даних може бути продовжено до 6 років у разі, якщо протягом перших 3 років після реєстрації оригінального препарату МОЗ України або уповноваженим ним органом дозволено застосування такого препарату за одним або більше показаннями, які мають особливу перевагу над існуючими. Правила та критерії визначення показань, що мають особливу перевагу над існуючими, буде встановлено відповідним наказом МОЗ України.
Заборона реєстрації генеричного препарату із посиланням на реєстраційні дані оригінатора не застосовуватиметься, якщо:
- заявник одержав право посилатися та/або використовувати таку інформацію від оригінатора;
- заявник подав власну повну реєстраційну інформацію, що відповідає вимогам до реєстраційної інформації оригінального препарату.
Отже, порядок охорони реєстраційної інформації в Україні зазнав суттєвих змін.
По-перше, заявник реєстрації генеричного препарату зможе подавати заяву на реєстрацію до закінчення п’ятирічного строку ексклюзивності і при цьому отримувати свідоцтво про реєстрацію відразу після завершення такого строку.
По-друге, інноваційні виробники втрачають право на ексклюзивність, якщо протягом 2 років із першої реєстрації препарату в світі не подадуть його на реєстрацію в Україні. Це обмеження, на нашу думку, має певну перевагу для інноваційних компаній, оскільки, ймовірно, не дозволить заявникам де-факто генеричних препаратів штучно отримати право на ексклюзивність при подачі на реєстрацію власної повної реєстраційної інформації.
По-третє, у новому формулюванні закону ми вбачаємо додаткові гарантії судового захисту прав оригінаторів на ексклюзивність. Така позиція базується на адресованій МОЗ забороні реєструвати генеричні лікарські засоби до закінчення п’ятирічного строку ексклюзивності. Слід зазначити, що попередня редакція закону забороняла заявникам (виробникам генеричних препаратів) посилатися на реєстраційну інформацію оригінальних лікарських засобів при поданні заяви на реєстрацію протягом 5 років із дати такої реєстрації.
По-четверте, закон створює підстави для додаткової (максимум річної) ексклюзивності для суттєвих нових показань оригінальних препаратів. Скористатися таким механізмом можна буде тільки після затвердження МОЗ правил та критеріїв визначення показань, що мають особливу перевагу над існуючими.
ІІ. ПРИМУСОВЕ ЛІЦЕНЗУВАННЯ
Закон передбачає, що з метою забезпечення здоров’я населення при реєстрації лікарського засобу Уряд може дозволити використання запатентованого винаходу, що стосується такого препарату, конкретному заявнику без згоди власника патенту (за умови, що останній безпідставно відмовляє у видачі ліцензії). Звертаємо увагу на те, що механізм примусового ліцензування не є новим в Україні. Загальні умови видачі примусової ліцензії визначені ст. 30 Закону України від 15.12.1993 р. № 3687-XII «Про охорону прав на винаходи і корисні моделі» й конкретизовані в Порядку надання Кабінетом Міністрів України дозволу на використання запатентованого винаходу (корисної моделі) чи зареєстрованої топографії інтегральної мікросхеми, затвердженому постановою КМУ від 14.01.2004 р. № 8.
ІІІ. ПІДТВЕРДЖЕННЯ ВІДПОВІДНОСТІ GMP
Із моменту набуття законом чинності для державної реєстрації препарату заявник разом з іншими документами повинен надавати засвідчену копію документа, що підтверджує відповідність умов виробництва вимогам до виробництва лікарських засобів в Україні. Функцію видачі такого документа буде покладено на Державну службу України з лікарських засобів, і вона здійснюватиметься в порядку, визначеному МОЗ.
Уже сьогодні виникає багато практичних питань щодо такого нововведення, зокрема, враховуючи міжнародні зобов’язання Державної служби України з лікарських засобів у зв’язку з її приєднанням до Міжнародної системи співробітництва фармацевтичних інспекцій (PIC/S). Це зумовлено тим, що у прийнятій редакції закону не вказана можливість подачі заявниками сертифікатів відповідності вимогам належної виробничої практики GMP, виданих навіть щодо виробництв на території країн — членів PIC/S відповідними інспекторатами.
Зазначимо, що змінений п. 3 Порядку державної реєстрації (перереєстрації) лікарських засобів, затверджений постановою КМУ № 376 (зміни набули чинності 21.11.2011 р.), передбачає, що перевірка відповідності виробництва ліків, що подаються на реєстрацію (перереєстрацію), вимогам належної виробничої практики проводиться під час експертизи реєстраційних матеріалів. У зв’язку з прийняттям закону очікується чергова зміна зазначеного порядку. Крім цього, слід також очікувати внесення змін до Порядку проведення сертифікації виробництва лікарських засобів, затвердженого наказом МОЗ України від 30.10.2002 р. № 391.
IV. ПІДТВЕРДЖЕННЯ ЧИННОСТІ ПАТЕНТУ, ПОВ’ЯЗАНОГО З ЛІКАРСЬКИМ ЗАСОБОМ
Для реєстрації захищених патентом ліків відтепер вимагається подача ще одного документа: окрім засвідченої копії патенту або ліцензії, якою дозволяється виробництво та продаж зареєстрованого лікарського засобу, також необхідно буде подавати документ, що підтверджує чинність патенту в Україні. Це може бути виписка з Державного реєстру патентів України на винаходи, відповідно до підпункту 4.1. п. 4 наказу Міністерства освіти і науки України від 12.04.2001 р. № 291.
партнер адвокатської фірми «ПАРИТЕТ», адвокат

Коментарі