 — Инна Борисовна, расскажите, пожалуйста, об особенностях законодательного обеспечения и организации деятельности регуляторного органа в сфере обращения лекарственных средств, препаратов крови и изделий медицинского назначения — BDA.
— Инна Борисовна, расскажите, пожалуйста, об особенностях законодательного обеспечения и организации деятельности регуляторного органа в сфере обращения лекарственных средств, препаратов крови и изделий медицинского назначения — BDA.И.Д.: История BDA началась с основания в 1904 г. химической лаборатории Директората защиты общественного здоровья. В дальнейшем лаборатория пережила множество преобразований. В 1992 г. на ее базе был создан Национальный институт лекарственных средств как специальный экспертный и контролирующий орган МЗ Республики Болгария для реализации государственной политики в сфере обращения лекарственных средств, национальный координатор и разработчик методологических подходов со статусом научной организации.
В 2000 г. было основано BDA как орган по контролю качества, эффективности и безопасности лекарственных средств (включая лицензирование производства препаратов, регистрацию аптечных учреждений; допуск на рынок лекарственных средств, изделий медицинского назначения и средств для диагностики in vitro, ведение соответствующих реестров).
В настоящее время в сфере обращения лекарственных средств в Республике Болгария действует ряд законов, в частности Закон о лекарственных средствах для человека (Закон за лекарствените продукти в хуманната медицина); Закон о крови, донорстве и переливании крови (Закон за кръвта, кръводаряването и кръвопреливането); Закон о медицинских изделиях (Закон за медицинските изделия).
МЗ Республики Болгария и BDA определены как две организации, формирующие и реализующие государственную политику страны в сфере обращения лекарственных средств и медицинских изделий. Основными функциями BDA в соответствии с законом являются:
- выдача разрешений на производство лекарственных средств;

- проведение химической и фармацевтической экспертизы качества лекарственных средств для допуска на рынок, ведение реестра клинических исследований, проводимых в стране, и клинических баз;
- регистрация аптечных учреждений;
- координация импорта и выдача разрешений на продажу лекарственных средств;
- выдача сертификатов лекарственных средств и сертификатов происхождения лекарственных средств;
- контроль за производством, оптовой и розничной торговлей лекарственными средствами, клиническими исследованиями и рекламой лекарственных средств;
- осуществление соответствующих лабораторных анализов при наличии сомнений относительно отклонения от показателей качества, эффективности и безопасности лекарственных средств, осуществление соответствующих мероприятий, предусмотренных в законодательстве;
- организация системы учета, анализа и обобщения информации о побочных реакциях, а также последствиях взаимодействия лекарственных средств, возникающих при их применении, принятие соответствующих мер;
- выполнение функции национального координатора и консультанта по вопросам, связанным с качеством, эффективностью и безопасностью лекарственных средств;
- осуществление консультационной, научной, информационной и издательской деятельности в сфере фармации;
- участие в деятельности международных органов, организаций и соглашениях в сфере обращения лекарственных средств, в которых Болгария выступает одной из сторон.
Как видим, деятельность BDA охватывает практически весь жизненный цикл лекарственных средств, препаратов крови и изделий медицинского назначения, начиная с клинических исследований, допуска на рынок и контроля качества, безопасности и эффективности в обращении. С целью предотвращения коррупционных правонарушений деятельность BDA не распространяется на вопросы ценообразования и реимбурсации.
В связи с тем, что Болгария является членом ЕС, BDA осуществляет постоянную гармонизацию национального законодательства с европейскими директивами. По информации А. Янкова, исполнительного директора BDA, с 1994 по 2007 г. осуществлялась адаптация национального законодательства к таковому ЕС. Но и сейчас работа не остановлена, поскольку на уровне ЕС нормативно-правовая база постоянно совершенствуется. Раз в полгода, Национальное собрание Болгарии вносит дополнительные изменения в вышеупомянутые законы, а Совет Министров и МЗ — в соответствующие подзаконные акты.
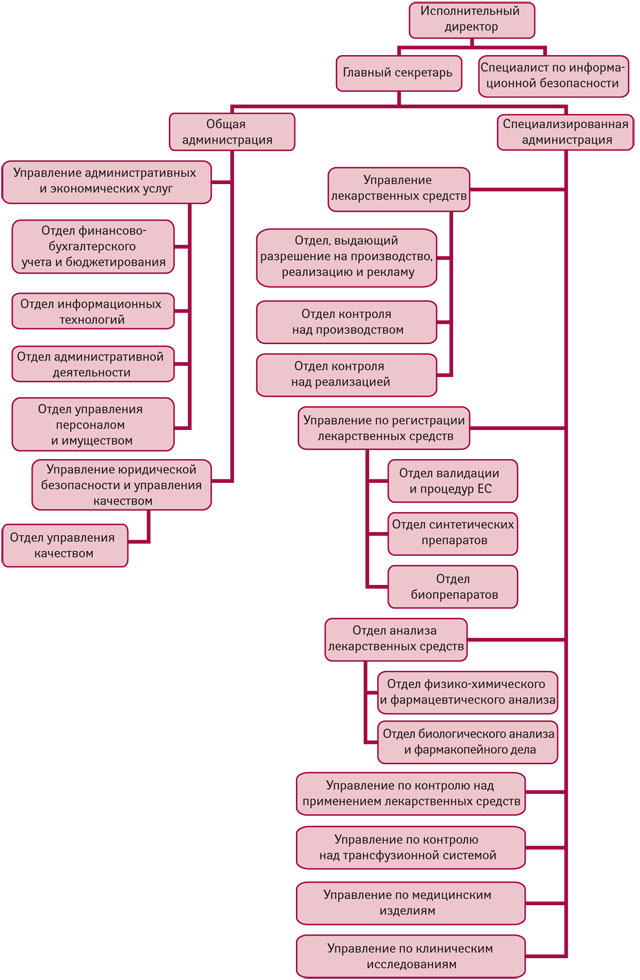
BDA подчинено непосредственно министру здравоохранения. Его исполнительный директор назначается на должность Советом Министров по представлению министра здравоохранения сроком на 5 лет, однако государственным служащим не является. В структуре BDA действует 9 департаментов. Штат — 187 специалистов, из которых только 18 — инспекторы, в частности 7 GMP-инспекторов, 6 — GDP-инспекторов, 5 — GCP-инспекторов (рисунок). GMP-инспекторы BDA не принимают участия в проведении инспектирования фармацевтических производств, находящихся в других странах. За все время была проведена лишь 1 такая проверка в Турции.
Если говорить о продолжающейся гармонизации законодательства Болгарии в сфере обращения лекарственных средств с нормативами ЕС, стоит отметить, что с 1 января 2013 г. в этой стране планируется внедрение сертификации активных фармацевтических ингредиентов (АФИ) на соответствие требованиям GMP. Но поскольку существует вероятность переголосования данной нормы в Европейском Парламенте, внедрение такой сертификации может быть перенесено на боле поздний срок.
В состав BDA входит 1 сертифицированная контрольно-аналитическая лаборатория, расположенная в Софии, в которую поступают образцы продукции со всей страны.
Примечательный факт: BDA не имеет территориальных подразделений, что также снижает вероятность возникновения коррупционных правонарушений.
С 2011 г. в BDA внедрены и сертифицированы Система менеджмента качества, Система информационной безопасности в соответствии с требованиями ISO 9001:2008 и ISO/IEC 27001:2006, что, в отличие от требований Европейского агентства по лекарственным средствам (European Medicines Agency — EMA), является обязательным требованием национального законодательства. В BDA реализована Система менеджмента качества в соответствии с ISO/IEC 17025:2006, что подтверждено Европейским директоратом по качеству лекарственных средств и медицинской помощи (European Directorate for the Quality of Medicines & Healthcare — ЕDQM). Кроме того, внедрена Система управления качеством в соответствии с требованиями ISO 9001:2009 (MC ISO 9001:2008). Лаборатория контроля качества лекарственных средств BDA является частью сети официальных лабораторий по контролю лекарственных средств стран — членов ЕС.
К проблемным вопросам деятельности BDA можно отнести ограниченные человеческие ресурсы (его штат составляет 187 человек, в то время как в других странах с аналогичной численностью населения (Словакия и Венгрия) штат регуляторного органа в сфере обращения лекарственных средств составляет около 280 человек), постоянные аудиты со стороны EDQM (8 аудитов в год), ЕМА, и других международных организаций, что существенно повышает нагрузку на работников, и, наконец, текучесть кадров — получив надлежащий уровень подготовки за государственный счет, специалисты переходят работать в коммерческие структуры с более высокой зарплатой.
В.Б.: Фармрынок Болгарии, население которой составляет около 6,5 млн человек, самый маленький среди странах ЕС — 1,2 млрд евро. 15% его объема — это госпитальный сегмент, 85% — розничный. На рынке доминируют генерические лекарственные средства.
В Болгарии осуществляют деятельность 44 производителя препаратов (в том числе производства транснациональных фармацевтических компаний), 12 импортеров лекарственных средств, 156 дистрибьюторов, 158 аптечных складов, 4000 аптек.
В структуре потребления лекарственных средств 21% занимаю препараты для терапии сердечно-сосудистых заболеваний; 13% — для лечения заболеваний нервной системы; 12% — лекарственные средства, влияющие на метаболизм и применяемые для лечения заболеваний эндокринной системы; 11% — для лечения респираторных заболеваний; 11% — противовоспалительные лекарственные средства; 11% — препараты, применяемые в онкологии; 21% — другие.
Государственное регулирование в фармацевтическом секторе осуществляют МЗ Болгарии и BDA. Импортерами, в основном, являются производители и дистрибьюторы лекарственных средств, при этом дистрибьютор имеет 2 лицензии (на импорт и на оптовую торговлю). Лицензия на импорт препаратов выдается заявителю в срок до 30 дней, при этом проводится предварительная проверка. Заявитель должен обеспечить наличие как минимум одного уполномоченного лица (требования к которому четко определены законодательством), лаборатории по контролю качества лекарственных средств, перечень лекарственных средств и АФИ, заверенные надлежащим образом копии лицензий производителей препаратов, договоры между импортером и производителями лекарственных средств и т.д. Проверка инструкции по применению лекарственного средства, информации на упаковке и т.д. находится в компетенции BDA.
Что касается регистрации лекарственных средств, то в случае, если речь идет о централизованной процедуре допуска препарата на рынки стран — членов ЕС, она обходится заявителю в 250–300 тыс. евро, если же на рынок Болгарии — национальная процедура допуска будет стоить заявителю в среднем 7,5 тыс. евро.
При лицензировании производства обязательным является его соответствие требованиям GMP. Лицензирование аптечных учреждения осуществляется в течение 30 календарных дней. Площадь аптеки должна составлять не менее 30 м2, аптечного склада — 100 м2. Обязательным для них является обеспечение доступа для лиц с ограниченными возможностями.
В Болгарии отсутствуют нормы или ограничения относительно пешеходной доступности аптек. В составе аптечной сети может быть не более 4 аптечных учреждений. Регистрационный сбор за открытие аптечного учреждения составляет 500 евро. Проверка соблюдения аптекой лицензионных условий проводится 1 раз в 3 года. Штраф за торговлю фальсифицированными и некачественными лекарственными средствами — 75 тыс. евро.
В рамках контроля качества препаратов, находящихся в обращении, BDA осуществляет отбор образцов таковых согласно годовому плану, порядок формирования которого предусмотрен стандартной операционной процедурой. При отрицательных результатах лабораторного контроля запрет на обращение лекарственного средства распространяется на территории всех стран ЕС.
Интересно, что в течение 2011 г. в Болгарии было отмечено 2 случая фальсификации лекарственных средства и 4 случая попадания на рынок некачественных препаратов.
Что касается системы фармаконадзора, то она полностью интегрирована в таковую ЕС. Все сообщения о побочных эффектах лекарственных средств размещаются на официальном сайте BDA. В течение 2011 г. в BDA поступило около 270 таких сообщений. Указанная информация вносится в базу данных EudraVigilance. До сих пор право на уведомление о побочных реакциях имеют только врачи (фармацевтические работники не являются частью системы контроля безопасности лекарственных средств). С сентября-октября 2012 г. в Болгарии вводится новая законодательная норма, в соответствии с которой возможность информирования BDA о побочных реакциях получат пациенты и провизоры. Причем такие сообщения они смогут направлять в форме документа, заполненного согласно соответствующему образцу? как на бумажном носителе, так и по e-mail.
И.Д.: Нормативно-правовые основы функционирования указанных систем государственного регулирования цен на лекарственные средства и реимбурсации определены Законом о лекарственных средствах для человека. Функция регулирования цен возложена на МЗ Болгарии. Совет Министров определяет состав Комиссии, порядок ее деятельности, а также порядок и критерии включения лекарственных средств в положительный список (куда входят препараты, подлежащие реимбурсации). Сегодня в состав Комиссии входят: 5 представителей МЗ, 5 — Национального страхового фонда (Национальная касса медицинского страхования, далее — НСФ), 1 представитель Болгарского союза врачей, 1 — Болгарского союза стоматологов. возглавляет Комиссию представитель Министерства финансов Болгарии. Форма работы Комиссии — еженедельные заседания.
НСФ ведет реестр, в котором размещается информация о каждом пациенте, его диагнозе, врачебных назначениях, лекарственных средствах, применяемых больным и т.д. Электронный реестр пациентов находится на этапе создания.
Источником формирования поступлений в НСФ являются взносы работодателей (90%) и работающих граждан (10%). Однако с целью солидарного распределения и повышения ответственности за состояние своего здоровья со стороны граждан парламент Болгарии рассматривает возможность увеличения с 2013 г. доли вкладов граждан в НСФ до 40% с последующим увеличением до 50%. Эта инициатива болгарского правительства является предметом серьезных политических дебатов.
Положительный список лекарственных средств, стоимость которых возмещается частично или полностью (на сегодня — около 2,5 тыс. позиций), состоит из 4 приложений:
- № 1 — Перечень лекарственных средств, стоимость которых возмещается НСФ;
- № 2 — Перечень лекарственных средств, которые могут закупаться государственными и коммунальными лечебными учреждениями по ценам, не выше установленных указанным перечнем;
- № 3 — Перечень лекарственных средств, которые могут закупаться МЗ для реализации национальных программ (централизованные бюджетные закупки);
- № 4 — Обобщенный (на основе 3 предыдущих) перечень лекарственных средств с соответствующими ценами.
В Болгарии действуют дифференцированные ставки возмещения стоимости лекарственных средств, входящих в положительный список — 25%, 50% и 100%. Они определяются на основе социальной значимости заболевания, например: препараты для лечения онкологической патологии и заболеваний нервной системы возмещаются на 100%; препараты для лечения сердечно-сосудистых заболеваний — на 50% и т.д. Каждая позиция лекарственного средства, стоимость которого возмещается, содержит специальное поле со ссылкой на код заболевания, в соответствии с Международной классификацией болезней (МКБ-10).
В зависимости от того, какой из указанных перечней рассматривается, определяется состав Комисии. Квоты на места между ее членами распределяются пропорционально, в соответствии с тем, какое из учреждений является самым крупным плательщиком средств по конкретному перечню. Так, например, при рассмотрении перечня № 1 квота на места в Комиссии распределяется следующим образом: 5 представителей НСФ; 2 — МЗ; 1 — Болгарского союза врачей/стоматологов, 1 — председательствующий (от Министерства финансов Болгарии);Перечень № 2 обсуждается Комиссией в полном составе. Всего существует 3 состава Комиссии.
Процедура включения лекарственного средства в положительный список включает 3 этапа.
На первом этапе заявитель подает заявление о включении препарата в положительный список с пакетом соответствующих документов по установленным формам, в частности: декларацию относительно правильности заполнения документов; информацию о потребности в лекарственном средств на основе данных «IMS Health»; регистрационное свидетельство на препарат; доверенность производителя/импортера на право осуществлять соответствующие действия; перечень стран, в которых препарат уже входит в положительный список; информацию относительно цен в этих странах и уровня реимбурсации; документ об уплате госпошлины и т.д. Указанные документы должны быть апостилированы или заверенны нотариально и в Министерстве иностранных дел Болгарии. Госпошлина о включении нового лекарственного средства в положительный список составляет 750 евро. В случае, если препарат уже включен в этот список, — 400 евро. Независимо от результата рассмотрения заявки госпошлина заявителю не возвращается;
Пакет документов, поданных заявителем, проходит юридическую (в юридическом департаменте МЗ), медицинскую (в профильном структурном подразделением МЗ) и экономическую (экспертами, привлекаемыми Комиссией на контрактной основе) экспертизы. Когда рассматривается инновационный препарат, или лекарственное средство, которое еще не включено в положительный список, МЗ осуществляет фармакоэкономическую экспертизу. Для ее осуществления профильное министерство привлекает независимых экспертов на контрактной основе.
Все эксперты, которые принимают участие в экспертизе представленных заявителем документов, подписывают декларацию о конфликте интересов. Стоимость экспертных услуг по оценке 1 лекарственного средства устанавливается приказом МЗ Болгарии и составляет 10 евро. Финансовым источником для оплаты экспертных услуг является госпошлина, уплачиваемая заявителем на этапе подачи документов.
Срок проведения указанных экспертиз составляет 60 календарных дней для нового лекарственного средства, или 40 — для уже включенного в положительный список. На данном этапе эксперт может приостановить процедуру экспертизы в срок до 30 календарных дней с целью уточнения отдельных позиций в документах, представленных заявителем. Указанные 30 дней не входят в сроки проведения экспертизы.
На втором этапе указанный пакет документов вместе с соответствующими экспертными заключениями подается на рассмотрение членам Комиссии. Срок их обработки не должен превышать 30 календарных дней (для новых лекарств). Таким образом, общий срок прохождения экспертиз и рассмотрения материалов членами Комиссии не должен превышать 90 календарных дней для препаратов, не включенных в положительный список, и 75 — для лекарственных средств, включенных в него.
На третьем этапе в рамках первого же заседания Комиссии проводится обсуждение целесообразности включения препарата в положительный список, и простым большинством голосов принимается решение о его включении/отказе во включении в положительный список. Решение подписывается председателем Комиссии и обнародуется, приобретая официальный статус.
В случае, если принимается решение об отказе во включении препарата в положительный список, его направляют на дополнительные клинические исследования и фармакоэкономический анализ.
В.Б.: Кроме 4 приложений-перечней, образующих положительный список, в системе государственного регулирования цен имеются 2 реестра:
- предельных цен на лекарственные средства, отпускаемые по рецепту;
- максимальных розничных цен на лекарственные средства, отпускаемые без рецепта, и максимальных розничных цен на препараты, отпускаемые по рецепту;
Реестр предельных цен на лекарственные средства, отпускаемые по рецепту, содержит такую информацию: международные непатентованные названия препаратов, включенных в положительный список; лекарственные формы; торговые названия препаратов конкретных производителей, стоимость которых не возмещается; развернутая цена, которая включает:
- цену производителя: EXW (заводская цена) + 20% НДС = общая цена производителя с НДС;
- цену дистрибьютора: EXW + 6% оптовой наценки = отпускная цена дистрибьютора (ОЦД) ОЦД + 20% НДС = отпускная цена дистрибьютора с НДС;
- цену аптеки: ОЦД + 18% розничной наценки = отпускная розничная цена (ОРЦ) ОРЦ + 20% НДС = розничная отпускная цена с НДС.
Реестр максимальных розничных цен на лекарственные средства, отпускаемые без рецепта и по рецепту, содержит такую информацию: международные непатентованные названия препаратов; торговые названия; лекарственные формы; названия владельцев регистрационных свидетельств; названия производителей; зарегистрированные максимальные цены производителей. Стоит обратить внимание на то, что указанная информация касается безрецептурных лекарственных средств и рецептурных препаратов, не включенных в положительный список.
Основным инструментом проверки объективности заявленной цены производителя являются внешние референтные цены на конкретную упаковку лекарственного средства конкретного производителя, размещаемые на официальных сайтах соответствующих национальных учреждений, и рассчитанные, исходя из особенностей налогообложения или разницы в наценках.
Болгарский перечень основных референтных стран включает: Румынию, Грецию, Португалию, Испанию, Францию, Эстонию, Литву и Латвию (8 стран). Базовые критерии отбора основных референтных стран: отсутствие плавающего валютного курса; сходство экономик (например Прибалтийские страны) или наличие низких цен на лекарственные средства (Франция), контроль цен производителей со стороны государства. Перечень 5 дополнительных референтных стран: Чехия, Словакия, Польша, Венгрия, Бельгия.
Если препарат отсутствует и в дополнительных референтных странах, рассматривается наличие препарата в Финляндии, Словении, Дании, Италии. Главным критерием выступает минимальная цена.
В случае отсутствия препарата на рынках дополнительных стран, по всему перечню референтных стран рассматривается цена лекарственного средства с сопоставим количеством единиц в упаковке (например упаковки 28/30 таблеток).
Если и последнее сравнение оказалось безрезультатным, принимается цена, заявленная производителем (его уполномоченным лицом).
В Болгарии действует система дифференцированных наценок:
- до 5 евро — оптовая наценка 10%, розничная — 22%;
- до 15 евро — оптовая наценка 9%, розничная — 20%;
- от 15,1 евро — оптовая наценка 8%, но не более 7,5 евро; розничная — 18%, но не более 15 евро;
Информация о ценах на лекарственные средства ежегодно публикуется в официальном издании (Государственная газета). Кроме того, она размещается на официальном сайте МЗ в свободном доступе.
Нынешняя система государственного регулирования цен в Болгарии формировалась с 2000 г. в течение 7 лет. С 2000 по 2003 г. государственное регулирование цен осуществлялось без положительного списка, цены определялись исключительно для государственных закупок. С 2003 г. начал формироваться положительный список, однако он не содержал информации относительно цен. До 2007 г. цены декларировались, но не проверялись государством, а с 2007 г. было введено 2 цены — цена лекарственного средства для положительного списка, на основе которого определяется уровень возмещения его стоимости, и максимальная цена препарата для розничной реализации.
Подводя итоги, хотелось бы обратить внимание на то, что в настоящее время BDA — единственный регуляторный орган, деятельность которого охватывает практически весь жизненный цикл лекарственных средств, препаратов крови и изделий медицинского назначения. Деятельность BDA и в целом реализация государственной политики в сфере обращения лекарственных средств в Болгарии осуществляется исключительно в соответствии с законодательством ЕС. Вопросы ценообразования на препараты и реимбурсации находятся вне компетенции BDA, что исключает возможность конфликтов интересов и коррупционных проявлений.
Государственная система регулирования цен на лекарственные средства в Болгарии формировалась на протяжении длительного периода и фактически 7 лет существовала без системы реимбурсации. Сегодня это простая, прозрачная и эффективная система формирования и регулирования цен на лекарственные средства, находящиеся в обращении. Она охватывает все звенья формирования цены, начиная с производителя, а использование такого инструментария, как внешние референтные цены по широкому перечню европейских стран и критерию минимальной цены делает невозможным формирование посреднической составляющей. Последствия этого очевидны как для государства, участников рынка, так и для пациентов.
Система реимбурсации в Болгарии в целом является обобщенной моделью систем реимбурсации, действующих в большинстве европейских стран и может быть использована в Украине в качестве прототипа. В то же время нельзя утверждать, что она окончательно сформировалась, поскольку в обществе не завершены дебаты относительно источников поступлений страховых взносов для НСФ и т.д. Это требует дополнительных исследований деятельности систем медицинского страхования других стран со стороны профильных научных учреждений.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим