 Ю. Подпружников рассказал присутствующим о системе обеспечения качества лекарственных средств на всех этапах их жизненного цикла и подробно остановился на состоянии внедрения надлежащих практик в Украине, в том числе GMP. Основная цель внедрения стандартов GXP — обеспечение населения качественными лекарственными средствами. Качество лекарственных средств, в глобальном смысле, это одновременное наличие ряда характеристик и показателей, обеспечивающих эффективность, безопасность и собственно качество.
Ю. Подпружников рассказал присутствующим о системе обеспечения качества лекарственных средств на всех этапах их жизненного цикла и подробно остановился на состоянии внедрения надлежащих практик в Украине, в том числе GMP. Основная цель внедрения стандартов GXP — обеспечение населения качественными лекарственными средствами. Качество лекарственных средств, в глобальном смысле, это одновременное наличие ряда характеристик и показателей, обеспечивающих эффективность, безопасность и собственно качество.
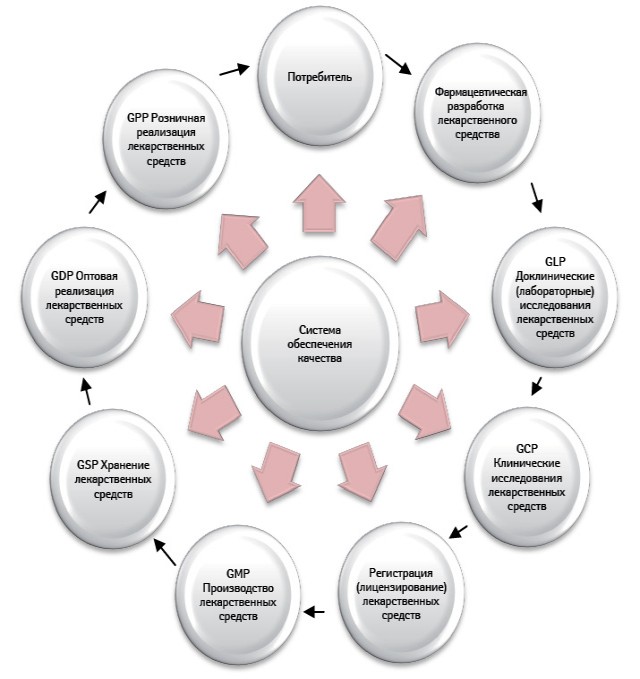
Жизненный цикл лекарственного средства
При создании препарата главным образом учитываются потребности пациента, врача и системы здравоохранения. Лекарственное средство может являться разработкой de novo или генерической копией препарата, срок патентной защиты которого истек. В 2005 г. Международной конференцией по гармонизации технических требований к регистрации лекарственных средств для человека (International Conference of Harmonization — ICH) был создан документ Q8 Pharmaceutical development (Фармацевтическая разработка), который содержит понятие жизненного цикла лекарственного средства и алгоритм его разработки. Фармацевтическая разработка — это комплексные экспериментальные исследования, в рамках которых осуществляется обоснование состава, этапов технологического процесса, условий производства для дальнейшего включения этой информации в регистрационное досье. Специальная экспертная комиссия анализирует этот документ и определяет, сможет ли конкретный кандидат в препараты после проведения доклинических и клинических исследований быть допущен на рынок. Таким образом, качество закладывается в лекарственное средство уже на этапе разработки.
Далее следуют доклинические исследования препаратов на моделях in vitro и in vivo с соблюдением правил надлежащей лабораторной практики (Good Laboratory Practice — GLP). GLP охватывает организационный процесс и условия, в которых проводятся доклинические исследования, связанные с определением профиля безопасности и экологическими аспектами. Благодаря этой системе результаты доклинических исследований признаются на международном уровне. Именно на этом этапе изучается безопасность препаратов и зависимость их эффективности от дозы. Доклинические исследования непосредственно входят в круг интересов биологов, поскольку в основном эксперименты проводятся на животных.
После успешных доклинических исследований подается заявка на проведение клинических исследований. На этом этапе жизненного цикла лекарственных средств создается протокол, после утверждения которого проводятся клинические исследования с участием пациентов (оригинальные препараты) и/или здоровых добровольцев (эквивалентность генерических препаратов).
Клинические исследования проводятся в соответствии с требованиями надлежащей клинической практики (Good Clinical Practice — GCP). GCP — международный этический и научный стандарт качества планирования и проведения клинических исследований лекарственных средств с участием людей, а также документального оформления и представления их результатов.
Далее следует лицензирование препаратов (в Украине — регистрация). Получение лицензии означает одобрение производства препарата в промышленном масштабе, его дальнейшей реализации и медицинского применения. Производство лекарственных средств контролируется специфической для фармацевтического производства системой качества — GMP. Принципиальным отличием стандартов GMP от системы качества, существовавшей в СССР, основной упор в которой делался на контроль качества готового продукта, является обеспечение качества на всех этапах производства — от закупки сырья, материалов и их контроля (через валидацию и тщательный мониторинг технологического процесса) до проверки качества конечного продукта и контроля первого этапа дистрибьюции.
Далее следует хранение и транспортировка, которые осуществляются согласно стандарту надлежащей практики хранения (Good Storage Practise — GSP), и могут быть реализованы как производителем, так и дистрибьютором.
Этап оптовой реализации лекарственных средств осуществляется в соответствии с надлежащей дистрибьюторской практикой (Good Distribution Practice — GDP). Основные требования GDP заключаются в соблюдении условий хранения, в том числе и в период транспортировки, исключении возможности контаминации, обеспечении доставки необходимых препаратов в медицинские и аптечные учреждения в течение определенного периода и т.д.
Непосредственно после оптовой реализации следует розничная, регламентируемая надлежащей аптечной или фармацевтической практикой (Good Pharmacy Practice — GPP). Эта система стандартов создана Международной фармацевтической федерацией (International Pharmaceutical Federation — FIP), и рекомендована ВОЗ к исполнению. В то же время в НФаУ был сформулирован специальный термин — «фармацевтическая опека», который подразумевает, что в аптечном учреждении осуществляются не столько продажа препаратов, сколько консультации и оказание помощи пациентам в их выборе.
Таким образом, стандарты GXP обеспечивают качество на всех этапах жизненного цикла лекарственного средства.
Ю. Подпружников также остановился на вопросах имплементации этих стандартов в Украине, а именно: адаптации документов, создании нормативно-правовой базы и компетентных организаций, обеспечивающих контроль их соблюдения.
Одним из наиболее важных аспектов развития отечественного фармацевтического сектора, по словам лектора, является создание Государственной Фармакопеи Украины (ГФУ) — сборника официальных документов, устанавливающих уровень требований к качеству и безопасности препаратов, которые государство гарантирует своим гражданам. При этом качество гарантируется обязательным соблюдением надлежащих практик. При создании ГФУ особое внимание уделялось ее соответствию Европейской Фармакопеи, поэтому большинство монографий априори гармонизированы с ней. Такая стратегия работы была обусловлена выбранным стратегическим курсом на гармонизацию именно с Европейской Фармакопеей. Первое издание ГФУ датируется 2001 г., в настоящее время выпущено 4 дополнения, ведется работа над вторым изданием.
Основные требования GMP
Непосредственно производство лекарственных средств начинается с получения сырья. Ю. Подпружников отметил, что в Украине не более 5% производителей лекарственных средств используют собственное сырье, остальные его закупают. Изготовление сырья должно соответствовать стандартам GMP, а контролировать это — обязанность производителя готовых лекарственных средств.
Необходимо, чтобы на фармацевтическом предприятии работало соответствующее количество квалифицированного персонала, прошедшего обучение GMP.
Следует также обеспечить административную независимость производственной части и отдела контроля качества с целью исключения конфликта интересов.
Производство должно осуществляться с использованием соответствующего оборудования в соответствующих помещениях.
Технологический процесс должен быть валидирован, а все его этапы следует осуществлять в соответствии с технической документацией. Допускаемые при производстве отклонения фиксируются, после чего дается оценка их значимости в контексте возможного влияния на качество препарата и здоровье пациента. На основании этого принимается решение об одобрении или запрете реализации серии продукции. В случае одобрения оговариваются дополнительные действия, которые необходимо предпринять для компенсации этого отклонения.
На этапе реализации лекарственных средств уполномоченной лицо, несущее ответственность за обеспечение качества в системе производства, в письменном виде дает разрешение на реализацию данной серии продукции, подтверждая тем самым, что она выпущена в полном соответствии с регистрационной документацией, в том числе и с требованиями GMP. Концепция уполномоченного лица очень важна, и она не ограничивается отпуском продукции со склада: производитель должен быть убежден в компетентности дистрибьютора, а также в том, что он может обеспечить надлежащие условия хранения лекарственных средств. В то же время, согласно стандартам GDP, дистрибьютор не может реализовать лекарственное средство другому дистрибьютору или аптечному учреждению до тех пор, пока не будет убежден в наличии у них необходимых условий для хранения, транспортировки и дальнейшей реализации этой продукции.
Ю. Подпружников подчеркнул, что после имплементации стандартов GMP в Лицензионные условия осуществления хозяйственной деятельности по производству лекарственных средств, оптовой, розничной торговле лекарственными средствами, с 2009 по 2011 гг. количество предприятий, имеющих соответствующие лицензии, уменьшилось на четверть, что, однако, не отразилось на объеме производства препаратов. Более того, отмечено увеличение объема производства, экспорта отечественных лекарственных средств, а также их доли на фармацевтическом рынке Украины в денежном выражении.
Отдельно лектор остановился на вопросе импорта лекарственных средств в Украину. Так, согласно постановлению КМУ от 08.08.2012 г. № 793, с 1 января 2013 г. препараты не могут быть ввезены на территорию нашей страны без подтверждения Государственной службой Украины по лекарственным средствам (далее — Гослекслужба) соответствия условий их производства требованиям GMP. Кроме того, согласно Закону Украины от 04.07.2012 г. № 5038-IV «О внесении изменений в некоторые законы Украины относительно лицензирования импорта лекарственных средств и определения термина «активный фармацевтический ингредиент» лицензирование импорта препаратов должно стать обязательным с 1 марта следующего года. По словам Ю. Подпружникова, около половины зарубежных предприятий, подающих заявления на сертификацию GMP, не соответствуют этому стандарту. Такое положение вещей свидетельствует о важности проведения сертификации, поскольку в случае ее отсутствия к реализации могут быть допущены препараты, несущие риск для здоровья пациентов.
Ю. Подпружников также напомнил о том, что в 2011 г. Гослекслужба присоединилась к Международной системе сотрудничества фармацевтических инспекций (Pharmaceutical Inspection Cooperation Scheme — PIC/S). Решение об этом было принято в 2010 г. PIC/S — международная система, объединяющая 43 организации на 5 континентах. Она призванна устранить препятствия в международной торговле лекарственными средствами за счет взаимного признания результатов инспектирования фармацевтических производств, проводимых национальными регуляторными органами.
Ю. Подпружников также акцентировал внимание присутствующих на нерешенных вопросах, касающихся имплементации требований надлежащих практик и системы обеспечения качества лекарственных средств в целом, среди них: необходимость увеличения количества монографий на готовые лекарственные средства в ГФУ; охват системой контроля в Украине стандартов GLP и GCP; доказательство терапевтической эквивалентности генерических препаратов. Кроме того, лектором была отмечена проблема подтверждения эквивалентности препаратов, используемых в доклинических и клинических исследованиях, и производимых в промышленных масштабах.
P.S.
Среди многочисленных определений термина «качество», одно из наиболее удачных звучит так: «Качество» — это совокупность характеристик объекта, относящихся к его способности удовлетворять установленные и предполагаемые потребности. В контексте препаратов — это диагностика, профилактика, лечение, изменение состояния и функций организма, то есть то, что от него ожидают получить пациенты и врачи. Необходимые свойства лекарственных средств достигаются при одновременном наличии 3 характеристик — эффективность, безопасность и качество. Причем в данном случае под качеством подразумевается более узкое понятие — а именно соответствие фармакопейной статье или другой нормативной документации.
Около 10 лет назад Ю. Подпружниковым и соавторами была сформулирована глобальная концепция обеспечения качества на всех этапах обращения лекарственного средства (схема). В рамках данной концепции во главе угла находятся не рыночные принципы существования лекарственных средств, как это сделано в документах ICH Q9 и Q10, а этапы, связанные с предназначением лекарственного средства — его нацеленностью на пациента и конечное применение в лечебном процессе. Это отличие является очень важным, поскольку характеризует жизненный цикл препарата начиная от его разработки, и заканчивая применением. В данной системе учтены соответствующие специфические стандарты, которые устанавливают требования к системе обеспечения качества, применяемой на каждом этапе жизненного цикла лекарственного средства. Система обеспечения качества должна быть встроена в каждый этап обращения и охватывать всю цепочку жизненного цикла препарата. При этом глобальная система обеспечения качества ориентирована именно на пациента.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим