|
 Как рассказал корреспонденту «Еженедельника АПТЕКА» Тарас Лясковский, заведующий отделом регистрации биопрепаратов Государственной службы лекарственных средств и изделий медицинского назначения МЗ Украины (далее — Государственная служба), понятия «биологические препараты», «иммунологические препараты» по терминологии и классификации ВОЗ и ЕС имеют существенные отличия от ЛС (химико-фармацевтических препаратов). Национальное законодательство о порядке регистрации медицинских иммунобиологических препаратов (МИБП) отличается от такового по регистрации химико-фармацевтических препаратов. Такая практика объективно обусловлена необходимостью изучения, проверки, контроля и пострегистрационного мониторинга специфических показателей МИБП (реактогенность, иммуногенность, клинико-эпидемиологическая эффективность, биологическая специфичность, биотехнологическая эффективность, биосовместимость, биоспецифичность, генетическая детерминированность эффективности) и условий их производства (соответствие требованиям надлежащих практик — производства, дистрибьюции, лабораторного контроля, клинического применения и т.д.) с целью обеспечения задекларированных государством эффективности и безопасности, и находится в полном соответствии с рекомендациями ВОЗ и директивами ЕС.
Как рассказал корреспонденту «Еженедельника АПТЕКА» Тарас Лясковский, заведующий отделом регистрации биопрепаратов Государственной службы лекарственных средств и изделий медицинского назначения МЗ Украины (далее — Государственная служба), понятия «биологические препараты», «иммунологические препараты» по терминологии и классификации ВОЗ и ЕС имеют существенные отличия от ЛС (химико-фармацевтических препаратов). Национальное законодательство о порядке регистрации медицинских иммунобиологических препаратов (МИБП) отличается от такового по регистрации химико-фармацевтических препаратов. Такая практика объективно обусловлена необходимостью изучения, проверки, контроля и пострегистрационного мониторинга специфических показателей МИБП (реактогенность, иммуногенность, клинико-эпидемиологическая эффективность, биологическая специфичность, биотехнологическая эффективность, биосовместимость, биоспецифичность, генетическая детерминированность эффективности) и условий их производства (соответствие требованиям надлежащих практик — производства, дистрибьюции, лабораторного контроля, клинического применения и т.д.) с целью обеспечения задекларированных государством эффективности и безопасности, и находится в полном соответствии с рекомендациями ВОЗ и директивами ЕС.
Сегодня законодательством Украины определены отдельные требования к процедуре регистрации и контролю качества биопрепаратов. Биопрепараты выделены в отдельную категорию ЛС и определяются термином «медицинские иммунобиологические препараты», объединившем «иммунологический лекарственный препарат» и «биологический лекарственный препарат». Таким образом, этот термин был образован путем объединения определений иммунологических и биологических лекарственных препаратов, которые приведены в различных документах ВОЗ и директивах Европейского парламента и Совета ЕС (Директива Европейского парламента и Совета ЕС 2001/83/ЕС, постановление Совета ЕС № 2303/93, WHO Technical Report Series № 822, 1992 и т.д.).
Позиция Государственной службы в аспекте регистрации аналогичных биопрепаратов очень четкая. Эти препараты не могут быть генериками и, соответственно, регистрироваться по сокращенной процедуре. Процедура регистрации биологических препаратов должна учитывать их биологические свойства и ни в коем случае не должна быть идентичной процедуре регистрации химико-фармацевтических препаратов
Определение медицинского иммунологического препарата приведено в Законе Украины «О защите населения от инфекционных заболеваний», постановлении КМУ от 15.01.1996 г. № 73 (с изменениями) «Положение о контроле за соответствием иммунобиологических препаратов, применяемых в медицинской практике, требованиям государственных и международных стандартов», приказе МЗ Украины от 28.06.2005 г. № 426 «Об утверждении Порядка проведения экспертизы регистрационных материалов на лекарственные препараты, которые подаются для регистрации (перерегистрации), а также экспертизы материалов о внесении изменений в регистрационные материалы на протяжении срока действия регистрационного свидетельства». Приведенные документы отличаются полнотой определения термина «МИБП». Государственной службой были внесены уточнения в толкование термина «медицинский иммунологический препарат» путем дополнения ст. 2 «Определение терминов» Порядка проведения государственной регистрации (перерегистрации) медицинских иммунобиологических препаратов в Украине, утвержденного приказом МЗ Украины от 06.12.2001 г. № 486, таким определением: «МИБП — лекарственные препараты, которые предназначены для использования в медицинской практике с целью лечения, специфической профилактики инфекционных паразитарных заболеваний и аллергических состояний, а также которые получают путем культивирования штаммов микроорганизмов и клеток эукариот, экстракции веществ из биологических тканей, включая ткани человека, животных и растений (аллергены), внедрения технологии рекомбинантной ДНК, гибридомной технологии, репродукции живых агентов в эмбрионах или животных. К МИБП относятся аллергены, антигены, вакцины (анатоксины), цитокины, иммуномодуляторы бактериального происхождения и полученные на основе органов и тканей, препараты, полученные из крови и плазмы крови человека, иммунные сыворотки, иммуноглобулины (включая моноклональные антитела), пробиотики, интерфероны, другие лекарственные препараты, предназначенные для использования в медицинской практике с целью лечения, специфической профилактики, диагностики состояния иммунитета (in vivo). МИБП могут быть изготовлены как готовые лекарственные формы, биологические агенты (действующие вещества), нефасованные иммунобиологические препараты и препараты в упаковке большой емкости (in bulk), стандартные образцы (международный образец, государственный (отраслевой) стандартный образец, стандартный образец предприятия). Новые МИБП — МИБП, которые впервые регистрируются в Украине и созданы с использованием новых биологических агентов (действующих веществ) или являются новой качественной или количественной комбинацией известных биологических агентов (действующих веществ)».
Для гармонизации регистрационных материалов между странами Международной конференции по гармонизации (ICH) в Евросоюзе принят рекомендованный ICH в 2000 г. международный формат регистрационного досье — Общий технический документ (Common technical document — CTD)
Нормативно-правовое закрепление функций за Государственной службой соответствует рекомендациям ВОЗ по функциям национального органа по контролю обеспечения качества биологических препаратов. Этими документами регламентируется участие Государственной службы в осуществлении контроля процессов разработки, лицензирования, производства, выпуска, дистрибьюции (транспортировки и хранения), введения (применения), мониторинга побочного и неспецифического действия МИБП.
Позиция Государственной службы в отношении регистрации аналогичных (подобных) биопрепаратов очень четкая. Эти препараты не могут быть генериками и, соответственно, регистрироваться по сокращенной процедуре. Процедура регистрации биологических препаратов должна учитывать их биологические свойства (реактогенность, иммуногенность, клинико-эпидемиологическую эффективность, биологическую специфичность, биотехнологическую специфичность, биотехнологическую эффективность, биосовместимость, биоспецифичность, генетическую детерминированность эффективности, соответствие надлежащим практикам — производства, дистрибьюции, лабораторного контроля, клинического применения и т.д.) и ни в коем случае не должна быть идентичной процедуре регистрации химико-фармацевтических препаратов.
 Как отметил Владимир Карасик, заместитель главы Государственной службы лекарственных средств и изделий медицинского назначения МЗ Украины, в нашей стране существует единый орган, осуществляющий допуск на рынок всех ЛС, — МЗ Украины. В разработке нормативных актов и организации деятельности органа ориентируются прежде всего на соответствующий опыт, накопленный в странах Европейского Союза. Взят курс на расширение прав и возможностей заявителей, устранение возможностей двойного толкования. Это позволит обеспечить прозрачность и четкость действия механизма государственной регистрации.
Как отметил Владимир Карасик, заместитель главы Государственной службы лекарственных средств и изделий медицинского назначения МЗ Украины, в нашей стране существует единый орган, осуществляющий допуск на рынок всех ЛС, — МЗ Украины. В разработке нормативных актов и организации деятельности органа ориентируются прежде всего на соответствующий опыт, накопленный в странах Европейского Союза. Взят курс на расширение прав и возможностей заявителей, устранение возможностей двойного толкования. Это позволит обеспечить прозрачность и четкость действия механизма государственной регистрации.
Таким образом, необходимо понимать, что же представляет собой система регистрации и контроля за препаратами в Европе, какие организации занимаются этими вопросами, какие есть варианты процедур и т.д.
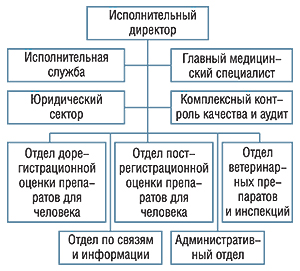
В Европейский Союз входят 27 государств, каждое из которых имеет свою систему государственных служб по регистрации и контролю за ЛС. Кроме того, существует интегральная система, работающая для всех стран Евросоюза, а также трех стран, входящих в Европейское экономическое пространство и Европейскую ассоциацию свободной торговли, — Норвегии, Лихтенштейна и Исландии. Она, безусловно, обладает существенно бóльшим организационным и научным потенциалом, чем системы каждого отдельного государства. Основным органом этой системы, занимающейся вопросами регистрации и контроля за препаратами, является Европейское агентство по лекарственным средствам (European Medicines Agency — ЕМЕА). Структурно оно представляет собой децентрализованный орган, штаб-квартира которого расположена в Лондоне. Главной задачей агентства является защита и содействие здравоохранению и ветеринарии путем оценки и контроля за ЛС для людей и применения в ветеринарии. ЕМЕА несет ответственность за научную оценку заявок, подающихся для европейской регистрации препаратов по централизованной процедуре. Агентство имеет сложную структуру и состоит из управленческого звена и нескольких отделов. Отдел дорегистрационной оценки ЛС для человека (Pre-authorization evaluation of medicines for human use) проводит оценку их качества, эффективности и безопасности, а также предоставляет научные консультации по поводу препаратов-сирот (orphan drugs, ЛС для лечения редких заболеваний). Отдел пострегистрационной оценки ЛС для человека (Post-authorization evaluation of medicines for human use) занимается регуляторными вопросами и оказывает организационную поддержку, отвечает за фармаконадзор и предоставление медицинской информации. Отдел ветеринарных ЛС и инспекций (Veterinary medicines and inspections) отвечает за препараты, предназначенные для применения в ветеринарии. Существуют также отделы по связям и информации (Communications and networking), административный и юридический, по контролю качества и аудитам. Схема организации ЕМЕА представлена на рис. 1, ее можно также найти на официальном сайте агентства ().
Кроме централизованной процедуры регистрации, ЕМЕА занимается мониторингом безопасности ЛС с помощью системы фармаконадзора. Также агентство играет немаловажную роль в организации и проведении исследований в фармацевтическом секторе. ЕМЕА предоставляет научные консультации и предлагает помощь в подготовке протоколов компаниям, разрабатывающим новые препараты. Агентство подготавливает и публикует руководства по требованиям к проверке качества, безопасности и эффективности. Отдельными подразделениями ЕМЕА являются комитеты. Комитет по лекарственным средствам для человека (Committee for Medicinal Products for Human Use — CHMP) отвечает за подготовку позиции агентства по поводу любого вопроса, имеющего отношение к оценке препаратов для человека. В состав комитета входит по одному представителю из каждой страны-участницы.
|
Система рецензирования материалов, принятая в ЕМЕА, работает посредством сети европейских экспертов, состоящей из более чем 4000 специалистов, которые рекомендованы ЕМЕА 40 национальными регуляторными органами 30 стран-участниц. Эти эксперты являются членами научных комитетов, рабочих групп ЕМЕА или частью команд по научной оценке. Список экспертов ЕМЕА, а также названия и адреса делегировавших их регуляторных органов доступны в интернете. Заявитель имеет возможность запросить отдельно более подробную информацию об экспертах и круге их научных интересов. Члены научных комитетов ЕМЕА и европейские эксперты не должны иметь прямого финансового или других интересов в фармацевтической индустрии, которые могли бы повлиять на их беспристрастность. Они должны каждый год подавать декларацию о своих финансовых интересах, а также обо всех косвенных интересах, которые могут иметь отношение к фармацевтической промышленности. Такие требования разработаны для того, чтобы гарантировать, что эксперты действуют независимо и в интересах общества.
В разработке нормативных актов и организации деятельности МЗ Украины ориентируется прежде всего на соответствующий опыт, накопленный в странах Европейского Союза. Взят курс на расширение прав и возможностей заявителей, устранение возможностей двойного толкования
Основные документы Евросоюза, регулирующие регистрацию и контроль за ЛС для человека и применения в ветеринарии, разделены на 10 томов. Тома с первого по третий, а также десятый, относятся к препаратам для человека, с пятого по восьмой — к препаратам, применяемым в ветеринарии, а четвертый (Надлежащая производственная практика) и девятый (Фармаконадзор) являются общими для всех. В первый том сведены директивы и постановления (регламенты). Они служат основой для создания законодательных баз стран — членов ЕС. К ним относится основополагающая Директива 2001/83/EC, Директива 2001/20/EC по проведению клинических исследований, Постановление EC/726/2004, описывающее структуру и функции ЕМЕА, и многие другие документы. Список законов можно найти на официальном сайте Совета Европы по адресу: ec.europa.eu/enterprise/pharmaceuticals/eudralex/homev1.htm. Во втором томе находятся пояснительные записки (Notice to Applicant). Эти документы разрабатываются Еврокомиссией в сотрудничестве с компетентными органами стран — членов ЕС, а также ЕМЕА. Впервые они были опубликованы в 1986 г. и регулярно обновляются. К третьему тому относятся руководства. Они разработаны CHMP для того, чтобы помочь заявителю подготовить заявку на регистрацию ЛС в соответствии с требованиями агентства. Созданы отдельные руководства по обеспечению качества, биотехнологическим препаратам, доклинической разработке, клинической эффективности и безопасности и т.д.
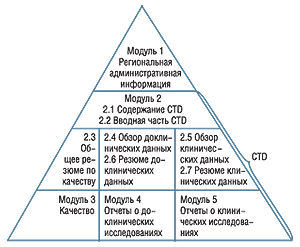
Для гармонизации регистрационных материалов между странами Международной конференции по гармонизации (ICH) в Евросоюзе принят рекомендованный ICH в 2000 г. международный формат регистрационного досье — Общий технический документ (Common technical document — CTD). CTD регламентирует только структуру досье, но ни в коем случае не его содержание. Структура CTD отражает логическую последовательность всех этапов разработки ЛС (рис. 2), более подробно о CTD можно прочитать в пояснительной записке «Представление и формат досье» (Notice to Applicants, vol 2B «Presentation and format of dossier», июнь 2006).
|
В этой пояснительной записке содержатся также основные требования к полноте досье на ЛС, в части данных по эффективности и безопасности препарата приведены перекрестные ссылки на различные руководства ICH (ICH E1а, Е4, Е5, Е7, Е10, Е11).
В соответствии с европейским законодательством существует несколько вариантов регистрации ЛС. Централизованная процедура предполагает анализ досье экспертами ЕМЕА и при положительном решении — разрешение на маркетинг во всех странах-участницах. Процедура взаимного признания предполагает получение в нескольких странах — членах ЕС разрешений на маркетинг препарата, который уже одобрен одним из национальных регуляторных органов. При этом национальное разрешение на маркетинг должно быть признано другими странами-членами. В отличие от нее, децентрализованная процедура может применяться, когда разрешение на маркетинг ни в одной из стран еще не было получено. В таком случае идентичные заявки подают в регуляторные органы всех стран, где планируется получение разрешения на маркетинг, с последующим коллективным принятием решения. По централизованной процедуре могут регистрироваться ЛС, содержащие новые незарегистрированные в Евросоюзе действующие вещества или представляющие собой существенную научную или техническую инновацию. Приложением к Постановлению EC/726/2004 четко определяются также группы препаратов, которые должны подвергаться централизованной процедуре регистрации в обязательном порядке. В этот список входят ЛС (содержащие новое действующее вещество) для лечения СПИДа, онкологических и нейродегенеративных заболеваний, сахарного диабета, а также иммунных нарушений и вирусных заболеваний (с мая 2008 г.), препараты-сироты, а также целая группа биотехнологических препаратов, то есть ЛС, произведенных с помощью какого-либо биотехнологического метода (технологии рекомбинантной ДНК, контролированной экспрессией генов, гибридомным методом или методом моноклональных антител).
За несколько месяцев до подачи заявки по процедуре центральной регистрации ЛС обычно проводятся консультации представителей производителя с сотрудниками ЕМЕА. После того как заявитель подал досье на ЛС в CHMP, комитет рассматривает документы в течение максимум 210 дней (оговорен также и минимум — 80 дней). По истечении этого срока комитет предоставляет свое мнение в Европейскую комиссию. Комиссия формирует предварительное решение в течение 15 дней, отсылает его на рассмотрение странам-участницам и заявителю. Еще через 15 дней комиссия формулирует окончательное решение.
Таким образом очевидно, что, несмотря на свою сложность и многогранность, система регистрации ЛС, принятая в странах Евросоюза, достаточно прозрачна, понятна и выполнима всеми участниками этого процесса. Разработано большое количество сопроводительной документации, поддерживающей законодательную базу, существует система консультаций на любом этапе регистрационного процесса, прилагаются усилия для своевременного усовершенствования законов и рекомендаций (так, например, Евросоюз первым создал руководства по особенностям подготовки регистрационных материалов аналогичных биопрепаратов). Интересно, что под одной юрисдикцией объединены не только все виды ЛС для применения у людей (как химического, так и биологического происхождения), но и препараты для применения в ветеринарии, включая специальные средства, стимулирующие рост животных. Такое объединение всех функций на фоне структурной сложности органа и жестких правил, исключающих какую бы то ни было заинтересованность экспертов, дает возможность европейской системе выполнять свою основную задачу — защищать здоровье и благополучие граждан путем жесткого контроля за ЛС, получившими разрешение на маркетинг. n
Продолжение следует…
Елена Руднева
Фото Елены Старостенко
|

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим