Документ набув чинності 6 січня 2017 р.
у зв’язку з опублікуванням у газеті
«Офіційний вісник України» № 2 від 06.01.2017 р.
МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ
НАКАЗ
від 26.09.2016 № 996
Зареєстровано в Міністерстві
юстиції України
19 грудня 2016 р.
за № 1649/29779
Про внесення змін до деяких наказів Міністерства охорони здоров’я України
Відповідно до Основ законодавства України про охорону здоров’я, Законів України «Про лікарські засоби», «Про захист населення від інфекційних хвороб», «Про забезпечення санітарного та епідемічного благополуччя населення», «Про Загальнодержавну програму адаптації законодавства України до законодавства Європейського Союзу», Порядку державної реєстрації (перереєстрації) лікарських засобів і Розмірів збору за державну реєстрацію (перереєстрацію) лікарських засобів, затверджених постановою Кабінету Міністрів України від 26 травня 2005 року № 376, пункту 8 Положення про Міністерство охорони здоров’я України, затвердженого постановою Кабінету Міністрів України від 25 березня 2015 року № 267, НАКАЗУЮ:
1. У заголовку та тексті наказу Міністерства охорони здоров’я України від 27 грудня 2006 року № 898 «Про затвердження Порядку здійснення нагляду за побічними реакціями лікарських засобів, дозволених до медичного застосування», зареєстрованого в Міністерстві юстиції України 29 січня 2007 року за № 73/13340, слова «Порядок здійснення нагляду за побічними реакціями лікарських засобів, дозволених до медичного застосування» у всіх відмінках замінити словами «Порядок здійснення фармаконагляду» у відповідних відмінках.
2. Внести зміни до Порядку здійснення нагляду за побічними реакціями лікарських засобів, дозволених до медичного застосування, затвердженого наказом Міністерства охорони здоров’я України від 27 грудня 2006 року № 898, зареєстрованого в Міністерстві юстиції України 29 січня 2007 року за № 73/13340, виклавши його у новій редакції, що додається.
3. Підпункти 1.4–1.6 пункту 1 наказу Міністерства охорони здоров’я України від 16 вересня 2011 року № 595 «Про порядок проведення профілактичних щеплень в Україні та контроль якості й обігу медичних імунобіологічних препаратів», зареєстрованого в Міністерстві юстиції України 10 жовтня 2011 року за № 1159/19897, виключити.
У зв’язку з цим підпункти 1.7, 1.8 вважати відповідно підпунктами 1.4, 1.5.
4. В абзаці другому пункту 5 Календаря профілактичних щеплень в Україні, затвердженого наказом Міністерства охорони здоров’я України від 16 вересня 2011 року № 595, зареєстрованого в Міністерстві юстиції України 10 жовтня 2011 року за № 1159/19897, слова «, анатоксину» виключити.
5. В абзаці шостому пункту 5.2 розділу 5 Правил зберігання та проведення контролю якості лікарських засобів у лікувально-профілактичних закладах, затверджених наказом Міністерства охорони здоров’я України від 16 грудня 2003 року № 584, зареєстрованих у Міністерстві юстиції України 03 березня 2004 року за № 275/8874, слова «, та побічні реакції або загибель людей при застосуванні серії(й) лікарських засобів» виключити.
6. Підпункт 3.2.5 пункту 3.2 розділу ІІІ Порядку встановлення заборони (тимчасової заборони) та поновлення обігу лікарських засобів на території України, затвердженого наказом Міністерства охорони здоров’я України від 22 листопада 2011 року № 809, зареєстрованого в Міністерстві юстиції України 30 січня 2012 року за № 126/20439, викласти у такій редакції:
«3.2.5 негативні висновки щодо якості зразків серії або серій підозрюваного у спричиненні смерті, непередбаченої побічної реакції та/або відсутності ефективності лікарського засобу за наявності причинно-наслідкового зв’язку на підставі надходження повідомлень від МОЗ України та/або територіальних органів Державної служби України з лікарських засобів та контролю за наркотиками;».
7. Затвердити Положення про центральну і регіональні групи оперативного реагування на несприятливі події після імунізації/туберкулінодіагностики, що додається.
8. Визнати такими, що втратили чинність:
1) наказ Міністерства охорони здоров’я України від 15 червня 2007 року № 325 «Про затвердження Показників якості імунобіологічних препаратів (вакцин та анатоксинів)», зареєстрований у Міністерстві юстиції України 06 липня 2007 року за № 773/14040;
2) наказ Міністерства охорони здоров’я України від 24 липня 2009 року № 531 «Про затвердження Порядку проведення моніторингу безпеки та ефективності лікарських засобів у стаціонарах закладів охорони здоров’я», зареєстрований у Міністерстві юстиції України 17 серпня 2009 року за № 774/16790.
9. Управлінню фармацевтичної діяльності та якості фармацевтичної продукції забезпечити подання цього наказу на державну реєстрацію до Міністерства юстиції України в установленому порядку.
10. Контроль за виконанням цього наказу залишаю за собою.
11. Цей наказ набирає чинності з дня його офіційного опублікування.
| В.о. Міністра |
У. Супрун |
ЗАТВЕРДЖЕНО
Наказ Міністерства охорони
здоров’я України
27.12.2006 № 898
(у редакції наказу
Міністерства охорони
здоров’я України
26.09.2016 № 996)
Зареєстровано в Міністерстві
юстиції України
19 грудня 2016 р.
за № 1649/29779
ПОРЯДОК
здійснення фармаконагляду
І. Загальні положення
1. Цей Порядок розроблено відповідно до Основ законодавства України про охорону здоров’я, Законів України «Про лікарські засоби», «Про захист населення від інфекційних хвороб», «Про забезпечення санітарного та епідемічного благополуччя населення», «Про Загальнодержавну програму адаптації законодавства України до законодавства Європейського Союзу», Порядку державної реєстрації (перереєстрації) лікарських засобів і Розмірів збору за державну реєстрацію (перереєстрацію) лікарських засобів, затверджених постановою Кабінету Міністрів України від 26 травня 2005 року № 376, положень Директиви Європейського Парламенту та Ради ЄС № 2001/83, Регламенту Європейського Парламенту та Ради ЄС № 726/2004, що встановлюють основні правила та вимоги щодо здійснення фармаконагляду.
2. У цьому Порядку терміни вживаються у таких значеннях:
вакцинація (щеплення, активна/пасивна імунізація) — створення штучного імунітету у людини до певних інфекційних хвороб шляхом введення вакцини чи імуноглобуліну;
відсутність ефективності лікарського засобу — відсутність сприятливої діагностичної, лікувальної чи профілактичної дії лікарського засобу щодо встановлення характеру захворювання, його перебігу, тривалості або корекції стану чи фізіологічних функцій організму людини відповідно до показань до застосування, зазначених в інструкції для медичного застосування;
групові несприятливі події після імунізації — два або більше випадків несприятливих подій після імунізації, що мають подібні клінічні прояви, пов’язані за часом, місцем проведення імунізації/туберкулінодіагностики та типом введеної вакцини, туберкуліну;
групові побічні реакції — два або більше випадків побічних реакцій, пов’язаних із застосуванням лікарського засобу, вакцини та туберкуліну, що мають подібні клінічні прояви, пов’язані за часом, місцезнаходженням закладу охорони здоров’я та/або серією лікарського засобу, вакцини, туберкуліну;
ефективність вакцин — зниження відсотка керованих інфекційних захворювань у групі щеплених осіб порівняно з групою нещеплених осіб;
ефективність лікарського засобу — сприятлива діагностична, лікувальна чи профілактична дія лікарського засобу щодо характеру захворювання, його перебігу, тривалості або корекції стану чи фізіологічних функцій організму людини відповідно до показань до застосування, зазначених в інструкції для медичного застосування;
загальний звіт за картами епідрозслідування про зареєстровані випадки захворювання на інфекційні хвороби, що керуються засобами специфічної імунопрофілактики у щеплених, — звіт про всі зареєстровані випадки захворювання на інфекційні хвороби, що керуються засобами специфічної імунопрофілактики у щеплених, складений на підставі даних карт епідрозслідування про випадки захворювання на інфекційні хвороби, що керуються засобами специфічної імунопрофілактики у щеплених;
зафіксована побічна реакція лікарського засобу, вакцини, туберкуліну — побічна реакція, характер або тяжкість проявів якої відповідає наявній інформації, що міститься в основній інформації з безпеки заявника лікарського засобу, вакцини, туберкуліну;
зведені дані про випадки побічних реакцій після застосування вакцин, туберкуліну — звіт, що узагальнює інформацію про побічні реакції після застосування вакцин, туберкуліну згідно з переліком клінічних проявів побічних реакцій після застосування вакцин, туберкуліну та/або їх описом, що міститься в інструкціях для медичного застосування вакцин, туберкуліну, за звітний період;
звіт про випадки побічних реакцій лікарських засобів, вакцини, туберкуліну, та/або відсутності ефективності лікарських засобів, та/або несприятливих подій після імунізації/туберкулінодіагностики у закладах охорони здоров’я — щорічний звіт про всі випадки побічних реакцій лікарських засобів, вакцини, туберкуліну, та/або відсутності ефективності лікарських засобів, та/або несприятливих подій після імунізації/туберкулінодіагностики, який складають та подають усі заклади охорони здоров’я незалежно від форм власності, структурні підрозділи з питань охорони здоров’я Автономної Республіки Крим, обласних, Київської та Севастопольської міських державних адміністрацій;
звіт про післяреєстраційне дослідження з безпеки та ефективності лікарського засобу, вакцини, туберкуліну — надані в письмовій формі результати післяреєстраційного дослідження з безпеки та ефективності лікарського засобу, вакцини, туберкуліну та їх аналіз;
імуногенність вакцини — здатність вакцини утворювати гуморальний (визначені рівні антитіл у відсотках) та/або клітинно-опосередкований імунітет. Цей показник за даними клінічних досліджень має бути більше 90% (крім вакцин для профілактики грипу); для комбінованих вакцин кожен з компонентів повинен відповідати цьому показнику;
інформація, що ідентифікує випадок побічної реакції лікарського засобу, вакцини, туберкуліну, та/або відсутності ефективності лікарського засобу, та/або несприятливої події після імунізації/туберкулінодіагностики, — відомості про джерело отримання інформації, підозрюваний лікарський засіб, вакцину, туберкулін, пацієнта, опис побічної реакції/зазначення інформації про відсутність ефективності/опис несприятливої події після імунізації/туберкулінодіагностики;
інша важлива медична оцінка — випадок побічної реакції, та/або відсутності ефективності, що не становить безпосередньої загрози для життя пацієнта або не призводить до смерті чи госпіталізації, але піддає пацієнта небезпеці або потребує втручання для запобігання прояву побічної реакції, та/або відсутності ефективності, що розвинулась;
карта епідрозслідування — форма, згідно з якою відповідальна особа районного чи обласного структурного підрозділу з питань охорони здоров’я надає інформацію про випадок захворювання на інфекційні хвороби, що керуються засобами специфічної імунопрофілактики у щеплених;
карта-повідомлення про побічну реакцію лікарського засобу, вакцини, туберкуліну, та/або відсутність ефективності лікарського засобу, та/або несприятливу подію після імунізації/туберкулінодіагностики — форма, за якою лікарі, провізори, фельдшери, акушери, фармацевти, медичні сестри усіх закладів охорони здоров’я незалежно від форм власності повідомляють про будь-які випадки побічних реакцій лікарських засобів, вакцини, туберкуліну, відсутності ефективності лікарських засобів та несприятливих подій після імунізації/туберкулінодіагностики;
комбіновані вакцини — вакцини, призначені для захисту від декількох інфекційних хвороб, що можуть бути спричинені різними штамами, різними мікроорганізмами чи серотипами мікроорганізмів;
користь — сукупність ступенів позитивного впливу лікарського засобу, вакцини та туберкуліну на зменшення тяжкості перебігу або зниження інтенсивності проявів симптомів захворювання, інтенсивність позитивної фармакологічної реакції на введення лікарського засобу, вакцини, туберкуліну та її тривалість;
майстер-файл системи фармаконагляду — документ, що містить опис системи фармаконагляду, яка використовується заявником щодо одного або декількох лікарських засобів, вакцин, туберкуліну;
мета-аналіз — метод отримання інформації, у тому числі про побічні реакції лікарських засобів, вакцин, туберкулін, в якому використовується статистичний аналіз для інтеграції даних декількох незалежних досліджень для моніторингу лікарських засобів, вакцин, туберкуліну і побічних реакцій, зокрема тих, що виникають через тривалий період часу. При цьому враховується уся інформація про пацієнта з різних джерел (заклади охорони здоров’я, де він лікувався, пологовий будинок, виписані рецепти тощо), накопичена протягом усього його життя, що є підґрунтям для створення досьє пацієнта та наступного аналізу;
міжнародна дата народження лікарського засобу, вакцини, туберкуліну — дата видачі заявнику першого дозволу на продаж лікарського засобу, вакцини, туберкуліну у будь-якій країні світу;
моніторинг рецептів — метод отримання інформації про побічні реакції лікарських засобів, вакцин, заснований на обліку призначень лікарського засобу, вакцини, коли за встановлений період часу визначено кількість зареєстрованих побічних реакцій і кількість пацієнтів, які застосовували лікарський засіб, вакцину, що дає змогу виявити взаємозв’язок між побічною реакцією і застосуванням лікарського засобу, вакцини;
моніторинг стаціонару(ів) — метод отримання інформації про побічні реакції лікарського засобу, вакцини, що дає змогу визначити частоту побічних реакцій та виявити особливості взаємодії лікарських засобів, вакцин, у пацієнтів одного чи декількох стаціонарів, коли протягом певного періоду часу під контролем знаходяться усі пацієнти стаціонару(ів), враховуються всі лікарські засоби, вакцини, що призначаються, й усі побічні реакції, що виникають;
неефективність вакцинації — визначається на основі клінічних проявів інфекційної хвороби, що лабораторно підтверджено відсутністю захисних маркерів від цієї хвороби. Первинна неефективність вакцинації може бути наслідком недосягнення запланованого ефекту від щеплення (відсутність сероконверсії або серопротекції), вторинна — вроджених та/або набутих дефектів імунної системи або неналежного введення призначеної вакцини;
незафіксована побічна реакція лікарського засобу, вакцини, туберкуліну — побічна реакція, характер або тяжкість проявів якої не відповідає наявній інформації, що міститься в основній інформації з безпеки лікарського засобу, вакцини, туберкуліну заявника. До таких побічних реакцій належать ті, які за характером, тяжкістю проявів, специфічністю або наслідками не відповідають інформації, що міститься в основній інформації з безпеки лікарського засобу, вакцини, туберкуліну заявника, включаючи реакції, властиві певній фармакологічній групі лікарських засобів, вакцин, туберкуліну, що не виникали при застосуванні лікарського засобу, вакцини, туберкуліну;
непередбачена побічна реакція — побічна реакція, характер або тяжкість проявів якої не узгоджуються з наявною інформацією про лікарський засіб, вакцину, туберкулін в інструкції для медичного застосування/короткій характеристиці лікарського засобу, вакцини, туберкуліну;
несерйозна побічна реакція — будь-яка побічна реакція, що не призводить до смерті, не становить загрози для життя, не вимагає госпіталізації або збільшення терміну госпіталізації, не викликає стійкої або значної непрацездатності чи інвалідності та вроджених аномалій чи вад розвитку та не має іншої важливої медичної оцінки;
несприятлива подія після імунізації/туберкулінодіагностики — будь-яка несприятлива з медичної точки зору подія, що спостерігається після імунізації/туберкулінодіагностики та необов’язково має причинно-наслідковий зв’язок з використанням вакцини та/або туберкуліну. Несприятливою подією може бути будь-яка несприятлива або ненавмисна ознака, відхилення у результатах лабораторних досліджень, симптоми захворювання або захворювання;
основна інформація з безпеки заявника — документ, складений заявником, що містить усю відповідну інформацію з безпеки, яка є складовою переліку основних даних заявника. Основна інформація з безпеки заявника використовується при складанні звітності для визначення, зафіксовано чи ні побічну реакцію в переліку основних даних заявника. Дані основної інформації з безпеки заявника не використовуються для визначення, чи є побічна реакція передбаченою чи непередбаченою, для подання повідомлення про випадок побічної реакції (Company Core Safety Information (CCSI));
первинні документи — вихідні документи, дані і записи (наприклад, історії хвороби, амбулаторні карти, лабораторні записи, службові записки, щоденники досліджуваних або опитувальники, журнали видачі лікарських засобів, роздруківки приладів, верифіковані та засвідчені копії або розшифровки фонограм, мікрофіші, фотографічні негативи, мікроплівки або магнітні носії, рентгенівські знімки, адміністративні документи, записи, що зберігаються в аптеці, лабораторії та у відділенні інструментальної діагностики закладів охорони здоров’я) тощо;
передбачена побічна реакція — побічна реакція, характер або тяжкість проявів якої узгоджуються з наявною інформацією про лікарський засіб, вакцину, туберкулін в інструкції для медичного застосування зареєстрованого лікарського засобу/короткій характеристиці лікарського засобу, вакцини, туберкуліну;
перелік основних даних заявника — документ, складений заявником, що містить інформацію про лікарський засіб, вакцину, туберкулін щодо безпеки, пропонованих показань до застосування, сили дії, особливостей застосування, фармакологічних властивостей тощо (Company Core Data Sheet (ССDS));
період після застосування вакцини, туберкуліну — проміжок часу після проведеної імунізації/туберкулінодіагностики, що коливається у межах від першої доби до 24 місяців та залежить від типу вакцини, туберкуліну і для переважної більшості з них становить 30 діб;
підозрюваний(а) лікарський засіб, вакцина, туберкулін — лікарський засіб, вакцина, туберкулін, при призначенні якого (якої) існує причинно-наслідковий зв’язок між клінічними проявами будь-якої побічної реакції, та/або відсутністю ефективності, та/або несприятливою подією після імунізації/ туберкулінодіагностики та його (її) застосуванням;
післяреєстраційне дослідження з безпеки та ефективності лікарського засобу, вакцини, туберкуліну — будь-яке післяреєстраційне дослідження з безпеки та ефективності дозволеного до медичного застосування лікарського засобу, вакцини, туберкуліну, що проводиться з метою визначення, характеристики чи оцінки загрози безпеці, підтвердження профілю безпеки лікарського засобу, вакцини, туберкуліну та/або оцінки ефективності заходів з управління ризиками;
післяреєстраційне неінтервенційне дослідження з безпеки та ефективності лікарського засобу, вакцини, туберкуліну — вид післяреєстраційного дослідження з безпеки та ефективності лікарських засобів, вакцин, туберкуліну, в якому лікарські засоби, вакцини, туберкулін призначаються відповідно до інструкції для медичного застосування лікарського засобу, вакцини, туберкуліну. Залучення пацієнта до групи з визначеним методом лікування в протоколі дослідження заздалегідь не передбачено, а призначення лікарського засобу, вакцини, туберкуліну диктується сучасною практикою та не залежить від рішення про залучення пацієнта до дослідження. При проведенні такого дослідження не застосовують додаткових діагностичних або моніторингових процедур щодо пацієнтів, а для аналізу зібраних даних використовують епідеміологічні методи;
післяреєстраційне неінтервенційне дослідження з безпеки та ефективності лікарського засобу, вакцини, туберкуліну (випадок-контроль) — вид післяреєстраційного дослідження з безпеки та ефективності лікарського засобу, вакцини, туберкуліну, що проводиться на двох групах пацієнтів, в одній з яких присутні конкретні ятрогенні захворювання чи побічні реакції, а в іншій немає подібних захворювань чи побічних реакцій, з метою виявлення факторів ризику розвитку ятрогенних захворювань та побічних реакцій;
післяреєстраційне неінтервенційне когортне дослідження з безпеки та ефективності лікарського засобу, вакцини, туберкуліну — вид післяреєстраційного дослідження з безпеки та ефективності лікарського засобу, вакцини, туберкуліну, при проведенні якого протягом певного часу ведеться спостереження за двома підібраними великими групами хворих, одна з яких отримує досліджуваний препарат, а інша — не отримує, з метою виявлення побічних реакцій, факторів ризику виникнення побічних реакцій тощо;
план управління ризиками — детальний опис системи управління ризиками;
побічна реакція — будь-яка ненавмисна і шкідлива реакція на лікарський засіб; будь-яка ненавмисна і шкідлива реакція на вакцину, туберкулін, якщо вона спричинена чи прискорена активним компонентом (одним з інших компонентів) або пов’язана з порушеннями, що виникають у процесі виробництва вакцини, туберкуліну, включаючи пристрій для введення, що надається виробником;
причинно-наслідковий зв’язок між клінічними проявами будь-якої побічної реакції/несприятливої події після імунізації/туберкулінодіагностики та застосуванням лікарського засобу, вакцини, туберкуліну — ступінь, який визначається прийнятним методом (якісна методика Всесвітньої організації охорони здоров’я, шкала Наранжо, бінарний метод тощо) за певними критеріями та вказує на взаємопов’язаність/взаємозв’язок побічної реакції/несприятливої події після імунізації/туберкулінодіагностики, що спостерігається, із застосуванням лікарського засобу, вакцини, туберкуліну;
протокол післяреєстраційного дослідження з безпеки та ефективності лікарського засобу, вакцини, туберкуліну — документ, що містить опис, завдання, методологію, процедури, статистичні аспекти та організацію післяреєстраційного дослідження з безпеки та ефективності лікарського засобу, вакцини, туберкуліну, а також (за необхідності) раніше отримані дані щодо досліджуваного лікарського засобу, вакцини, туберкуліну та обґрунтування цього дослідження;
профіль безпеки — сукупність показників застосування лікарського засобу, вакцини, туберкуліну, що дають змогу визначити співвідношення користь/ризик лікарського засобу, вакцини, туберкуліну;
регулярно оновлюваний звіт з безпеки лікарського засобу, вакцини, туберкуліну — письмовий звіт, що містить регулярно оновлювану інформацію з безпеки лікарського засобу, вакцини, туберкуліну;
ризик, пов’язаний із застосуванням лікарського засобу, вакцини, туберкуліну, — будь-який ризик, пов’язаний з якістю, безпекою чи ефективністю лікарського засобу, вакцини, туберкуліну, що стосується здоров’я пацієнтів або громадського здоров’я, чи будь-який ризик небажаних ефектів на довкілля;
розподіл випадків побічних реакцій лікарського засобу, вакцини, туберкуліну за частотою їх виникнення:
понад 10% — дуже часті;
1 — 10% — часті;
0,1 — 1% — нечасті;
0,01 — 0,1% — поодинокі;
менше 0,01% — рідкісні;
серйозна побічна реакція — будь-яка побічна реакція, що призводить до смерті, становить загрозу для життя, вимагає госпіталізації або збільшення строку госпіталізації, викликає стійку або значну непрацездатність чи інвалідність, або є вродженою аномалією чи вадою розвитку, або має іншу важливу медичну оцінку;
сероконверсія — продукування або збільшення концентрації антитіл, що розглядається як перехід від серонегативної до серопозитивної реакції або як клінічно значиме збільшення заданого рівня антитіл, що демонструє імуногенність вакцини;
серопротекція — титр антитіл, що захищає від визначеної(их) інфекції(й);
сигнал — інформація, що походить з одного або декількох джерел (у тому числі спостережень і досліджень), яка свідчить про виявлений новий потенційний зв’язок або новий аспект відомого зв’язку між лікарським засобом, вакциною, туберкуліном і явищем або сукупністю взаємопов’язаних явищ, як несприятливих, так і сприятливих, і яка вважається достатньо достовірною, щоб обґрунтувати її перевірку;
система управління ризиками — комплекс процесів та заходів із фармаконагляду, спрямованих на виявлення, характеристику, запобігання або мінімізацію ризиків, пов’язаних із застосуванням лікарського засобу, вакцини, туберкуліну, що включає оцінку їх ефективності;
система фармаконагляду — система, що використовується державою та заявником для здійснення фармаконагляду з метою моніторингу безпеки й ефективності лікарських засобів, вакцин, туберкуліну і визначення будь-яких змін співвідношення користь/ризик;
співвідношення користь/ризик лікарського засобу, вакцини, туберкуліну — оцінка позитивних терапевтичних ефектів лікарського засобу, вакцини, туберкуліну щодо будь-яких ризиків, пов’язаних з якістю, безпекою чи ефективністю лікарського засобу, вакцини, туберкуліну, що стосуються здоров’я пацієнтів чи громадського здоров’я;
узагальнюючий звіт — письмовий звіт, що узагальнює інформацію з безпеки лікарського засобу, вакцини, туберкуліну, яка міститься у двох або більше регулярних звітах з безпеки лікарського засобу, вакцини, туберкуліну;
фармаконагляд — процес, пов’язаний із виявленням, збором, оцінкою, вивченням та запобіганням виникненню побічних реакцій, несприятливих подій після імунізації/туберкулінодіагностики та будь-яких інших питань, пов’язаних з безпекою та ефективністю застосування лікарських засобів, вакцин, туберкуліну;
частота випадків побічних реакцій лікарського засобу, вакцини, туберкуліну — співвідношення кількості пацієнтів за певний проміжок часу, у яких виникла побічна реакція при застосуванні лікарського засобу, вакцини, туберкуліну, до кількості пацієнтів за цей самий проміжок часу, які застосовували лікарський засіб, вакцину, туберкулін, виражене у відсотках.
3. Інші терміни в цьому Порядку вживаються у значеннях, визначених в Основах законодавства України про охорону здоров’я, Законах України «Про лікарські засоби», «Про захист населення від інфекційних хвороб», «Про забезпечення санітарного та епідемічного благополуччя населення» та інших нормативно-правових актах у сфері охорони здоров’я.
Обробка персональних даних під час здійснення фармаконагляду здійснюється відповідно до вимог Закону України «Про захист персональних даних».
ІІ. Засади здійснення фармаконагляду
1. Здійснення фармаконагляду в Україні забезпечується шляхом застосування міжнародних стандартів, виконання правил і вимог, встановлених цим Порядком, та передбачає створення і функціонування систем фармаконагляду.
2. Система фармаконагляду створюється у системі охорони здоров’я на загальнодержавному рівні та у заявників лікарських засобів, вакцин, туберкуліну.
3. Система фармаконагляду у системі охорони здоров’я використовується для:
1) збору інформації про ризики лікарських засобів, вакцин, туберкуліну щодо здоров’я пацієнтів чи громадського здоров’я, зокрема для збору інформації про побічні реакції лікарських засобів, вакцин, туберкуліну, відсутність ефективності лікарських засобів, несприятливі події після імунізації/туберкулінодіагностики (далі — НППІ) (класифікація несприятливих подій після імунізації/туберкулінодіагностики наведена у додатку 1 до цього Порядку) та про будь-які інші питання, пов’язані з безпекою та ефективністю, застосування лікарських засобів, вакцин, туберкуліну;
2) обґрунтованої оцінки усієї інформації про ризики лікарських засобів, вакцин, туберкуліну щодо впливу на здоров’я пацієнтів чи громадське здоров’я;
3) розробки заходів для запобігання чи мінімізації ризиків, пов’язаних із застосуванням лікарських засобів, вакцин, туберкуліну;
4) застосування регуляторних заходів впливу щодо дії реєстраційного посвідчення на лікарський засіб, вакцину, туберкулін у разі необхідності.
4. Для здійснення фармаконагляду Міністерство охорони здоров’я України:
1) залучає медичних працівників, заявників, пацієнтів та/або їх законних представників тощо;
2) встановлює порядок дій керівників структурних підрозділів з питань охорони здоров’я Автономної Республіки Крим, обласних, Київської та Севастопольської міських державних адміністрацій (далі — структурні підрозділи з питань охорони здоров’я), керівників усіх закладів охорони здоров’я незалежно від форм власності (далі — заклади охорони здоров’я), лікарів, провізорів, фельдшерів, акушерів, фармацевтів, медичних сестер (далі — медичні працівники), а також правила, вимоги до заявників лікарських засобів, вакцин, туберкуліну, та їх зобов’язання, викладені у цьому Порядку;
3) регулює взаємовідносини між структурами, що мають відношення до процесу регулювання обігу лікарських засобів, вакцин, туберкуліну.
5. Фармаконагляд здійснює державне підприємство «Державний експертний центр Міністерства охорони здоров’я України» (далі — Центр) відповідно до вимог законодавства.
У сфері охорони здоров’я фармаконагляд здійснюється на локальному, адміністративно-територіальному та центральному рівнях, а у фармацевтичній галузі — заявниками.
6. Центр для виконання покладених на нього повноважень щодо фармаконагляду:
1) здійснює заходи щодо оптимізації подання медичними працівниками карт-повідомлень про побічні реакції лікарських засобів, вакцин, туберкуліну, та/або відсутність ефективності лікарських засобів, та/або НППІ (далі — карта-повідомлення) та інформації щодо інших питань, пов’язаних з безпекою та ефективністю застосування лікарських засобів, вакцин, туберкуліну, до Центру, у тому числі шляхом залучення до цього процесу представників Центру з питань фармаконагляду в адміністративно-територіальних одиницях;
2) сприяє поданню пацієнтами та/або їх законними представниками повідомлень про побічні реакції лікарських засобів, вакцин, туберкуліну, та/або відсутність ефективності лікарських засобів, та/або НППІ та про будь-які інші питання, пов’язані з безпекою та ефективністю застосування лікарських засобів, вакцин, туберкуліну, усіма доступними способами;
3) здійснює необхідні заходи для отримання точних даних, що піддаються перевірці, для оцінки карт-повідомлень про побічні реакції лікарських засобів, вакцин, туберкуліну, та/або відсутність ефективності лікарського засобу, та/або НППІ та про будь-які інші питання, пов’язані з безпекою та ефективністю застосування лікарських засобів, вакцин, туберкуліну;
4) інформує громадськість про важливі дані щодо безпеки та ефективності застосування лікарських засобів, вакцин, туберкуліну усіма доступними способами;
5) проводить аудит систем фармаконагляду заявників;
6) інформує Міністерство охорони здоров’я про заявників, які не виконують правила, вимоги та зобов’язання, викладені у цьому Порядку.
7. Заявник створює та керує системою (системами) фармаконагляду.
8. Заявник під час здійснення фармаконагляду повинен:
1) мати у штаті (постійно і безперервно) уповноважену особу, відповідальну за фармаконагляд (далі — УОВФ);
2) створити, підтримувати і надавати на вимогу Центру майстер-файл системи фармаконагляду (далі — МФСФ);
3) керувати системою управління ризиками для лікарського засобу, вакцини, туберкуліну (за необхідності);
4) здійснювати моніторинг результатів заходів з мінімізації ризиків, що містяться в плані управління ризиками, та тих, що є умовою видачі реєстраційного посвідчення;
5) регулярно оновлювати систему управління ризиками та проводити моніторинг даних з фармаконагляду для виявлення нових ризиків, змін відомих ризиків та змін співвідношення користь/ризик лікарських засобів, вакцин, туберкуліну;
6) регулярно проводити аудит своєї(їх) системи (систем) фармаконагляду.
9. Кожна система фармаконагляду заявника може мати лише одну УОВФ. Якщо УОВФ не проживає в Україні, на території України призначається єдина контактна особа, відповідальна за фармаконагляд (далі — КОВФ), яка проживає і працює в Україні та підзвітна УОВФ. КОВФ повинна мати відповідний документ, що підтверджує її повноваження.
10. Заявник надає до Центру інформацію про УОВФ, КОВФ, а саме: прізвище, ім’я, по батькові, контактні дані, документ (копія диплома) про наявність медичної або фармацевтичної освіти та документ, що підтверджує повноваження УОВФ, КОВФ.
ІІІ. Отримання та обмін інформацією з безпеки та ефективності лікарських засобів, вакцин, туберкуліну
1. Інформація з безпеки та ефективності лікарських засобів, вакцин, туберкуліну надходить до Центру від:
1) медичних працівників;
2) юридичних та фізичних осіб, які здійснюють господарську діяльність з медичної практики;
3) закладів охорони здоров’я;
4) заявників;
5) пацієнтів та/або їх законних представників за формою карти-повідомлення для надання пацієнтом та/або його законним представником інформації про побічну реакцію лікарського засобу, вакцини, туберкуліну, та/або відсутність ефективності лікарського засобу, та/або несприятливу подію після імунізації/туберкулінодіагностики, наведеною у додатку 2 до цього Порядку;
6) Державної служби України з лікарських засобів та контролю за наркотиками та її територіальних органів;
7) представників Центру з питань фармаконагляду в адміністративно-територіальних одиницях;
8) Всесвітньої організації охорони здоров’я (далі — ВООЗ), EMA (Європейське медичне агентство), FDA (Агентство з контролю за лікарськими засобами та харчовими продуктами США), MHRA (Агентство з регулювання обігу лікарських засобів і виробів медичного призначення Великобританії), Health Canada (Міністерство охорони здоров’я Канади), TGA (Агентство з контролю за лікарськими засобами та виробами медичного призначення Австралії), Swissmedic (Агентство з лікарських засобів Швейцарії), PMDA (Агентство з контролю за лікарськими засобами та виробами медичного призначення Японії) та інших міжнародних організацій і агентств;
9) офіційних інформаційних джерел та періодичних видань;
10) інших джерел.
2. Центр надає інформацію з безпеки та ефективності лікарських засобів, вакцин, туберкуліну:
1) Державній службі України з лікарських засобів та контролю за наркотиками (у паперовому та/або електронному вигляді):
копії отриманих карт-повідомлень про непередбачені побічні реакції, побічні реакції, що призвели до смерті пацієнта, про групові побічні реакції та/або відсутність ефективності лікарських засобів (за винятком вакцин, туберкуліну) за наявності причинно-наслідкового зв’язку між ними та застосуванням лікарського засобу (за винятком вакцин, туберкуліну) — не пізніше 48 годин з дня отримання Центром інформації, що підтверджує наявність причинно-наслідкового зв’язку між ними та застосуванням лікарського засобу (за винятком вакцин, туберкуліну);
копії отриманих карт-повідомлень про групові побічні реакції та/або серйозні побічні реакції, пов’язані з порушеннями, що виникають у процесі виробництва вакцини, туберкуліну, включаючи пристрій для введення, що надається виробником вакцини, туберкуліну, за наявності причинно-наслідкового зв’язку між ними та застосуванням вакцини, туберкуліну — не пізніше 48 годин з дня отримання Центром інформації, що підтверджує наявність причинно-наслідкового зв’язку між ними та застосуванням вакцини, туберкуліну.
Якщо строк подання інформації припадає на вихідний або святковий день, інформація надається у перший після нього робочий день;
2) заявнику (стосовно лікарських засобів, вакцин, туберкуліну, які він представляє на фармацевтичному ринку України):
про випадки непередбачених побічних реакцій, побічних реакцій, що призвели до смерті пацієнта, групових побічних реакцій та/або відсутності ефективності лікарських засобів (за винятком вакцин, туберкуліну) за наявності причинно-наслідкового зв’язку між ними та застосуванням лікарського засобу (за винятком вакцин, туберкуліну) — не пізніше 48 годин з дня отримання Центром інформації, що підтверджує наявність причинно-наслідкового зв’язку між ними та застосуванням лікарського засобу (за винятком вакцин, туберкуліну);
про випадки групових побічних реакцій та/або серйозних побічних реакцій, пов’язаних з порушеннями, що виникають у процесі виробництва вакцин, туберкуліну, включаючи пристрій для введення, що надається виробником вакцин, туберкуліну, за наявності причинно-наслідкового зв’язку між ними та застосуванням вакцин, туберкуліну — не пізніше 48 годин з дня отримання Центром інформації, що підтверджує наявність причинно-наслідкового зв’язку між ними та застосуванням вакцин, туберкуліну;
про випадки побічних реакцій лікарських засобів, вакцин, туберкуліну, та/або відсутності ефективності лікарського засобу, та/або НППІ, інформація про які надійшла до Центру протягом певного періоду, — на його вимогу.
Якщо строк подання інформації припадає на вихідний або святковий день, інформація надається у перший після нього робочий день;
3) Міністерству охорони здоров’я України:
на вимогу;
щороку у вигляді звіту — до 01 березня наступного року. У разі якщо 01 березня припадає на вихідний або святковий день, звіт подається у перший після нього робочий день;
щороку у вигляді звіту про зареєстровані випадки захворювання на інфекційні хвороби, що керуються засобами специфічної імунопрофілактики у щеплених, — до 20 березня наступного року. У разі якщо 20 березня припадає на вихідний або святковий день, звіт подається у перший після нього робочий день;
щокварталу у вигляді звіту щодо зведених даних про випадки побічних реакцій після застосування вакцин, туберкуліну — до 30 числа наступного за звітним місяця. У разі якщо 30 число наступного за звітним місяця припадає на вихідний або святковий день, звіт подається у перший після нього робочий день;
копії (у паперовому та/або електронному вигляді) отриманих карт-повідомлень про непередбачені побічні реакції, побічні реакції, що призвели до смерті пацієнта, про групові побічні реакції та/або відсутність ефективності лікарських засобів (за винятком вакцин, туберкуліну) за наявності причинно-наслідкового зв’язку між ними та застосуванням лікарського засобу (за винятком вакцин, туберкуліну) — не пізніше 48 годин з дня отримання Центром інформації, що підтверджує наявність причинно-наслідкового зв’язку між ними та застосуванням лікарського засобу (за винятком вакцин, туберкуліну);
копії (у паперовому та/або електронному вигляді) отриманих карт-повідомлень про групові побічні реакції та/або серйозні побічні реакції, пов’язані з порушеннями, що виникають у процесі виробництва вакцини, туберкуліну, включаючи пристрій для введення, що надається виробником вакцини, туберкуліну, за наявності причинно-наслідкового зв’язку між ними та застосуванням вакцини, туберкуліну та копії протоколів розслідування серйозних та/або групових НППІ при застосуванні вакцин, туберкуліну та встановлення причинно-наслідкового зв’язку між серйозними та/або груповими НППІ й застосуванням вакцин, туберкуліну (далі — протокол розслідування НППІ) за формою, наведеною у додатку до Положення про центральну і регіональні групи оперативного реагування на несприятливі події після імунізації/туберкулінодіагностики, затвердженого наказом Міністерства охорони здоров’я України від 26 вересня 2016 року № 996, — не пізніше 48 годин з дня отримання Центром інформації, що підтверджує наявність причинно-наслідкового зв’язку між ними та застосуванням вакцини, туберкуліну;
копії (у паперовому та/або електронному вигляді) отриманих карт-повідомлень про НППІ, що пов’язані з програмною помилкою імунізації, туберкулінодіагностики при застосуванні вакцини, туберкуліну, за наявності інформації згідно з протоколом розслідування НППІ — не пізніше 48 годин з дня отримання Центром інформації, що підтверджує наявність причинно-наслідкового зв’язку між ними та застосуванням вакцини, туберкуліну;
копії (у паперовому та/або електронному вигляді) отриманих карт-повідомлень про НППІ (летальний випадок), що зареєстрована(ий) протягом 30 діб після імунізації, туберкулінодіагностики, — не пізніше 48 годин з дня отримання Центром карти-повідомлення.
Якщо строк подання інформації припадає на вихідний або святковий день, інформація надається у перший після нього робочий день;
4) Центральній групі оперативного реагування:
копії (у паперовому та/або електронному вигляді) отриманих карт-повідомлень про НППІ, що містять інформацію про клінічні прояви, що не зазначені в інструкції для медичного застосування або переліку клінічних проявів побічних реакцій після застосування вакцин, туберкуліну (далі — перелік клінічних проявів) (додаткок 3) та строках розвитку клінічних проявів побічних реакцій після застосування вакцин, туберкуліну (далі — строки розвитку клінічних проявів) (додаток 4), карт-повідомлень, що стали підставою для формування сигналів, — не пізніше 48 годин з дня отримання Центром інформації, що підтверджує наявність причинно-наслідкового зв’язку між такими НППІ та застосуванням серії (серій), вакцини (вакцин), туберкуліну;
копії (у паперовому та/або електронному вигляді) отриманих карт-повідомлень про НППІ (летальний випадок), що зареєстрована(ий) протягом 30 діб після імунізації/туберкулінодіагностики, — не пізніше 48 годин з дня отримання Центром карти-повідомлення;
копії (у паперовому та/або електронному вигляді) отриманих карт-повідомлень про НППІ, що пов’язані з програмною помилкою імунізації/туберкулінодіагностики при застосуванні вакцини, туберкуліну, за наявності інформації згідно з протоколом розслідування НППІ — не пізніше 48 годин з дня отримання Центром інформації, що підтверджує наявність причинно-наслідкового зв’язку між ними та застосуванням вакцини, туберкуліну.
Якщо строк подання інформації припадає на вихідний або святковий день, інформація надається у перший після нього робочий день;
5) ВООЗ;
6) на вимогу фізичних та юридичних осіб незалежно від форм власності у передбачених законодавством випадках.
3. Державна служба України з лікарських засобів та контролю за наркотиками надає Центру копії (у паперовому та/або електронному вигляді) усіх отриманих карт-повідомлень (включаючи НППІ та інформацію про летальний випадок) незалежно від джерела їх надходження — не пізніше 48 годин з дня їх отримання. У разі якщо цей строк припадає на вихідний або святковий день, інформація надається у перший після нього робочий день.
4. Центр аналізує інформацію, надану Державною службою України з лікарських засобів та контролю за наркотиками відповідно до пункту 3 цього розділу, та надає результати цього аналізу Державній службі України з лікарських засобів та контролю за наркотиками не пізніше 48 годин з дня отримання такої інформації. У разі якщо цей строк припадає на вихідний або святковий день, інформація надається у перший після нього робочий день.
5. Територіальні органи Державної служби України з лікарських засобів та контролю за наркотиками надають представникам Центру з питань фармаконагляду в адміністративно-територіальних одиницях та Державній службі України з лікарських засобів та контролю за наркотиками копії (у паперовому та/або електронному вигляді) усіх отриманих карт-повідомлень — не пізніше 48 годин з дня їх отримання. У разі якщо цей строк припадає на вихідний або святковий день, інформація надається у перший після нього робочий день.
6. Представники Центру з питань фармаконагляду в адміністративно-територіальних одиницях надають Центру карти-повідомлення та/або їх копії (у паперовому та/або електронному вигляді):
про випадки побічних реакцій, що призвели до смерті пацієнта, та/або відсутності ефективності лікарського засобу — не пізніше 48 годин з дня їх отримання;
про усі інші випадки побічних реакцій — не пізніше 15 днів з дня їх отримання.
У разі якщо цей строк припадає на вихідний або святковий день, інформація надається у перший після нього робочий день.
7. Центр надає до структурних підрозділів з питань охорони здоров’я копії (у паперовому та/або електронному вигляді) отриманих карт-повідомлень про побічні реакції та/або відсутність ефективності лікарського засобу, що призвели до смерті пацієнта, — не пізніше 48 годин з дня їх отримання. У разі якщо цей строк припадає на вихідний або святковий день, інформація надається у перший після нього робочий день.
8. Структурні підрозділи з питань охорони здоров’я при отриманні карт-повідомлень або їх копій (у паперовому та/або електронному вигляді) про побічні реакції та/або відсутність ефективності лікарського засобу, що призвели до смерті пацієнта, надають цю інформацію до відповідної клініко-експертної комісії, що проводить клініко-експертну оцінку якості надання медичної допомоги та медичного обслуговування щодо випадків побічних реакцій та/або відсутності ефективності лікарського засобу, що призвели до смерті пацієнта, — не пізніше 48 годин з дня отримання такої інформації. У разі якщо цей строк припадає на вихідний або святковий день, інформація надається у перший після нього робочий день.
9. Клініко-експертна оцінка якості надання медичної допомоги та медичного обслуговування щодо випадків побічних реакцій та/або відсутності ефективності лікарського засобу, що призвели до смерті пацієнта, здійснюється клініко-експертною комісією із залученням представників Центру з питань фармаконагляду із відповідної адміністративно-територіальної одиниці та інших фахівців за згодою.
10. За результатами роботи клініко-експертної комісії складаються протокол та висновок клініко-експертної комісії щодо випадків побічних реакцій та/або відсутності ефективності лікарського засобу, що призвели до смерті пацієнта, які надаються до Міністерства охорони здоров’я України, Центру та Державної служби України з лікарських засобів та контролю за наркотиками не пізніше 24 годин з дня їх складання. У разі якщо цей строк припадає на вихідний або святковий день, інформація надається у перший після нього робочий день.
ІV. Порядок дій керівників структурних підрозділів з питань охорони здоров’я, керівників закладів охорони здоров’я та медичних працівників щодо здійснення фармаконагляду
1. Керівники структурних підрозділів з питань охорони здоров’я:
1) призначають відповідальну особу за складання звіту за формою первинно-облікової документації № 69 «Звіт про випадки побічних реакцій лікарських засобів, вакцин, туберкуліну, та/або відсутності ефективності лікарських засобів, та/або несприятливих подій після імунізації/туберкулінодіагностики у закладах охорони здоров’я за 20__ рік» (далі — форма № 69), наведеною у додатку 5 до цього Порядку, у термін, визначений підпунктом 2 цього пункту (зведений звіт складається на підставі даних форми № 69, що подаються відповідальними особами з питань фармаконагляду закладів охорони здоров’я, за формою № 69 та подається у строк, визначений підпунктом 2 пункту 3 цього розділу);
2) забезпечують своєчасне подання до Центру звіту за формою № 69 до 30 січня наступного за звітним року за підписом керівника відповідного структурного підрозділу з питань охорони здоров’я у паперовому та електронному вигляді (таблиця Excel). На титульній сторінці форми № 69 вказуються поштова та електронна адреси (зведений звіт за формою № 69 у паперовому вигляді подається до Центру разом із супровідним листом на адресу, що зазначена у формі № 69. Зведений звіт за формою № 69 в електронному вигляді подається на електронну адресу, що зазначена у формі № 69);
3) забезпечують своєчасне подання до Центру протоколів розслідування НППІ та карт-повідомлень за формою, наведеною у додатку 6 до цього Порядку;
4) призначають відповідальну особу за складання загального звіту за картами епідрозслідування про зареєстровані випадки захворювання на інфекційні хвороби, що керуються засобами специфічної імунопрофілактики у щеплених (далі — загальний звіт), за формою, наведеною у додатку 7 до цього Порядку. Загальний звіт складається на підставі даних карт епідрозслідування про випадок захворювання на інфекційні хвороби, що керуються засобами специфічної імунопрофілактики у щеплених (далі — карта епідрозслідування), за формою, наведеною у додатку 8 до цього Порядку;
5) забезпечують своєчасне подання загального звіту до Центру в електронному вигляді у строк до 30 січня наступного за звітним року. Загальний звіт подається на електронну адресу, що зазначена у вимогах до його заповнення;
6) забезпечують щокварталу своєчасне подання до Центру зведених даних про випадки побічних реакцій після застосування вакцин, туберкуліну (далі — зведені дані) в електронному та паперовому вигляді разом із супровідним листом за підписом керівника відповідного структурного підрозділу з питань охорони здоров’я за формою, наведеною у переліку клінічних проявів, на поштову та електронну адреси, що зазначені у вимогах до складання зведених даних, у строк до 10 числа наступного за звітним місяця. У разі якщо цей строк припадає на вихідний або святковий день, зведені дані подаються у перший після нього робочий день;
7) заслуховують щопівроку питання про стан подання медичними працівниками інформації про випадки побічних реакцій лікарських засобів, вакцин, туберкуліну, відсутності ефективності лікарських засобів, НППІ на засіданнях колегій структурних підрозділів з питань охорони здоров’я;
8) включають до складу атестаційних комісій при підпорядкованих структурних підрозділах з питань охорони здоров’я представників Центру з питань фармаконагляду в адміністративно-територіальних одиницях (за згодою).
2. Керівник Державного підприємства «Укрвакцина» Міністерства охорони здоров’я України (далі — Укрвакцина) призначає відповідальну особу за складання та подання звіту щодо кількісного розподілу вакцин по адміністративно-територіальних одиницях, що подається до Центру за формою, наведеною у додатку 9 до цього Порядку, протягом 48 годин з дня отримання від нього письмового запиту.
3. Керівники закладів охорони здоров’я призначають заступника головного лікаря з лікувальної роботи (або іншу особу, яка має вищу медичну та/або фармацевтичну освіту) відповідальною особою з питань фармаконагляду та забезпечують:
1) своєчасне подання медичними працівниками карт-повідомлень та інформації про будь-які інші питання, пов’язані з безпекою та ефективністю застосування лікарських засобів, вакцин, туберкуліну, у строк, визначений пунктом 9 цього розділу;
2) своєчасне подання до відповідного структурного підрозділу з питань охорони здоров’я звіту за формою № 69 (за винятком таблиці 1001) у строк до 20 січня наступного за звітним року у паперовому та електронному вигляді (таблиця Excel). Звіт за формою № 69 у паперовому та електронному вигляді подається разом із супровідним листом за підписом керівника закладу охорони здоров’я на поштову та електронну адреси відповідних структурних підрозділів з питань охорони здоров’я;
3) своєчасне подання до структурних підрозділів з питань охорони здоров’я форми первинної облікової документації № 058/о «Екстрене повідомлення про інфекційне захворювання, харчове, гостре професійне отруєння, незвичайну реакцію на щеплення», затвердженої наказом Міністерства охорони здоров’я України від 10 січня 2006 року № 1, зареєстрованим в Міністерстві юстиції України 08 червня 2006 року за № 686/12560 (далі — повідомлення про інфекційне захворювання), у випадку інфекційного захворювання у пацієнта, щепленого проти відповідної інфекції, у строк не пізніше 12 годин після виявлення такого пацієнта.
4. Відповідальна особа з питань фармаконагляду закладу охорони здоров’я:
1) створює стандартні операційні процедури щодо порядку дій у разі виникнення побічних реакцій лікарського засобу, вакцин, туберкуліну, відсутності ефективності лікарського засобу, НППІ та ознайомлює з ними медичних працівників;
2) веде облік карт-повідомлень;
3) складає звіт за формою № 69 (за винятком таблиці 1001) та подає у строк, визначений підпунктом 2 пункту 3 цього розділу, до відповідного структурного підрозділу з питань охорони здоров’я. Звіт за формою № 69 складається на підставі даних копій карт-повідомлень, що подаються медичними працівниками закладу охорони здоров’я. Звіт за формою № 69 (за винятком таблиці 1001) у паперовому та електронному вигляді (таблиця Excel) подається разом із супровідним листом за підписом керівника закладу охорони здоров’я на поштову та електронну адреси відповідного структурного підрозділу з питань охорони здоров’я;
4) співпрацює зі співробітниками із фармаконагляду Центру в адміністративно-територіальних одиницях з питань здійснення фармаконагляду (аналізу випадків побічних реакцій при застосуванні лікарських засобів, вакцин, туберкуліну, відсутності ефективності лікарських засобів, НППІ, виявлення системних помилок, навчання тощо);
5) сприяє реалізації заходів з мінімізації ризиків, пов’язаних із застосуванням лікарських засобів, вакцин, туберкуліну;
6) веде облік побічних реакцій після застосування вакцин, туберкуліну;
7) складає та надає відповідальній особі структурного підрозділу з питань охорони здоров’я зведені дані про випадки побічних реакцій після застосування вакцин, туберкуліну щомісяця до 05 числа наступного за звітним місяця за формою, наведеною у переліку клінічних проявів. У разі якщо цей строк припадає на вихідний або святковий день, зведені дані про випадки побічних реакцій після застосування вакцин, туберкуліну надаються у перший після нього робочий день. Зведені дані у паперовому та електронному вигляді подаються разом із супровідним листом за підписом керівника закладу охорони здоров’я на поштову та електронну адреси відповідного структурного підрозділу з питань охорони здоров’я.
5. Керівники закладів охорони здоров’я забезпечують надання копій документів первинної медичної документації закладу охорони здоров’я у разі надходження запиту Центру.
6. Медичні працівники інформують:
1) пацієнтів (батьків чи законних представників) про ті побічні реакції, що можуть виникнути при застосуванні лікарських засобів, та необхідність звернення за медичною допомогою до закладу охорони здоров’я у разі погіршення стану здоров’я після застосування лікарського засобу;
2) осіб, які підлягають імунізації, туберкулінодіагностиці (батьків чи законних представників), про ті побічні реакції, що можуть виникнути після застосування певної вакцини, туберкуліну, та необхідність звернення за медичною допомогою до закладу охорони здоров’я у разі будь-якого погіршення стану здоров’я після проведення імунізації/туберкулінодіагностики.
7. Медичні працівники виявляють:
1) побічні реакції лікарського засобу, вакцини, туберкуліну, відсутність ефективності лікарського засобу, будь-яке погіршення стану здоров’я та будь-які інші питання, пов’язані з безпекою та ефективністю застосування лікарського засобу, вакцини, туберкуліну, при зверненні пацієнта, імунізованої особи або особи, якій було проведено туберкулінодіагностику, до закладу охорони здоров’я;
2) НППІ та інші питання, пов’язані з безпекою та ефективністю застосування вакцини, туберкуліну, при зверненні імунізованої особи або особи, якій було проведено туберкулінодіагностику.
8. Медичні працівники своєчасно подають до Центру карти-повідомлення про будь-які побічні реакції лікарських засобів, вакцин, туберкуліну, відсутність ефективності лікарського засобу та про НППІ у строки, визначені пунктом 9 цього розділу.
9. Карта-повідомлення подається у паперовому та/або електронному вигляді. Електронна форма карти-повідомлення знаходиться за посиланням . Копія карти-повідомлення подається відповідальній особі з питань фармаконагляду закладу охорони здоров’я для складання звіту за формою № 69.
Карта-повідомлення подається до Центру у такі строки:
у випадку розвитку несерйозної побічної реакції/НППІ при застосуванні лікарського засобу — протягом 90 днів;
у випадку розвитку серйозної побічної реакції/НППІ при застосуванні лікарського засобу — протягом 15 днів;
у випадку розвитку відсутності ефективності при застосуванні лікарського засобу — протягом 48 годин;
у випадку розвитку побічної реакції лікарського засобу, вакцини, туберкуліну, та/або відсутності ефективності лікарського засобу, та/або несприятливої події після імунізації/туберкулінодіагностики, що призвели до смерті пацієнта, — протягом 48 годин.
У разі якщо зазначені строки припадають на вихідний або святковий день, інформація надається у перший після нього робочий день.
10. Інформація про побічну реакцію лікарського засобу, вакцини, туберкуліну, та/або відсутність ефективності лікарського засобу, та/або несприятливу подію після імунізації/туберкулінодіагностики заноситься лікарем до первинної облікової медичної документації.
11. Медичні працівники своєчасно подають до Центру та групи оперативного реагування відповідних структурних підрозділів з питань охорони здоров’я (далі — регіональна група оперативного реагування) карти-повідомлення про НППІ після застосування вакцини, туберкуліну у строк не пізніше 48 годин після реєстрації НППІ. У разі якщо цей строк припадає на вихідний або святковий день, інформація надається у перший після нього робочий день.
12. Карта-повідомлення подається до Центру та до регіональної групи оперативного реагування у паперовому та/або електронному вигляді. Копія карти-повідомлення надається відповідальній особі з питань фармаконагляду закладу охорони здоров’я для складання форми № 69.
13. Вимоги до створення, складу і завдання регіональних та центральної груп оперативного реагування на несприятливі події після імунізації/ туберкулінодіагностики визначені Положенням про центральну і регіональні групи оперативного реагування на несприятливі події після імунізації/туберкулінодіагностики, затвердженим наказом Міністерства охорони здоров’я України від 26 вересня 2016 року № 996.
14. Медичні працівники закладу охорони здоров’я, де проводиться щеплення, здійснюють моніторинг та надають інформацію щодо захворюваності у щеплених на інфекції, що керуються засобами специфічної імунопрофілактики.
У разі виявлення випадку інфекційного захворювання медичні працівники заповнюють первинну облікову медичну документацію (повідомлення про інфекційне захворювання) та надають її до структурного підрозділу з питань охорони здоров’я у строк не пізніше 12 годин після виявлення такого захворювання. У разі якщо цей строк припадає на вихідний або святковий день, інформація надається у перший після нього робочий день.
15. Відповідальна особа структурного підрозділу з питань охорони здоров’я при отриманні повідомлення про інфекційне захворювання проводить епідеміологічне розслідування за місцем виникнення/виявлення захворювання.
У разі якщо під час епідеміологічного розслідування буде з’ясовано, що має місце випадок інфекційного захворювання у особи, щепленої проти відповідної інфекції, відповідальна особа структурного підрозділу з питань охорони здоров’я заповнює карту епідрозслідування у строк не пізніше 48 годин з дня з’ясування. У разі якщо цей строк припадає на вихідний або святковий день, інформація надається у перший після нього робочий день.
16. Відповідальна особа структурного підрозділу з питань охорони здоров’я складає загальний звіт на підставі даних карт епідрозслідування. Загальний звіт в електронному вигляді разом із супровідним листом подається до Центру на електронну адресу, що зазначена у вимогах до його заповнення, щороку до 30 січня наступного за звітним року. У разі якщо цей строк припадає на вихідний або святковий день, інформація надається у перший після нього робочий день.
V. Здійснення фармаконагляду заявником
1. Загальні вимоги до системи фармаконагляду у заявника
1. Заявник створює, забезпечує та гарантує функціонування у себе системи фармаконагляду в Україні, що є обов’язковою умовою обігу лікарських засобів, вакцин, туберкуліну на території України.
2. Система фармаконагляду складається з елементів, що дають змогу здійснювати моніторинг безпеки лікарських засобів, вакцин, туберкуліну та визначати будь-які зміни співвідношення користь/ризик, а саме:
1) наявність УОВФ у заявника. Якщо заявник знаходиться в Україні, УОВФ має бути в штаті заявника. Якщо заявник знаходиться не в Україні, на території України має бути визначена єдина КОВФ в Україні, підпорядкована УОВФ заявника. Дані про УОВФ та КОВФ в Україні мають міститися в МФСФ заявника. УОВФ/КОВФ в Україні повинні мати вищу медичну або фармацевтичну освіту (провізор, клінічний провізор). За наявності лише вищої фармацевтичної освіти УОВФ/КОВФ в Україні повинна мати змогу звернутись до особи з вищою медичною освітою (за необхідності). Кожна система фармаконагляду може мати лише одну УОВФ/КОВФ в Україні. Має бути передбачена процедура заміщення УОВФ та/або КОВФ в разі її відсутності;
2) наявність структурованої системи організації фармаконагляду, її оновлення і підтримка;
3) документування всіх процедурних процесів;
4) створення та забезпечення функціонування баз даних, що використовуються заявником при здійсненні фармаконагляду;
5) залучення (у разі необхідності) до здійснення фармаконагляду інших юридичних та/або фізичних осіб та підприємств, установ, організацій шляхом укладення договірних відносин;
6) забезпечення навчання персоналу заявника для виконання дій, пов’язаних із фармаконаглядом;
7) створення системи якості фармаконагляду;
8) ведення документації із фармаконагляду, включаючи її зберігання та архівування;
9) створення та підтримка системи управління ризиками.
3. УОВФ/КОВФ в Україні мають обов’язки (але не виключно) щодо:
1) створення та підтримки системи збору, оцінки та надання до Центру інформації про побічні реакції, відсутність ефективності, НППІ, інших даних, пов’язаних з безпекою та ефективністю застосування лікарських засобів, вакцин, туберкуліну, а також будь-яких даних, необхідних для оцінки ризику і користі при застосуванні лікарського засобу, вакцини, туберкуліну, включно із системою якості;
2) складання (для КОВФ — у разі необхідності) та/або подання регулярно оновлюваних звітів з безпеки (далі — регулярний звіт з безпеки) відповідно до періодичності подання регулярно оновлюваних звітів з безпеки лікарських засобів, вакцин, туберкуліну за міжнародною непатентованою назвою активного фармацевтичного інгредієнта або комбінацій активних фармацевтичних інгредієнтів (далі — періодичність подання регулярних звітів з безпеки) (додаток 10);
3) складання (для КОВФ — у разі необхідності) та/або надання планів управління ризиками;
4) надання на всі запити Центру додаткової інформації, необхідної для оцінки співвідношення користь/ризик лікарського засобу, вакцини, туберкуліну, у тому числі даних про обсяги продажу лікарського засобу або експозицію пацієнтів, які зазнали впливу лікарського засобу, вакцини, туберкуліну;
5) забезпечення надання будь-яких даних, необхідних для оцінки співвідношення користь/ризик лікарського засобу, вакцини, туберкуліну, включаючи інформацію про післяреєстраційні дослідження з безпеки та ефективності лікарського засобу, вакцини, туберкуліну;
6) надання повідомлення до Центру, вжиття необхідних заходів та внесення відповідних змін і доповнень до інформації з безпеки лікарського засобу, вакцини, туберкуліну, відображеної в інструкції для медичного застосування/короткій характеристиці лікарського засобу, вакцини, туберкуліну, у випадку виявлення раніше невідомих небезпечних властивостей лікарського засобу, вакцини, туберкуліну, що призвели або можуть призвести до тяжких наслідків для здоров’я і життя людей або зміни оцінки співвідношення користь/ризик у бік ризику, про які УОВФ/КОВФ стало відомо;
7) забезпечення навчання персоналу заявника для виконання дій, пов’язаних із фармаконаглядом.
4. У випадку внесення змін до системи фармаконагляду заявник оновлює її, підтримує та подає на вимогу Центру МФСФ документ, що містить опис системи фармаконагляду заявника, який використовується заявником стосовно одного або декількох лікарських засобів, вакцин, туберкуліну. МФСФ складається відповідно до структури, наведеної у додатку 11 до цього Порядку, та містить інформацію про:
1) УОВФ/КОВФ;
2) організаційну структуру заявника, включаючи систему фармаконагляду, що забезпечує збір, визначення, оцінку та подання вірогідної інформації про побічні реакції, відсутність ефективності, НППІ, а також будь-яких інших даних, необхідних для оцінки ризику і користі при застосуванні лікарського засобу, вакцини, туберкуліну;
3) фізичних та/або юридичних осіб, залучених заявником до здійснення фармаконагляду;
4) джерела інформації про безпеку застосування лікарських засобів, вакцин, туберкуліну;
5) перелік та стислий функціональний опис баз даних, що використовуються заявником при здійсненні фармаконагляду;
6) процеси у фармаконагляді, включаючи перелік стандартних операційних процедур, що використовуються при здійсненні фармаконагляду, опис документації з фармаконагляду, включаючи документацію, що зберігається в архіві, інші види документації, що стосуються здійснення фармаконагляду;
7) результативність системи фармаконагляду;
8) систему якості у фармаконагляді, включаючи опис системи навчання персоналу заявника із зазначенням інформації про навчання, з урахуванням функціональних обов’язків персоналу заявника, із наданням стислого опису зобов’язань заявника для гарантії якості аудиту системи фармаконагляду, включаючи аудит системи фармаконагляду та аудит фізичних та/або юридичних осіб, які залучені заявником до здійснення фармаконагляду.
2. Вимоги до подання заявником повідомлень про побічні реакції лікарських засобів, вакцин, туберкуліну та/або відсутність ефективності лікарських засобів
1. при поданні заявником повідомлень про побічні реакції лікарських засобів, вакцин, туберкуліну та/або відсутність ефективності лікарських засобів заявник своєчасно подає до Центру:
1) у будь-який спосіб достовірну інформацію про всі випадки серйозних побічних реакцій на лікарські засоби, вакцини, туберкулін, які були зафіксовані при їх застосуванні в Україні та мають медичне підтвердження і про які йому стало відомо, за наявності причинно-наслідкового зв’язку між побічною реакцією та застосуванням лікарського засобу, вакцини, туберкуліну — не пізніше 15 календарних днів з дня отримання такої інформації;
2) у будь-який спосіб достовірну інформацію про всі випадки несерйозних побічних реакцій на лікарські засоби, вакцини, туберкулін, які були зафіксовані при їх застосуванні в Україні та мають медичне підтвердження і про які йому стало відомо, за наявності причинно-наслідкового зв’язку між побічною реакцією та застосуванням лікарського засобу, вакцини, туберкуліну — не пізніше 90 календарних днів з дня отримання такої інформації;
3) у будь-який спосіб достовірну інформацію про всі випадки серйозних непередбачених побічних реакцій на лікарські засоби, вакцини, туберкулін, що призвели до смерті або становили загрозу для життя пацієнта, про всі підозрювані випадки передавання інфекції лікарським засобом, що були зафіксовані на території іншої країни та мають медичне підтвердження і про які йому стало відомо, за наявності причинно-наслідкового зв’язку між ними та застосуванням лікарського засобу, вакцини, туберкуліну — не пізніше 15 календарних днів з дня отримання такої інформації;
4) у будь-який спосіб достовірну інформацію про випадки порушень, що виникають у процесі виробництва вакцини, туберкуліну, включаючи пристрій для введення, — не пізніше 48 годин з дня отримання такої інформації.
Якщо строк подання інформації припадає на вихідний або святковий день, інформація надається у перший після нього робочий день;
5) інформацію про усі інші випадки побічних реакцій лікарських засобів, вакцин, туберкуліну, які були зафіксовані на території іншої країни і про які йому стало відомо, — у складі чергового регулярного звіту з безпеки лікарського засобу, вакцини, туберкуліну;
6) у будь-який спосіб достовірну інформацію про випадки відсутності ефективності, що були зафіксовані в Україні і виникли під час:
лікування станів, що загрожують життю або невідкладних, крім випадків, коли першоджерело повідомлення зазначає, що випадок відсутності ефективності пов’язаний із прогресуванням захворювання, а не із застосуванням лікарського засобу;
застосування вакцин;
застосування контрацептивів.
Інформація подається не пізніше 15 календарних днів з дня її отримання. Якщо цей строк припадає на вихідний або святковий день, інформація надається у перший після нього робочий день;
7) інформацію про всі інші ідентифіковані випадки відсутності ефективності лікарського засобу, про які йому стало відомо, — у складі чергового регулярного звіту.
2. Повідомлення про побічні реакції лікарських засобів, вакцин, туберкуліну та/або відсутність ефективності лікарських засобів подається з наданням інформації, зазначеної у пункті 7 цієї глави, у паперовому та/або в електронному вигляді за посиланням .
3. Повідомлення про випадок побічної реакції лікарського засобу, вакцини, туберкуліну та/або відсутності ефективності лікарського засобу заявник подає до Центру у вигляді інформації про побічні реакції лікарського засобу, вакцини, туберкуліну та/або відсутність ефективності лікарського засобу, що виникали у одного пацієнта в певний момент часу.
4. Заявник враховує повідомлення про випадки побічних реакцій лікарського засобу, вакцини, туберкуліну та/або відсутності ефективності лікарського засобу, отримані ним електронним шляхом або іншим методом від пацієнтів та/або їх законних представників або медичних працівників.
5. Заявник співпрацює з Центром щодо виявлення повторних повідомлень про випадки побічних реакцій лікарського засобу, вакцини, туберкуліну та/або відсутності ефективності лікарського засобу.
6. Повідомлення про випадок побічної реакції лікарського засобу, вакцини, туберкуліну та/або відсутності ефективності лікарського засобу має містити щонайменше інформацію, за допомогою якої можна ідентифікувати повідомника, пацієнта, одну побічну реакцію/відсутність ефективності і підозрюваний(і) лікарський(і) засіб(оби), вакцину(и), туберкулін.
7. При поданні повідомлення про випадок побічної реакції лікарського засобу, вакцини, туберкуліну та/або відсутності ефективності лікарського засобу заявник надає всю наявну інформацію про кожний окремий випадок, включаючи:
1) адміністративну інформацію (вид повідомлення, дата, унікальний ідентифікаційний номер випадку, а також унікальний ідентифікатор відправника і відправника; дата, коли було вперше отримано інформацію від джерела, та дата отримання найновішої інформації (точні); інші ідентифікатори та їх джерела, а також посилання на додаткові доступні документи, що належать відправнику повідомлення, про випадок побічної реакції лікарського засобу, вакцини, туберкуліну та/або відсутності ефективності лікарського засобу, коли застосовано);
2) посилання відповідно до міжнародних та вітчизняних вимог щодо публікацій — для інформації про випадки побічних реакцій лікарського засобу, вакцини, туберкуліну та/або відсутності ефективності лікарського засобу (за даними літературних джерел), у тому числі вичерпне резюме статті англійською або українською мовою. У разі якщо стаття викладена англійською мовою, слід надати переклад резюме українською мовою. На запит Центру заявник, який передав первинне повідомлення, надає копію відповідної статті з урахуванням обмежень авторського права, а також повний переклад цієї статті українською мовою у разі, якщо стаття викладена англійською мовою;
3) вид, назву і номер, присвоєний спонсором, або реєстраційний номер дослідження з безпеки та ефективності лікарського засобу, вакцини, туберкуліну — для повідомлень про випадки побічних реакцій лікарського засобу, вакцини, туберкуліну та/або відсутності ефективності лікарського засобу при проведенні цього неінтервенційного дослідження;
4) інформацію про першоджерело(а) (інформацію, що ідентифікує джерело повідомлення, включаючи назву країни, де проживає повідомник, та його професійну кваліфікацію);
5) інформацію, що ідентифікує пацієнта й одного з батьків у випадку повідомлення батьки — дитина, включаючи вік на момент виникнення побічної реакції/відсутності ефективності, вікову групу, гестаційний вік, коли реакція/явище спостерігалася(ося) у плода, вагу, зріст, стать, дату останнього менструального та/або гестаційного періоду на момент виникнення побічної реакції/відсутності ефективності;
6) анамнез і супутні захворювання пацієнта;
7) торговельну(і) назву(и) лікарського(их) засобу(ів), вакцини (вакцин), туберкуліну, що підозрюється(ються) у спричиненні побічної реакції та/або відсутності ефективності, у тому числі супутніх лікарських засобів, вакцин, туберкуліну, або, якщо назва невідома, активний(і) фармацевтичний(і) інгредієнт(и) і будь-які інші дані, що дають змогу ідентифікувати лікарський(і) засіб(оби), вакцину(и), туберкулін, у тому числі найменування заявника/виробника, номер реєстраційного посвідчення, країну, де зареєстрований лікарський засіб, вакцина, туберкулін, форму випуску та спосіб застосування, показання для застосування у цьому випадку, застосовані дози, дату початку застосування і дату закінчення застосування, вжиті заходи щодо усунення проявів побічної реакції, включаючи фармакотерапію, результат відміни та повторного призначення підозрюваного(их) лікарського(их) засобу(ів), вакцини;
8) для біологічних лікарських засобів — номер серії. Для того, щоб отримати номер серії, якщо він не вказаний у первинному повідомленні, у заявника має бути наявна процедура збору додаткової інформації;
9) супутні лікарські засоби, вакцини, туберкулін, що не підозрюються у спричиненні побічної реакції/відсутності ефективності, фармакотерапію пацієнта (батьків) у минулому, при доцільності;
10) інформацію про підозрювану(і) побічну(і) реакцію(ї)/відсутність ефективності (дата початку і дата завершення або тривалість, серйозність, наслідок підозрюваної(их) побічної(их) реакції(й)/відсутності ефективності на момент останнього спостереження пацієнта, проміжок часу, що минув від початку застосування підозрюваного лікарського засобу, вакцини, туберкуліну і початку побічної(их) реакції(й)/відсутності ефективності, терміни та дані, зазначені у документації про побічну(і) реакцію(ї)/відсутність ефективності, які використовувало першоджерело для опису побічної(их) реакції(й)/відсутності ефективності, та країна, на території якої виникла(и) побічна(і) реакція(ї) та/або відсутність ефективності);
11) результати тестів і процедур, що стосуються дослідження пацієнта;
12) дату і повідомлену причину смерті, у тому числі причину смерті, встановлену за результатами патолого-анатомічного дослідження;
13) опис випадку (надається за можливості уся пов’язана інформація).
Інформація подається в логічній послідовності (розвиток ситуації у часі, у хронології нагляду за пацієнтом, включаючи клінічний перебіг, терапію, наслідки та отриману у подальшому додаткову інформацію; будь-які доречні результати патолого-анатомічного дослідження; інформація щодо причинно-наслідкового зв’язку між проявами побічної реакції/відсутності ефективності та застосуванням підозрюваного лікарського засобу, вакцини, туберкуліну; причина анулювання або внесення змін до повідомлення про побічні реакції лікарського засобу, вакцини, туберкуліну та/або відсутність ефективності лікарського засобу).
8. Заявник реєструє відомості, необхідні для отримання у подальшому додаткової інформації про побічні реакції лікарського засобу, вакцини, туберкуліну та/або відсутність ефективності лікарських засобів. Наступні повідомлення належним чином документуються.
3. Вимоги до подання заявником регулярних звітів з безпеки
1. Заявник подає до Центру повний регулярний звіт з безпеки відповідно до структури регулярно оновлюваного звіту з безпеки лікарського засобу, вакцини, туберкуліну та вимог до його заповнення, наведених у додатку 12 до цього Порядку. Регулярний звіт з безпеки подається у паперовому вигляді, додатки до регулярного звіту з безпеки можуть бути подані в електронному вигляді. Повний регулярний звіт з безпеки подається українською або англійською мовою з періодичністю, зазначеною у пункті 2 цієї глави. У разі подання регулярного звіту англійською мовою розділи ІІІ «Заходи з безпеки, вжиті протягом звітного періоду», IV «Зміни у довідковій інформації з безпеки», XVIII «Інтегрований аналіз користь/ризик для зареєстрованих показань» та XIX «Висновки та заходи» або інші розділи, що містять таку інформацію, подаються в перекладі українською мовою. Розділи XVI «Оцінка сигналів та ризиків» та XVII «Оцінка користі» регулярного звіту з безпеки подаються в перекладі українською мовою у разі потреби на вимогу Центру.
2. Регулярний звіт з безпеки подається з такою періодичністю:
1) для лікарського засобу, що зареєстрований в Україні як у першій країні світу або вперше у будь-якій іншій країні світу, — кожні 6 місяців протягом перших двох років (незалежно від наявності лікарського засобу в обігу), один раз на рік протягом наступних двох років та надалі — 1 раз кожні три роки, починаючи з дати реєстрації лікарського засобу. Якщо строки подання регулярних звітів з безпеки, зазначені в цьому підпункті, збігатимуться зі строками відповідно до періодичності подання регулярних звітів з безпеки, — регулярний звіт з безпеки подається відповідно до строків, зазначених у періодичності подання регулярних звітів;
2) або відповідно до періодичності, зазначеної у реєстраційному посвідченні при його видачі, згідно з підпунктом 1 пункту 3 цієї глави;
3) або згідно зі строком відповідно до періодичності подання регулярних звітів з безпеки;
4) для лікарських засобів, зареєстрованих після набрання чинності цим наказом, — згідно зі строками, зазначеними у періодичності подання регулярних звітів з безпеки, або за бажанням заявника, але не рідше встановленого законодавством строку;
5) за запитом/вимогою Центру.
3. Регулярний звіт з безпеки подається на всі лікарські засоби, крім генеричних лікарських засобів, лікарських засобів, що мають добре вивчене медичне застосування, традиційних рослинних та гомеопатичних лікарських засобів, за винятком випадків, коли надання регулярного звіту з безпеки для таких лікарських засобів:
1) є умовою видачі реєстраційного посвідчення;
2) вимагає Міністерство охорони здоров’я України та/або Центр у зв’язку з питаннями, пов’язаними з даними фармаконагляду, або через відсутність регулярного звіту з безпеки для активного фармацевтичного інгредієнта після видачі реєстраційного посвідчення (наприклад, коли дію реєстраційного посвідчення референтного лікарського засобу в Україні припинено);
3) строки визначені періодичністю подання регулярних звітів з безпеки.
Заявники лікарських засобів, яким більше не потрібно подавати регулярний звіт з безпеки, продовжують регулярну оцінку безпеки своїх лікарських засобів та повідомляють про будь-яку нову інформацію з безпеки, що впливає на співвідношення користь/ризик, та інформацію про лікарський засіб, що зазначена в інструкції для медичного застосування/короткій характеристиці лікарського засобу.
4. Регулярний звіт з безпеки складається та подається відповідно до таких строків:
1) протягом 70 календарних днів з дати закриття бази даних (день 0) — для регулярних звітів з безпеки, що охоплюють звітний період до 12 місяців включно;
2) протягом 90 календарних днів з дати закриття бази даних (день 0) — для регулярних звітів з безпеки, що охоплюють звітний період понад 12 місяців;
3) відповідно до строків, вказаних у запитах, для регулярних звітів з безпеки на запит;
4) протягом 90 календарних днів з дати закриття бази даних (день 0) — для регулярних звітів з безпеки в інших випадках.
5. При зміні частоти подання та/або строків подання регулярного звіту з безпеки заявник подає заяву на зміни до реєстраційних матеріалів протягом дії реєстраційного посвідчення у визначеному законодавством порядку. Застосовується у випадках, коли заявник виявив бажання подавати регулярний звіт з безпеки за іншою періодичністю, але не рідше встановленого законодавством строку.
6. При перереєстрації лікарського засобу, вакцини, туберкуліну в Україні заявник подає до Центру разом із документами, необхідними для проведення експертизи матеріалів для державної перереєстрації лікарського засобу, вакцини, туберкуліну згідно із законодавством України, зведені дані про стан безпеки медичного застосування лікарського засобу, вакцини, туберкуліну в Україні за період дії останнього реєстраційного посвідчення за формою, наведеною у додатку 13 до цього Порядку.
7. Якщо не зазначено інше у періодичності подання регулярних звітів з безпеки та періодичність подання регулярного звіту з безпеки не зазначена як умова видачі реєстраційного посвідчення, заявник складає регулярний звіт з безпеки для активного фармацевтичного інгредієнта (далі — АФІ) на всі лікарські форми. Регулярний звіт з безпеки охоплює усі показання, способи застосування, форми випуску і силу дії незалежно від того, зареєстровані чи ні такі лікарські засоби, вакцини, туберкулін під різними торговельними назвами і за різними типами заявок на реєстрацію. За необхідності дані, що стосуються окремого показання, форми випуску, способу застосування чи сили дії, подаються в окремому розділі регулярного звіту з безпеки і відповідним чином мають бути розглянуті будь-які питання з безпеки.
8. Якщо не зазначено інше у періодичності подання регулярних звітів та періодичність подання регулярного звіту з безпеки не зазначена як умова видачі реєстраційного посвідчення, а також якщо АФІ, на який поширюється дія регулярного звіту з безпеки, також зареєстрований як складова фіксованої комбінації, заявник або подає окремий регулярний звіт з безпеки для комбінації АФІ, що зареєстровані тим самим заявником, з перехресними посиланнями на регулярний(і) звіт(и) з безпеки для окремого АФІ, або подає дані для комбінації в межах регулярного звіту з безпеки для одного АФІ.
9. Регулярний звіт з безпеки містить:
1) резюме даних щодо користі та ризиків лікарського(их) засобу(ів), вакцини (вакцин), туберкуліну, включаючи результати усіх досліджень з урахуванням потенційного впливу на реєстраційне посвідчення;
2) наукову оцінку співвідношення користь/ризик лікарського(их) засобу(ів), вакцини (вакцин), туберкуліну, що повинна базуватись на всіх даних, включаючи дані клінічних випробувань за незареєстрованими показаннями, та популяцій;
3) всі дані щодо обсягу продажу та інші дані щодо обсягу призначень (виписаних рецептів) лікарського(их) засобу(ів), вакцини (вакцин), туберкуліну, що відомі заявнику, включаючи оцінку популяції, яка зазнала впливу лікарського(их) засобу(ів), вакцини (вакцин), туберкуліну.
Регулярний звіт з безпеки ґрунтується на всіх доступних даних і зосереджується на новій інформації з безпеки медичного застосування лікарського засобу, вакцини, туберкуліну за звітний період. У регулярному звіті з безпеки також надається оцінка експозиції, яка піддавалась впливу лікарського засобу, вакцини, туберкуліну, в тому числі надаються всі дані, що стосуються обсягу продажу й обсягу призначень лікарського(их) засобу(ів), вакцини (вакцин), туберкуліну. Оцінка експозиції повинна супроводжуватися якісним і кількісним аналізом фактичного використання, що має показувати (де це доречно), як фактичне використання відрізняється від показаного застосування, ґрунтуючись на всіх наявних у розпорядженні заявника даних, включаючи результати неінтервенційних досліджень і досліджень використання лікарських засобів.
10. Регулярний звіт з безпеки містить результати оцінки ефективності діяльності з мінімізації ризиків, пов’язаних з оцінкою співвідношення користь/ризик.
11. Регулярний звіт з безпеки містить висновок щодо необхідності здійснення певних заходів, включаючи необхідність внесення змін та/або доповнень до інструкції для медичного застосування/короткої характеристики лікарського(их) засобу(ів), вакцини (вакцин), туберкуліну, щодо яких подається регулярний звіт з безпеки.
12. У разі необхідності внесення змін до інструкції для медичного застосування/короткої характеристики лікарського засобу заявник не пізніше 60 календарних днів подає заяву на зміни до реєстраційних матеріалів протягом дії реєстраційного посвідчення відповідно до Порядку проведення експертизи реєстраційних матеріалів на лікарські засоби, що подаються на державну реєстрацію (перереєстрацію), а також експертизи матеріалів про внесення змін до реєстраційних матеріалів протягом дії реєстраційного посвідчення, затвердженого наказом Міністерства охорони здоров’я України від 26 серпня 2005 року № 426, зареєстрованого в Міністерстві юстиції України 07 жовтня 2015 року за № 1210/27655 (у редакції наказу Міністерства охорони здоров’я України від 23 липня 2015 року № 460) (далі — Порядок проведення експертизи).
13. Заявник перед оприлюдненням інформації з безпеки лікарських засобів, включаючи листи-звернення до спеціалістів системи охорони здоров’я, громадськості, медичних та/або фармацевтичних працівників, попередньо узгоджує цю інформацію з Міністерством охорони здоров’я України та/або Центром, за винятком тих випадків, що потребують термінового оприлюднення такої інформації за одночасного інформування про це Міністерства охорони здоров’я України та/або Центру.
4. Вимоги до системи управління ризиками у системі фармаконагляду заявника
1. Заявник створює та підтримує систему управління ризиками у системі фармаконагляду.
2. Заявник створює та надає до Центру плани управління ризиками:
1) для усіх нових заяв на реєстрацію лікарських засобів, у тому числі генеричних лікарських засобів (за винятком традиційних та гомеопатичних лікарських засобів, що реєструються за спрощеною процедурою відповідно до Порядку проведення експертизи);
2) у разі змін, що потребують нової реєстрації, зокрема нової лікарської форми, нового способу введення, нового процесу виробництва біотехнологічного лікарського засобу, педіатричних показань та інших істотних змін в показаннях тощо;
3) у разі появи/виявлення нових даних, що впливають на співвідношення користь/ризик лікарського засобу, поточну специфікацію, план з фармаконагляду, заходи з мінімізації ризиків чи їх ефективність, або протягом 60 днів після досягнення важливих результатів щодо фармаконагляду або мінімізації ризиків;
4) у разі перереєстрації, якщо план управління ризиками необхідний за результатами оцінки співвідношення користь/ризик відповідно до положень додатка 15 до Порядку проведення експертизи;
5) на вимогу Центру протягом 60 днів після подання запиту.
3. Якщо при підготовці регулярного звіту з безпеки виникає необхідність внесення змін до плану управління ризиками (внаслідок появи/виявлення нових даних з безпеки та/або інших даних), разом із регулярним звітом з безпеки подається оновлена версія плану управління ризиками. У цьому випадку непотрібно подавати окрему заяву на зміни для подання плану управління ризиками.
4. Для тих лікарських засобів, що не потребують створення планів управління ризиками, згідно з підпунктом 1 пункту 2 цієї глави заявник підтримує файл специфікації важливих ідентифікованих ризиків, важливих потенційних ризиків і відсутньої інформації з метою підготовки регулярного звіту з безпеки.
5. Якщо інше не зазначено як умова видачі реєстраційного посвідчення та у разі доцільності план управління ризиками може бути складений для лікарських засобів, вакцин, що містять однакові АФІ, належать одному й тому самому заявнику і можуть підпадати під дію (бути предметом) одного плану управління ризиками.
6. План управління ризиками подається у форматі окремого документа відповідно до структури, наведеної у додатку 14 до цього Порядку, або іншої структури, що містить модулі, частини, розділи, аналогічні викладеним у додатку 14 до цього Порядку, включаючи інформацію щодо заходів з мінімізації ризиків, резюме плану управління ризиками, план з фармаконагляду. План управління ризиками надається у паперовому вигляді, а додатки до нього можуть бути подані в електронному вигляді. При створенні плану управління ризиками слід враховувати вимоги до заповнення залежно від типу заяви на реєстрацію лікарського засобу, наведені у додатку 14 до цього Порядку. План управління ризиками подається українською або англійською мовою. У разі подання плану управління ризиками англійською мовою частини V «Заходи з мінімізації ризиків» та VI «Резюме плану управління ризиками» подаються в перекладі українською мовою. Модуль СVIII «Резюме проблем з безпеки», частина ІІІ «План з фармаконагляду», частина IV «Плани щодо післяреєстраційних досліджень ефективності» подаються в перекладі українською мовою на вимогу Центру. Кожний поданий план управління ризиками повинен мати унікальний номер версії і дату його створення.
План управління ризиками повинен містити:
визначення і характеристику профілю безпеки лікарського(их) засобу(ів), вакцини (вакцин), туберкуліну;
зазначення того, як сприяти подальшій характеристиці профілю безпеки лікарського(их) засобу(ів), вакцини (вакцин), туберкуліну;
документування заходів для запобігання чи мінімізації ризиків, пов’язаних з лікарським засобом, вакциною, туберкуліном, включаючи оцінку ефективності цих заходів;
документування післяреєстраційних зобов’язань, що були встановлені як умова видачі реєстраційного посвідчення.
7. Якщо у плані управління ризиками зазначено дані про післяреєстраційні дослідження, необхідно вказати, ким вони ініціюються, координуються (заявником на добровільних засадах чи відповідно до зобов’язань).
8. План управління ризиками повинен містити резюме плану управління ризиками.
У разі якщо план управління ризиками стосується більше одного лікарського засобу, вакцини, туберкуліну, резюме плану управління ризиками складається для кожного лікарського засобу, вакцини, туберкуліну.
9. Резюме плану управління ризиками розміщується на сайті Центру.
10. У випадку оновлення плану управління ризиками, якщо такі зміни відбулися внаслідок отримання нової інформації, що може призвести до значної зміни співвідношення користь/ризик, або при досягненні значних етапів (результатів) з фармаконагляду чи мінімізації ризику заявник подає оновлений план управління ризиками до Центру не пізніше 30 календарних днів з дня складання оновленої версії. У разі отримання згоди від Центру заявник може подати тільки оновлені модулі, частини, розділи. Якщо необхідно, заявник подає на вимогу Центру оновлене резюме плану управління ризиками.
5. Вимоги до проведення післяреєстраційних досліджень з безпеки та ефективності лікарського засобу, вакцини, туберкуліну заявником
1. Післяреєстраційні неінтервенційні дослідження з безпеки та ефективності лікарського засобу, вакцини, туберкуліну (далі — дослідження з безпеки) здійснюються заявником на добровільних засадах чи відповідно до зобов’язань. Дослідження з безпеки передбачають збір даних з безпеки, що надходять від пацієнтів чи медичних працівників.
2. Дослідження з безпеки не проводиться, якщо факт його проведення сприяє просуванню лікарського засобу, вакцини, туберкуліну на фармацевтичний ринок.
3. Центр може вимагати від заявника надання протоколу і проміжних звітів про дослідження з безпеки.
4. Під час проведення дослідження з безпеки заявник здійснює моніторинг отриманих даних та аналізує їх вплив на співвідношення користь/ризик лікарського засобу, вакцини, туберкуліну.
Заявник подає до Центру всю нову інформацію, що може вплинути на співвідношення користь/ризик лікарського засобу, вакцини, туберкуліну. Ця вимога не скасовує необхідність подання результатів досліджень з безпеки у регулярних звітах з безпеки.
5. До проведення дослідження з безпеки заявник подає до Центру проект протоколу (цей та наступні пункти цієї глави стосуються тільки досліджень з безпеки, що ініціюються, управляються заявником згідно із зобов’язаннями).
6. Протягом 60 днів з дня отримання проекту протоколу Центр надає заявнику:
лист-повідомлення про затвердження або незатвердження проекту протоколу (у цьому разі Центр детально обґрунтовує несхвалення та зазначає, що проведення дослідження з безпеки сприяє просуванню лікарського засобу, вакцини, туберкуліну на фармацевтичний ринок або не відповідає меті дослідження з безпеки);
лист-повідомлення про те, що дослідження є клінічним дослідженням та відповідає законодавству України щодо проведення клінічних досліджень.
7. Заявник може розпочинати проведення дослідження з безпеки лише після отримання письмового дозволу від Центру.
Після отримання листа-повідомлення про затвердження протоколу заявник може розпочинати дослідження з безпеки відповідно до затвердженого протоколу. Після початку проведення дослідження з безпеки будь-які значні зміни до протоколу до їх впровадження подаються на затвердження до Центру. Центр проводить оцінку таких змін та інформує заявника про згоду або незгоду щодо їх впровадження.
8. Заявник упродовж 12 місяців з дня закінчення збору даних:
1) подає до Центру заключний звіт про дослідження з безпеки українською мовою, якщо дослідження проводилось тільки на території України, або англійською мовою, якщо дослідження проводилось і в інших країнах. У цьому випадку заявник подає переклад українською мовою назви, резюме (abstract) протоколу дослідження з безпеки;
2) подає до Центру резюме заключного звіту про дослідження з безпеки українською мовою в електронному вигляді;
3) оцінює результати дослідження з безпеки, у разі необхідності подає заяву на зміни до реєстраційних матеріалів протягом дії реєстраційного посвідчення відповідно до Порядку проведення експертизи;
4) забезпечує зберігання в електронному вигляді та доступність для аудитів аналітичного набору даних і статистичних програм, що використовувались для генерації даних, включених у заключний звіт про дослідження з безпеки;
5) забезпечує обробку та збереження усієї інформації з дослідження з безпеки, що дає змогу коректного звітування, інтерпретації та перевірки цієї інформації і забезпечує захист конфіденційної інформації про учасників дослідження з безпеки;
6) складає протоколи, заключні звіти та резюме досліджень з безпеки відповідно до структури, наведеної у додатку 15 до цього Порядку;
7) публікує результати проведеного дослідження з безпеки у спеціалізованих медичних виданнях протягом року з дати завершення дослідження з безпеки.
9. На підставі результатів дослідження з безпеки Центр може прийняти рішення щодо реєстраційного посвідчення з обґрунтуванням його прийняття та повідомленням заявника. У випадку прийняття рішення щодо необхідності внесення змін заявник подає до Центру заяву на зміни до реєстраційних матеріалів протягом дії реєстраційного посвідчення відповідно до Порядку проведення експертизи, включаючи інструкцію для медичного застосування.
10. Ця глава застосовується відповідно до законодавства щодо гарантування збереження здоров’я і дотримання прав учасників досліджень з безпеки.
VIІ. Здійснення фармаконагляду центром
1. Загальні положення здійснення фармаконагляду Центром
1. Центр для отримання інформації про побічні реакції, відсутність ефективності, НППІ та про будь-які інші питання, пов’язані з безпекою та ефективністю застосування лікарських засобів, вакцин, туберкуліну, використовує будь-які методи збору інформації, включаючи метод спонтанних повідомлень, активний моніторинг, у тому числі активний моніторинг стаціонарів, рецептурний моніторинг, мета-аналіз, та залучає заявників, медичних працівників, юридичних та фізичних осіб, які здійснюють господарську діяльність з медичної практики, пацієнтів та/або їх законних представників.
2. Центр проводить аналіз інформації про побічні реакції, відсутність ефективності, НППІ та про будь-які інші питання, пов’язані з безпекою та ефективністю застосування лікарських засобів, вакцин, туберкуліну, отриманої з усіх доступних джерел та усіма методами, що використовуються при здійсненні фармаконагляду.
3. Центр при проведенні аналізу інформації, зазначеної у карті-повідомленні, з метою з’ясування достовірності зазначених у ній даних про побічні реакції, та/або відсутність ефективності, та/або НППІ та про будь-які інші питання, пов’язані з безпекою та ефективністю застосування лікарських засобів, вакцин, туберкуліну, має право запитувати та отримувати копії документів, включаючи первинну облікову медичну документацію, у медичних працівників, у закладах охорони здоров’я, у заявників, в організаціях, у юридичних та фізичних осіб, які здійснюють господарську діяльність з медичної практики, у пацієнтів та їх законних представників, що надали таку інформацію.
4. Центр проводить інформаційну та просвітницьку роботу з питань фармаконагляду серед медичних працівників, пацієнтів та/або їх законних представників та заявників із залученням представників Центру з питань фармаконагляду в адміністративно-територіальних одиницях.
5. Центр уповноважує представників Центру з питань фармаконагляду в адміністративно-територіальних одиницях організовувати та контролювати здійснення фармаконагляду в Україні на відповідному адміністративно-територіальному рівні за підтримки керівників усіх структурних підрозділів з питань охорони здоров’я, медичних працівників, осіб — підприємців, які здійснюють господарську діяльність з медичної практики, заявників, керівників та працівників Державної служби України з лікарських засобів та контролю за наркотиками.
6. Центр проводить регулярний аудит власної системи фармаконагляду й аудит системи фармаконагляду у заявника та оприлюднює їх результати.
7. Центр оприлюднює на веб-сайті перелік досліджень з безпеки лікарських засобів, вакцин, туберкуліну.
2. Порядок проведення Центром аудиту системи фармаконагляду заявників
1. Центр проводить аудит системи фармаконагляду заявників для з’ясування питань щодо її наявності та функціонування.
2. Аудити можуть бути:
1) планові:
якщо аудит системи фармаконагляду заявника раніше не проводився протягом 5 років після розміщення на фармацевтичному ринку України першого лікарського засобу, вакцини, туберкуліну заявника;
згідно з графіком проведення планових аудитів;
2) цільові:
з причин, що не стосуються питань, пов’язаних з безпекою лікарських засобів, вакцин, туберкуліну, або з причин недотримання встановлених вимог (зміни в організаційно-правовій формі підприємств, значна зміна власної системи фармаконагляду тощо);
з причин, що стосуються питань, пов’язаних з безпекою лікарського засобу, вакцини, туберкуліну, або з причин недотримання встановлених вимог (несвоєчасне подання повідомлень про випадки побічних реакцій лікарського засобу, вакцини, туберкуліну та/або відсутності ефективності лікарського засобу, подання повідомлень не в повному обсязі, подання доповнень до огляду клінічних даних невідповідної якості, подання регулярних звітів з безпеки невідповідної якості, подання планів управління ризиками невідповідної якості, невідповідність даних, зазначених у повідомленнях, даним з інших джерел інформації; зміни у співвідношенні користь/ризик, результати попередніх аудитів, оприлюднення інформації з фармаконагляду, яка є необ’єктивною чи вводить в оману громадськість, тощо).
3. Аудит передбачає:
1) початок проведення не раніше ніж через 7 тижнів після надсилання попереднього повідомлення-запиту та узгодження із заявником початку його проведення, за винятком випадків, коли існує необхідність проведення аудиту без попередження або коли про проведення аудиту буде попереджено у строк менше ніж 7 тижнів. При цьому заявник надає Центру запитувані документи згідно з попереднім повідомленням-запитом не пізніше ніж за 14 календарних днів до початку проведення аудиту;
2) здійснення аудиту фахівцями з фармаконагляду Центру, які мають досвід роботи у сфері фармаконагляду та діяльність яких не призводить до конфлікту інтересів. У разі необхідності до участі у проведенні аудиту можуть залучатися інші фахівці (відповідно до особливостей застосування та безпеки лікарського засобу, вакцини, туберкуліну) за згодою. При проведенні аудиту обов’язковою умовою є присутність УОВФ/КОВФ заявника, також можуть бути присутні інші законні представники заявника у разі необхідності (за згодою);
3) збереження фахівцями, які проводять аудит, конфіденційної інформації, яку вони одержують під час його проведення, відповідно до вимог законодавства;
4) встановлення у разі наявності таких невідповідностей:
критичних — невідповідності, які унеможливлюють оцінку безпеки застосування та співвідношення користь/ризик лікарських засобів, вакцин, туберкуліну, що спричиняє негативні наслідки для здоров’я населення чи громадського здоров’я. Критичні невідповідності включають відсутність системи фармаконагляду або однієї чи декількох складових системи фармаконагляду;
суттєвих — невідповідності, які можуть негативно вплинути на оцінку безпеки застосування та співвідношення користь/ризик лікарських засобів, вакцин, туберкуліну, що може спричинити негативні наслідки для здоров’я населення чи громадського здоров’я. Суттєві невідповідності включають (але не виключно) порушення вимог щодо кваліфікації, освіти та обов’язків УОВФ/КОВФ, недоліки, виявлені у задокументованих процедурних процесах, пов’язаних зі здійсненням фармаконагляду, недоліки ведення баз даних системи фармаконагляду, недоліки ведення системи управління ризиками, недоліки ведення документації стосовно фармаконагляду;
несуттєвих — невідповідності, що не спричиняють негативного впливу на оцінку безпеки застосування та співвідношення користь/ризик лікарського засобу, вакцини, туберкуліну та негативних наслідків для здоров’я населення чи громадського здоров’я;
5) складання звіту за результатами аудиту, який підтверджує факт проведення аудиту та у якому зазначаються зауваження щодо системи фармаконагляду (за наявності), виявлені порушення/недоліки, невідповідності;
6) надсилання звіту заявнику в строк до 30 календарних днів після повного завершення аудиту;
7) надсилання заявником до Центру для погодження інформації щодо строків коригувальних та запобіжних заходів для усунення заявником критичних і суттєвих невідповідностей та виявлених порушень (недоліків) під час проведеного аудиту (несуттєві невідповідності усуваються в робочому порядку).
4. Центр може провести цільовий аудит для підтвердження усунення невідповідностей.
5. У разі якщо протягом визначеного для усунення недоліків строку заявник не усуває критичні невідповідності, Центр подає до Міністерства охорони здоров’я України пропозиції про тимчасову заборону застосування лікарського(их) засобу(ів), вакцини (вакцин), туберкуліну шляхом припинення дії реєстраційного посвідчення заявника у зв’язку з відсутністю у заявника системи фармаконагляду або її складових.
3. Вимоги до проведення аналізу інформації щодо безпеки та ефективності лікарських засобів, вакцин, туберкуліну
1. Центр систематизує та аналізує:
1) отриману інформацію про побічні реакції, та/або відсутність ефективності, та/або НППІ, будь-які інші питання, пов’язані з безпекою та ефективністю застосування лікарських засобів, вакцин, туберкуліну;
2) отриману інформацію про зареєстровані випадки захворювання на інфекційні хвороби, що керуються засобами специфічної імунопрофілактики у щеплених;
3) регулярні звіти з безпеки;
4) плани управління ризиками.
2. Центр проводить:
1) оцінку якості даних з безпеки та ефективності лікарських засобів, вакцин, туберкуліну;
2) зберігання даних з безпеки та ефективності лікарських засобів, вакцин, туберкуліну;
3) аналіз даних з безпеки та ефективності лікарських засобів, вакцин, туберкуліну;
4) оцінку причинно-наслідкового зв’язку, передбаченості/непередбаченості, ступеня серйозності;
5) аналіз інформації про зареєстровані випадки захворювання на інфекційні хвороби, що керуються засобами специфічної імунопрофілактики у щеплених;
6) виявлення/управління сигналом;
7) оцінку співвідношення користь/ризик;
8) оцінку ефективності заходів з мінімізації/усунення ризиків, вжитих заявником;
9) навчання з питань здійснення фармаконагляду;
10) післяреєстраційні неінтервенційні дослідження з безпеки та ефективності лікарського засобу, вакцини, туберкуліну (за необхідності).
3. Центр при проведенні аналізу даних з безпеки та ефективності лікарських засобів, вакцин, туберкуліну, оцінки причинно-наслідкового зв’язку між клінічними проявами будь-якої побічної реакції та застосуванням лікарського засобу, вакцини, туберкуліну, оцінки причинно-наслідкового зв’язку між відсутністю ефективності та застосуванням лікарського засобу, передбаченості/непередбаченості, ступеня серйозності, інформації про зареєстровані випадки захворювання на інфекційні хвороби, що керуються засобами специфічної імунопрофілактики у щеплених, а також оцінки співвідношення користь/ризик може залучати незалежних експертів та інших спеціалістів у разі необхідності (за згодою).
4. За результатами аналізу даних з безпеки та ефективності лікарських засобів, вакцин, туберкуліну Центр подає пропозиції до Міністерства охорони здоров’я України щодо прийняття рішень:
1) про повну або тимчасову заборону медичного застосування:
у разі виявлення раніше невідомих небезпечних властивостей лікарського засобу, вакцини, туберкуліну, що призвели або можуть призвести до тяжких наслідків для здоров’я населення чи громадського здоров’я;
у випадках, коли ризик від застосування лікарського засобу, вакцини, туберкуліну перевищує користь;
у разі невиконання заявником умов видачі реєстраційного посвідчення;
у разі невиконання заявником взятих на себе зобов’язань;
2) про обмеження застосування лікарського засобу, вакцини, туберкуліну.
5. За результатами аналізу даних з безпеки та ефективності лікарських засобів, вакцин, туберкуліну Центр рекомендує заявнику:
1) внести уточнення, доповнення або зміни до інструкції для медичного застосування/короткої характеристики лікарського засобу, вакцини, туберкуліну з наданням вмотивованих висновків та рекомендацій;
2) провести дослідження з безпеки та ефективності;
3) розробити план управління ризиками.
6. Висновки Центру щодо подальшого медичного застосування лікарського(их) засобу(ів), вакцини (вакцин), туберкуліну можуть бути оскаржені згідно з вимогами чинного законодавства України.
| Начальник Управління фармацевтичної діяльності та якості фармацевтичної продукції |
Т.М. Лясковський |
ВИМОГИ ДО заповнення карти-повідомлення пацієнта
1. Інформація про пацієнта (зазначаються прізвище, ім’я та по батькові пацієнта, у якого спостерігалась побічна реакція при застосуванні лікарського засобу, вакцини, туберкуліну, та/або відсутність ефективності лікарського засобу, та/або несприятлива подія після імунізації/ туберкулінодіагностики, адреса місця проживання та телефон).
2. Інформація про підозрюваний лікарський засіб, чи вакцину, чи туберкулін (зазначаються торговельна назва, лікарська форма, виробник).
3. Інформація про призначення підозрюваного лікарського засобу, чи вакцини, чи туберкуліну (відмічається відповідна позиція).
4. Опис проявів побічної реакції лікарського засобу, вакцини, туберкуліну та/або несприятливої події після імунізації/туберкулінодіагностики та/або зазначення про відсутність ефективності лікарського засобу (детально описується побічна реакція, несприятлива подія після імунізації/туберкулінодіагностики, включаючи безпосередній прояв побічної реакції, несприятливої події після імунізації/туберкулінодіагностики, а також зазначається стислий опис усієї клінічної інформації, що може стосуватися виявленої побічної реакції, несприятливої події після імунізації/туберкулінодіагностики, або надається інформація щодо відсутності ефективності лікарського засобу).
5. Інформація про повідомника (зазначаються прізвище, ім’я та по батькові, адреса місця проживання, номер телефону того, хто подає карту- повідомлення).
6. Інформація про лікаря, заклад охорони здоров’я та місце проживання пацієнта, у якого спостерігалась побічна реакція на лікарський засіб, вакцину, туберкулін, та/або відсутність ефективності лікарського засобу, та/або несприятлива подія після імунізації/туберкулінодіагностики (зазначаються прізвище, ім’я та по батькові лікуючого лікаря, адреса місця роботи, номер телефону та найменування закладу охорони здоров’я, в якому працює лікуючий лікар, місце проживання пацієнта, у якого спостерігалась побічна реакція на лікарський засіб, вакцину, туберкулін, та/або відсутність ефективності лікарського засобу, та/або несприятлива подія після імунізації/туберкулінодіагностики).
ВИМОГИ ДО СКЛАДАННЯ ЗВЕДЕНИХ ДАНИХ
1. Зведені дані про випадки побічних реакцій після застосування вакцин, туберкуліну заповнюються відповідальною особою в такому порядку:
1) у заголовку зведених даних зазначаються заклад охорони здоров’я, структурний підрозділ з питань охорони здоров’я та звітний період;
2) торговельна назва вакцини та туберкуліну;
3) найменування підприємства-виробника, країна;
4) серія вакцини та туберкуліну (правильно вказується серія із усіма наявними літерами (латиницею або кирилицею) та цифрами, зазначеними на упаковці вакцини або анатоксину чи алергену туберкульозного (наприклад: AD12CN234DE — правильний варіант заповнення серії, AД12CН234DE — неправильний варіант заповнення серії));
5) кількість фактично введених доз відповідної серії вакцини, туберкуліну;
6) кількість осіб, яким була проведена імунізація або туберкулінодіагностика конкретною серією вакцини, туберкуліну;
7) інформація про побічні реакції згідно з переліком клінічних проявів побічних реакцій після застосування вакцин, туберкуліну, наведеним у додатку 1 до Порядку здійснення фармаконагляду, затвердженого наказом Міністерства охорони здоров’я України від 26 вересня 2016 року № 996 (далі — Перелік). Якщо клінічні прояви побічної реакції не зазначені в Переліку, але зазначені в інструкції для медичного застосування відповідної вакцини, туберкуліну, ця побічна реакція наводиться у вільному рядку без зазначення коду;
8) у випадку відсутності за звітний період побічних реакцій у відповідній графі зведених даних має бути зазначено «0».
2. Зведені дані про випадки побічних реакцій після застосування вакцин, туберкуліну надаються до:
державного підприємства «Державний експертний центр Міністерства охорони здоров’я України» (вул. Ушинського, 40, м. Київ, 03151, Департамент фармаконагляду; тел/факс: +38 (044) 498–43–58; електронна адреса: [email protected]);
відповідного структурного підрозділу з питань охорони здоров’я у паперовому вигляді разом із супровідним листом (за місцезнаходженням відповідного структурного підрозділу з питань охорони здоров’я. В електронному вигляді на електронну адресу відповідного структурного підрозділу з питань охорони здоров’я).
ВИМОГИ ДО заповнення ЗВІТУ
1. Таблиця 1000 звіту заповнюється відповідальною особою з питань фармаконагляду закладу охорони здоров’я незалежно від форми власності та відповідальною особою структурного підрозділу з питань охорони здоров’я Автономної Республіки Крим, обласних, Київської та Севастопольської міських державних адміністрацій. До звіту вносяться усі виявлені за рік випадки побічних реакцій лікарських засобів, вакцин, туберкуліну, та/або відсутності ефективності лікарських засобів, та/або несприятливих подій після імунізації/туберкулінодіагностики у закладі охорони здоров’я незалежно від форм власності, у такому порядку: до кожної графи таблиці вносяться дані стосовно усіх виявлених випадків побічних реакцій лікарських засобів, вакцин, туберкуліну, та/або відсутності ефективності лікарських засобів, та/або несприятливих подійпісля імунізації/туберкулінодіагностики у закладах охорони здоров’я області (міста) в послідовному порядку по закладах (обласного, міського, районного значення). Кожен наступний випадок вноситься до наступного рядка таблиці 1000.
2. Графи таблиці 1000:
1 — Порядковий номер;
2 — П.І.Б. (зазначаються ініціалами прізвище, ім’я та по батькові пацієнта);
3 — Стать (жіноча або чоловіча).
Якщо повідомлення стосується лікарського засобу, який приймала вагітна жінка, а побічна реакція, та/або відсутність ефективності лікарського засобу, вакцини, туберкуліну, та/або несприятлива подіяпісля імунізації виникли у плода, всі дані (за винятком побічної реакції) надаються про матір із зазначенням триместру вагітності;
4 — Вік (для пацієнтів віком від 3 років і старше зазначаються роки; для пацієнтів молодше 3 років — місяці; для пацієнтів віком до місяця — дні);
5 — Номер історії хвороби або амбулаторної карти;
6 — Підозрюваний лікарський засіб (торговельна назва, лікарська форма, виробник (повне найменування), країна);
7 — Опис проявів ПР, зазначення про ВЕ, опис НППІ (зазначаються негативні клінічні прояви, пов’язані з переважаючим або комбінованим впливом на функції органів травлення, шкіри, центральної нервової системи, серцево-судинної системи, системи дихання, сечовивідної, імунної та інших систем, що виникли унаслідок застосування підозрюваного лікарського засобу або комбінацій лікарських засобів, вакцин, туберкуліну і призвели до відповідного порушення життєдіяльності організму. У випадку відсутності ефективності зазначається «відсутність ефективності». У випадку несприятливої події після імунізації надається опис несприятливої події після імунізації);
8 — Основний клінічний та супутній діагнози із зазначенням шифру за МКХ-10 (зазначаються основний клінічний та супутній діагнози пацієнта, у якого спостерігалася побічна реакція на лікарський засіб, вакцину, туберкулін, та/або відсутність ефективності лікарського засобу, та/або несприятлива подія після імунізації/туберкулінодіагностики, та шифр за МКХ-10).
3. Таблиця 1001 звіту заповнюється відповідальною особою структурного підрозділу з питань охорони здоров’я Автономної Республіки Крим, обласних, Київської та Севастопольської міських державних адміністрацій. До звіту вносяться усі виявлені за рік випадки побічних реакцій лікарських засобів, вакцин, туберкуліну, та/або відсутності ефективності лікарських засобів, та/або несприятливих подій після імунізації/туберкулінодіагностики у закладі охорони здоров’я незалежно від форм власності (а саме абсолютні показники стосовно певної адміністративно-територіальної одиниці (області, міста)).
4. Графи таблиці 1001:
1 — Кількість закладів охорони здоров’я (зазначається кількість усіх діючих закладів охорони здоров’я незалежно від форм власності, що розташовані на території адміністративно-територіальної одиниці (області, міста));
2 — Кількість закладів охорони здоров’я, які подавали карти-повідомлення про ПР/ВЕ/НППІ (зазначається кількість усіх діючих закладів охорони здоров’я незалежно від форм власності, що розташовані на території адміністративно-територіальної одиниці, які протягом звітного року надавали карти-повідомлення про випадки побічних реакцій, та/або відсутності ефективності лікарських засобів, вакцин, туберкуліну, та/або несприятливих подій після імунізації);
3 — Кількість лікарів (за винятком тих, які не займаються лікарсько-профілактичною діяльністю) (зазначається загальна кількість лікарів, за винятком тих, які не займаються лікарсько-профілактичною діяльністю (патологоанатоми, лікарі-лаборанти, лікарі-статистики тощо));
4 — Кількість населення (середньорічна) (зазначається загальна середньорічна кількість населення в адміністративно-територіальній одиниці (області, міста) у звітному році (за даними статистичних управлінь));
5 — Із них діти (до 18 років включно) (зазначається середньорічна кількість дитячого населення (0 — 18 років включно) із загальної кількості населення в адміністративно-територіальній одиниці, що вказана у графі 4);
6 — Кількість карт-повідомлень про випадки ПР/ВЕ/НППІ (зазначається загальна кількість карт-повідомлень про випадки побічних реакцій лікарських засобів, вакцин, туберкуліну, та/або відсутності ефективності лікарських засобів, та/або несприятливих подій після імунізації/туберкулінодіагностики, що були надіслані з певної адміністративно-територіальної одиниці (області, міста). Цей показник має збігатися із загальною кількістю карт-повідомлень, зазначеною в таблиці 1000).
Вимоги до заповнення КАРТИ-ПОВІДОМЛЕННЯ
I. Інформація про пацієнта
П.І.Б. пацієнта (прізвище, ім’я та по батькові пацієнта зазначаються першими літерами. Якщо повідомлення стосується лікарського засобу, вакцини, які приймала вагітна жінка, а побічна реакція виникла у плода, всі дані (за винятком побічної реакції) надаються про матір).
Номер історії хвороби/амбулаторної карти (указується номер історії хвороби чи амбулаторної карти пацієнта).
Дата народження/вік (зазначаються день, місяць та рік народження пацієнта. Для пацієнтів віком від 3 років та старше зазначаються роки (наприклад, 4 роки); для пацієнтів до 3 років — місяці (наприклад, 24 місяці); для пацієнтів віком до місяця — дні (наприклад, 5 днів)).
Стать (позначається або Ж, або Ч. Якщо повідомлення стосується лікарського засобу, вакцини, які приймала вагітна жінка, а побічна реакція виникла у плода, всі дані (за винятком побічної реакції) надаються про матір із зазначенням триместру вагітності).
Вага (зазначається вага пацієнта у кг).
Зріст (зазначається зріст пацієнта у см).
II. Підозрювані ПР/ВЕ/НППІ
Підозрювана ПР/НППІ (описується кожен клінічний прояв ПР/НППІ із зазначенням дат та часу початку, закінчення та наслідку)/Зазначення ВЕ (описується кожна ПР/НППІ із зазначенням дат та часу початку і закінчення та наслідку ПР/ВЕ/НППІ. У повідомленні щодо вроджених аномалій плода вказується дата народження дитини або строк вагітності).
Наслідок ПР/ВЕ/НППІ (зазначаються відповідні позиції).
Корекція ПР/ВЕ/НППІ (зазначаються відповідні позиції).
Якими вважаються прояви ПР/НППІ (стосується випадку ПР/НППІ в цілому) (зазначаються відповідні позиції. У разі групової НППІ карти-повідомлення заповнюються на кожного пацієнта, у якого зареєстрована НППІ та якому була проведена імунізація/туберкулінодіагностика).
III. Інформація про підозрюваний ЛЗ, вакцину, туберкулін
Підозрюваний лікарський засіб, вакцина, туберкулін (торговельна назва, форма випуску, виробник) (указуються торговельна назва лікарського засобу, вакцини, туберкуліну, що підозрюються у причетності до виникнення ПР/ВЕ/НППІ, лікарська форма, виробник).
Номер серії (зазначається номер серії підозрюваних лікарського засобу, вакцини, туберкуліну).
Показання (зазначаються показання для призначення підозрюваного лікарського засобу, вакцини, туберкуліну (за можливості за МКХ-10)).
Сила дії (указується вміст діючої(их) речовини (речовин) у кількісному вираженні на одиницю дози, або одиницю об’єму, або одиницю маси відповідно до лікарської форми підозрюваних лікарського засобу, вакцини, туберкуліну).
Разова доза (указується разова доза підозрюваних лікарського засобу, вакцини, туберкуліну).
Кратність приймання (указується кратність приймання підозрюваних лікарського засобу, вакцини, туберкуліну).
Спосіб введення (указується спосіб введення підозрюваних лікарського засобу, вакцини, туберкуліну).
Дата та час початку терапії (зазначаються день, місяць, рік та час призначення підозрюваних лікарського засобу, вакцини, туберкуліну).
Дата та час закінчення терапії (зазначаються день, місяць, рік та час закінчення застосування підозрюваних лікарського засобу, вакцини, туберкуліну).
Заходи, що вживались стосовно підозрюваних лікарського засобу, вакцини, туберкуліну для корекції ПР/ВЕ/НППІ (зазначаються відповідні позиції).
ІІІа. Додаткова інформація у випадку НППІ на вакцини або туберкулін
Категорія імунізації або туберкулінодіагностики (позначкою у відповідній клітинці відмічається категорія імунізації або туберкулінодіагностики).
Категорія НППІ (позначкою у відповідній клітинці відмічається категорія НППІ).
Номер дози (для вакцини) (позначкою у відповідній клітинці відмічається номер дози вакцинального комплексу).
Місце уведення вакцини/туберкуліну (позначкою у відповідній клітинці відмічається місце уведення вакцини/туберкуліну).
Спосіб уведення вакцини/туберкуліну (позначкою у відповідній клітинці відмічається спосіб уведення вакцини/туберкуліну).
Дані анамнезу життя особи, якій було проведено щеплення/туберкулінодіагностику (щеплювальний анамнез, наявність реакцій на попередні введення вакцин, туберкуліну, наявність гострого або загострення хронічного захворювання протягом 1–1,5 місяців до проведення імунізації/туберкулінодіагностики, застосування імуносупресивної терапії протягом 1 місяця та препаратів крові протягом 3 місяців до проведення імунізації тощо) (зазначається інформація щодо щеплювального анамнезу, наявності реакції на попередні введення вакцин, туберкуліну, наявності гострого або загострення хронічного захворювання протягом 1–1,5 місяців до проведення імунізації/туберкулінодіагностики, застосування імуносупресивної терапії протягом 1 місяця та препаратів крові протягом 3 місяців до проведення імунізації/туберкулінодіагностики тощо).
IV. Інформація про супутні лікарські засоби (за винятком препаратів, які застосовувалися для корекції наслідків ПР/НППІ/ВЕ)
Супутні лікарські засоби, вакцина, туберкулін (торговельна назва, лікарська форма, виробник, номер серії) (указуються торговельні назви супутніх лікарських засобів, які призначались, їх форма випуску, виробник, номер серії).
Показання (зазначаються показання для призначення супутніх лікарських засобів, вакцини, туберкуліну (за можливості за МКХ-10)).
Сила дії (указується вміст діючої(их) речовини (речовин) у кількісному вираженні на одиницю дози, або одиницю об’єму, або одиницю маси відповідно до лікарської форми супутніх лікарських засобів, вакцин, туберкуліну).
Разова доза (указується разова доза підозрюваних лікарського засобу, вакцини, туберкуліну).
Кратність приймання (указується кратність приймання підозрюваних лікарського засобу, вакцини, туберкуліну).
Спосіб введення (указується спосіб введення супутніх лікарських засобів, вакцин, туберкуліну).
Дата початку терапії (зазначаються день, місяць та рік призначення супутніх лікарських засобів, вакцин, туберкуліну).
Дата закінчення терапії (зазначаються день, місяць та рік закінчення застосування супутніх лікарських засобів, вакцин, туберкуліну).
Інша важлива інформація (супутні діагнози, дані лабораторно-інструментальних досліджень, алергоанамнез, вагітність із зазначенням строку вагітності, способу зачаття, результату вагітності (якщо вагітність завершилась, зазначаються дата пологів, тип пологів тощо)) (зазначаються дані, які можуть впливати на прояв побічної реакції/відсутність ефективності, але безпосередньо з ним не пов’язані).
V. Інформація про повідомника
Зазначаються прізвище, ім’я, по батькові повідомника, спеціальність, організація (заклад охорони здоров’я), поштова адреса організації, електронна адреса, телефон, дата заповнення.
VІ. Інформація про медичного/фармацевтичного спеціаліста (якщо не повідомник)
Зазначаються прізвище, ім’я, по батькові медичного/фармацевтичного спеціаліста, спеціальність, заклад охорони здоров’я, місцезнаходження, електронна адреса, телефон, дата заповнення.
ВИМОГИ ДО ЗАПОВНЕННЯ ЗАГАЛЬНОГО ЗВІТУ
1. Епідномер (зазначається епідномер, який є унікальним для кожного окремого випадку захворювання на керовану інфекцію у щепленого і не може повторюватись у певній адміністративно-територіальній одиниці протягом звітного періоду. Окремо на кожен номер надається перелік всіх щеплень, отриманих протягом життя (зазначається інформація про всі щеплення, які проводились протягом життя, у таблиці з інформацією про вакцину, підприємство-виробник, дату щеплення у форматі день/місяць/рік, дози у форматі мл або краплях, серію (за наявності), термін придатності у форматі день/місяць/рік (за наявності), спосіб уведення у форматі в/м, п/ш, в/ш, перорально)).
Наприклад:
| Торговельна назва | Найменування виробника | Дата | Доза | Серія | Термін придатності | Спосіб уведення |
|---|---|---|---|---|---|---|
| АКДП | Біолік, Україна, Харків | 02.01.2007 | 0,5 мл | 25–5 | 01.01.2008 | в/м |
| ОПВ | Санофі Пастер С.А., Франція | 02.01.2007 | 4 кр. | 871 | 25.10.2007 | перорально |
2. Діагноз (зазначається діагноз, зареєстрований у щепленої особи).
3. Дата народження (зазначається дата народження у форматі день/місяць/рік).
4. Стать (зазначається стать хворого).
5. Найменування закладу, де працює, навчається хвора особа, або дитячого закладу, який відвідує хвора дитина (зазначається найменування закладу, де працює, навчається хвора особа, або дитячого закладу, який відвідує хвора дитина. Якщо хворий не відвідує дитячі заклади та на момент захворювання не працює, зазначається «не працює» або «не організований»).
6. Дані про перенесені інфекційні хвороби (надається інформація про перенесені інфекційні захворювання у вигляді таблиці із зазначенням дати захворювання у форматі день/місяць/рік та діагнозу. У разі відсутності даних про інфекційні захворювання ця графа не заповнюється).
7. Перелік хронічних хвороб (зазначаються дати у форматі день/місяць/рік та перелік будь-яких хронічних захворювань. У разі відсутності інформації про хронічні захворювання ця графа не заповнюється).
8. Контакт з інфекційними хворими (зазначається інформація про контакт особи з інфекційними хворими протягом місяця до захворювання).
9. Інтервал між останнім щепленням та датою захворювання (зазначається розрахований інтервал між датою останнього щеплення проти інфекції, на яку захворіла особа, та датою захворювання у форматі дні/місяці/роки).
10. Загальний звіт за картами епідрозслідування подається до:
державного підприємства «Державний експертний центр Міністерства охорони здоров’я України» в електронному вигляді на електронну адресу [email protected];
відповідного структурного підрозділу з питань охорони здоров’я в електронному вигляді на електронну адресу відповідного структурного підрозділу з питань охорони здоров’я.
ВИМОГИ ДО ЗАПОВНЕННЯ КАРТИ ЕПІДРОЗСЛІДУВАННЯ
1. Епідномер (зазначається епідномер, який є унікальним для кожного окремого випадку захворювання на керовану інфекцію у щепленого і не може повторюватись у певній адміністративно-територіальній одиниці протягом звітного періоду).
2. Діагноз (зазначається діагноз, зареєстрований у щепленої особи).
3. Дата захворювання (зазначається дата захворювання у форматі день/місяць/рік).
4. Прізвище, ім’я, по батькові (зазначаються прізвище, ім’я, по батькові хворого (у разі надання згоди на збір та обробку персональних даних)).
5. Дата народження (зазначається дата народження у форматі день/місяць/рік).
6. Стать (чоловіча/жіноча) (зазначається стать хворого).
7. Найменування закладу, де працює, навчається хвора особа, або дитячого закладу, який відвідує хвора дитина (зазначається найменування закладу, де працює чи навчається хвора особа, або дитячого закладу, який відвідує хвора дитина. Якщо хворий не відвідує дитячі заклади та на момент захворювання не працює, зазначається «не працює» або «не організований»).
8. Дані про перенесені інфекційні хвороби (надається інформація про перенесені інфекційні захворювання у вигляді таблиці із зазначенням дати захворювання у форматі день/місяць/рік та діагнозу. У разі відсутності даних про інфекційні захворювання цей пункт не заповнюється).
9. Наявність хронічних хвороб (зазначаються дати у форматі день/місяць/рік та перелік будь-яких хронічних захворювань. У разі відсутності інформації про хронічні захворювання цей пункт не заповнюється).
10. Контакт з інфекційними хворими протягом місяця до захворювання (так/ні/невідомо) (зазначається інформація про контакт особи з інфекційними хворими протягом місяця до захворювання).
11. Інтервал між останнім щепленням і днем захворювання (розраховується інтервал між датою останнього щеплення проти інфекції, на яку захворіла особа, та датою захворювання у форматі дні/місяці/роки).
12. Перелік щеплень, які проводились протягом життя (зазначається інформація про всі щеплення, які проводились протягом життя, у таблиці з інформацією про торговельну назву, найменування виробника вакцини, дату щеплення у форматі день/місяць/рік, дози у форматі мл або краплях, серію (за наявності), термін придатності у форматі день/місяць/рік (за наявності), спосіб уведення (наприклад, в/м, п/ш, в/ш, перорально)).
Наприклад:
| Торговельна назва | Найменування виробника | Дата | Доза | Серія | Термін придатності | Спосіб уведення |
|---|---|---|---|---|---|---|
| АКДП | Біолік, Україна, Харків | 02.01.2007 | 0,5 мл | 25–5 | 01.01.2008 | в/м |
| ОПВ | Санофі Пастер С.А., Франція | 02.01.2007 | 4 кр. | 871 | 25.10.2007 | перорально |
ВИМОГИ ДО ЗАПОВНЕННЯ ЗВІТУ
1. № з/п (зазначається номер за порядком вакцини).
2. Адміністративно-територіальна одиниця (зазначається адміністративно-територіальна одиниця, куди було розподілено певну серію вакцини).
3. Дата поставки (зазначається дата поставки вакцини у форматі день/місяць/рік).
4. Торговельна назва вакцини (зазначається торговельна назва вакцини).
5. Серія (зазначається серія вакцини).
6. Виробник (зазначається назва підприємства-виробника, країни-виробника вакцини).
7. Кількість доз (зазначається кількість доз окремої вакцини, що були передані у зазначену адміністративно-територіальну одиницю).
8. Температурний режим при транспортуванні (зазначаються умови температурного режиму, що зафіксовані приладами моніторингу температури при транспортуванні вакцини).
ВИМОГИ
до визначення та перегляду періодичності подання регулярно оновлюваних звітів з безпеки лікарських засобів, вакцин, туберкуліну за міжнародною непатентованою назвою активного фармацевтичного інгредієнта або комбінацій активних фармацевтичних інгредієнтів
1. Періодичність подання регулярно оновлюваних звітів з безпеки лікарських засобів, вакцин, туберкуліну (далі — лікарські засоби) за міжнародною непатентованою назвою активного фармацевтичного інгредієнта або комбінацій активних фармацевтичних інгредієнтів (далі — періодичність подання регулярних звітів з безпеки) складається і переглядається державним підприємством «Державний експертний центр Міністерства охорони здоров’я України» (далі — Центр).
2. Періодичність подання регулярних звітів з безпеки оприлюднюється на веб-сайті Центру та містить таку інформацію:
1) міжнародна непатентована назва (далі — МНН) активного фармацевтичного інгредієнта (далі — АФІ) або комбінацій АФІ;
2) строки подання регулярно оновлюваних звітів з безпеки за МНН АФІ або комбінацій АФІ;
3) кінцева дата для включення даних до регулярного звіту з безпеки за певний період;
4) кінцева дата подання регулярних звітів з безпеки;
5) дата публікації.
3. Критерії визначення періодичності подання регулярних звітів з безпеки:
1) інформація щодо ризиків чи користі, що може вплинути на здоров’я та життя пацієнтів;
2) новий лікарський засіб, щодо якого наразі немає вичерпної інформації з безпеки (включаючи дореєстраційний та післяреєстраційний досвід);
3) значні зміни лікарського засобу (наприклад, зареєстровано нове показання, нова форма випуску чи спосіб застосування, що розширюють популяцію пацієнтів, які застосовують лікарський засіб);
4) вразливі / недостатньо вивчені популяції пацієнтів, відсутня інформація (наприклад, діти, вагітні жінки), коли такі популяції пацієнтів ймовірно можуть застосовувати лікарський засіб у післяреєстраційному періоді;
5) сигнал про потенційну загрозу або потенційна загроза неправильного застосування, лікопов’язаної помилки, ризику передозування або залежності від лікарського засобу;
6) наявність даних з безпеки застосування лікарського засобу;
7) лікарські засоби, що підлягають додатковому моніторингу.
4. Критерії перегляду періодичності подання регулярних звітів з безпеки:
1) поява / виявлення нової інформації щодо властивостей (складових) лікарського засобу, що може вплинути на співвідношення користь / ризик АФІ або комбінацій АФІ та потенційно на здоров’я населення чи громадське здоров’я;
2) будь-яка зміна критеріїв, що використовуються для визначення періодичності подання регулярних звітів з безпеки;
3) на вимогу заявника з причин, що стосуються здоров’я населення чи громадського здоров’я; з метою уникнення дублювання оцінки; для досягнення міжнародної гармонізації;
4) новий зареєстрований АФІ.
5. У разі потреби заявники подають заяви на відповідні зміни до реєстраційних матеріалів протягом дії реєстраційного посвідчення у визначеному законодавством порядку, крім випадків, коли реєстраційне посвідчення містить пряме посилання на періодичність подання регулярних звітів з безпеки.
Додаток 11
до Порядку здійснення фармаконагляду
(пункт 4 глави 1 розділу V)
СТРУКТУРА
майстер-файла системи фармаконагляду заявника
Титульна сторінка.
Опис системи фармаконагляду за розділами:
I. Інформація про уповноважену особу з фармаконагляду
II. Інформація про організаційну структуру заявника/власника реєстраційного посвідчення
III. Інформація про джерела даних з безпеки
IV. Інформація про комп’ютеризовані системи і бази даних
V. Інформація про процеси фармаконагляду
VI. Інформація про продуктивність системи фармаконагляду
VII. Інформація про систему якості у фармаконагляді
Додатки.
ВИМОГИ ДО ЗАПОВНЕННЯ
майстер-файла
Титульна сторінка повинна містити таку інформацію:
унікальний номер;
найменування заявника/власника реєстраційного посвідчення;
П.І.Б. уповноваженої особи, відповідальної за описану систему фармаконагляду;
найменування третьої сторони/інших заявників/власників реєстраційного посвідчення (якщо є) у разі спільного використання системи фармаконагляду;
П.І.Б. уповноваженої особи, відповідальної за описану систему фармаконагляду, третьої сторони/інших заявників/власників реєстраційного посвідчення (якщо є) у разі спільного використання системи фармаконагляду;
перелік майстер-файлів системи фармаконагляду (далі — МФСФ) заявника/власника реєстраційного посвідчення (для лікарських засобів, вакцин, туберкуліну (далі — лікарський засіб), що мають різні системи фармаконагляду);
дата складання або останнього оновлення.
Опис системи фармаконагляду за розділами:
I. Інформація про уповноважену особу з фармаконагляду
Надається інформація про УОВФ, включаючи контактну інформацію про неї, дані про кваліфікацію і досвід роботи, резюме з ключовою інформацією про роль УОВФ, переліком обов’язків для гарантування того, що УОВФ має достатні повноваження щодо створення системи фармаконагляду, підтримки та покращення її функціонування, у тому числі в Україні, відомостями про резервні механізми, що будуть задіяні у випадку відсутності УОВФ; інформація про КОВФ, у тому числі в Україні, якщо вона відмінна від УОВФ, включаючи контактну інформацію про неї, дані про кваліфікацію і досвід роботи; інформація щодо виконання обов’язків УОВФ/КОВФ у разі її відсутності (хвороба, відпустка) та інша інформація за наявності.
II. Інформація про організаційну структуру заявника/власника реєстраційного посвідчення
Надається опис організаційної структури власника реєстраційного посвідчення/заявника, у тому числі у розрізі здійснення фармаконагляду, який повинен містити інформацію щодо залучених підприємств, установ, організацій незалежно від форм власності та взаємозв’язків між ними, а також щодо третіх осіб, залучених до діяльності, пов’язаної зі здійсненням фармаконагляду. Зокрема, МФСФ повинен описувати:
організаційну структуру власника(ів) реєстраційного(их) посвідчення (посвідчень) із зазначенням позиції УОВФ в організації;
місце(я), де провадиться діяльність з фармаконагляду, що включає збір повідомлень про випадки побічних реакцій, їх оцінку, введення у базу даних з безпеки, генерування регулярно оновлюваних звітів з безпеки, виявлення та аналіз сигналів, підготовку та виконання плану управління ризиками, а також клінічними та неінтервенційними дослідженнями, внесення змін до реєстраційних матеріалів, що стосуються безпеки лікарського(их) засобу(ів) та/або системи фармаконагляду.
Інформація може бути подана у вигляді списку/таблиці із зазначенням залучених сторін, їх обов’язків та відповідних лікарських засобів і країн. Список має бути складений відповідно до постачальників послуг (наприклад, медична інформація, аудитори, організатори програм підтримки пацієнтів, управління даними досліджень тощо), договірних відносин (дистриб’ютори, партнери, спільний маркетинг тощо) та інших технічних послуг (хостинг комп’ютерних систем тощо). У додатках надається перелік договорів, а самі договори в частині предмета договору мають бути доступні на запит або під час проведення інспекцій та аудитів.
III. Інформація про джерела даних з безпеки
Надаються опис основних підрозділів зі збору даних з безпеки, що повинен включати інформацію стосовно усіх сторін, що відповідають за організований та спонтанний збір даних з безпеки лікарських засобів в місці здійснення організації діяльності з фармаконагляду. Джерела даних з безпеки мають включати дані будь-яких досліджень, реєстрів, спостережень чи програм підтримки, що фінансуються власником реєстраційного посвідчення, за допомогою яких можна накопичувати дані про побічні реакції, відсутність ефективності, будь-яку іншу інформацію з безпеки та ефективності лікарського засобу. Перелік джерел даних з безпеки має бути всеосяжним та включати усі поточні дослідження/програми, а також дослідження/програми, завершені протягом останніх двох років, і може міститися в додатках або надаватися окремо.
IV. Інформація про комп’ютеризовані системи і бази даних
Надаються опис розташування, функціональності та відповідальності за експлуатацію комп’ютеризованих систем та/або баз даних, що використовуються для отримання, обробки, запису та надання інформації з безпеки, а також оцінка здатності таких систем і баз даних для виконання фармаконагляду заявником. Якщо використовуються декілька комп’ютеризованих систем та/або баз даних, їх придатність для діяльності з фармаконагляду має бути описана з урахуванням ступеня комп’ютеризації в рамках системи фармаконагляду. Також має бути описаний валідаційний статус баз даних. Інформація про процедури контролю внесення змін, характер тестування, процедури резервування та електронні сховища даних, важливих для відповідності фармаконагляду, повинна бути включена в узагальнену інформацію. Крім того, має бути зазначений характер доступної документації. Для систем на основі паперових носіїв (коли електронна система може використовуватися тільки для подання термінових повідомлень про побічні реакції) мають бути описані порядок ведення даних і механізми забезпечення цілісності та доступності даних про безпеку, зокрема узагальнення інформації про побічні реакції лікарських засобів.
V. Інформація про процеси фармаконагляду
Надається опис етапів обробки даних і записів для здійснення фармаконагляду, що охоплює такі аспекти (але не виключно):
безперервний моніторинг профілю користь/ризик лікарського(их) засобу(ів), результати оцінки, процес прийняття рішень для вжиття відповідних заходів; генерація сигналу, його виявлення й оцінка, а також перелік стандартних операційних процедур (далі — СОП), інструкцій, робочих інструкцій, що стосуються вихідних даних бази даних з безпеки, взаємодії з іншими структурними підрозділами заявника тощо;
система(и) управління ризиками і моніторинг результатів заходів з мінімізації ризиків. До цієї діяльності можуть бути залучені декілька структурних підрозділів заявника і їх взаємодія має бути регламентована в СОП або договорах;
збір повідомлень про індивідуальні випадки, пов’язані з безпекою, узагальнення даних повідомлень, подальше відстеження (follow-up), оцінка та звітування. Процедури, що при цьому застосовуються, повинні уточнювати діяльність на центральному та національному рівнях;
планування строків генерації регулярно оновлюваних звітів з безпеки, їх підготовка та подання;
інформування з питань безпеки споживачів, спеціалістів системи охорони здоров’я та уповноваженого органу;
внесення змін з безпеки до інструкції для медичного застосування. Процедури мають охоплювати як внутрішню, так і зовнішню взаємодію з питань безпеки.
Опис повинен супроводжуватися переліком СОП, інструкцій, робочих інструкцій щодо контролю відповідності, а також поєднання з іншими напрямами роботи, що включає (але не виключно) функціональні обов’язки та відповідальність УОВФ/КОВФ, відповіді на запити уповноваженого органу про надання інформації, пошук у медичній науковій літературі, контроль змін в базі даних з безпеки, договори про обмін даними з безпеки, архівування даних з безпеки, аудит фармаконагляду, контроль якості і навчання персоналу. Цей перелік може бути розміщений у додатках і має містити номер, заголовок, дату набрання чинності і тип документа (для усіх СОП, інструкцій, робочих інструкцій тощо). Має бути чітко ідентифіковано процедури, що стосуються постачальників послуг та третіх сторін. До переліку не вимагається включати документи, що стосуються відповідних вимог законодавства країни, де зареєстровано лікарський засіб, охоплений цією системою фармаконагляду, але їх перелік може вимагатися на законодавчому рівні країн, де зареєстровано лікарські засоби, що охоплені цією системою. Якщо жодна або лише деякі країни використовують спеціальні місцеві процедури, про це має бути вказано із зазначенням країн, де зареєстровано лікарські засоби, що охоплені цією системою.
VI. Інформація про продуктивність системи фармаконагляду
Надається опис моніторингу продуктивності системи фармаконагляду власника реєстраційного посвідчення/заявника, що застосовується. Необхідно описати і пояснити цільові показники продуктивності системи фармаконагляду. Перелік показників продуктивності потрібно надати у додатку до МФСФ разом з фактичними результатами оцінки такої ефективності. Така інформація може бути надана у вигляді цифрових даних/графіків, що ілюструють та підтверджують продуктивність системи фармаконагляду. МФСФ має включати опис методів моніторингу, що застосовуються, і містити щонайменше:
опис процедури оцінки коректності подання повідомлень про індивідуальні випадки, пов’язані з безпекою. У додатку потрібно надати цифрові дані/графіки, що ілюструють і підтверджують дотримання строків та своєчасність подання повідомлень про індивідуальні випадки, пов’язані з безпекою, у передньому році;
загальні відомості про подання регулярно оновлюваних звітів з безпеки до регуляторних органів (додаток має містити останні дані, що використовувалися власником реєстраційного посвідчення/заявником для оцінки відповідності строків подання таких звітів);
стислий опис методів, що використовуються для забезпечення своєчасності подання заяв на зміни з безпеки відповідно до внутрішніх граничних строків та строків, передбачених вимогами законодавства, а також дату та опис необхідних змін з безпеки, щодо яких заяви ще не були подані;
у відповідних випадках надаються узагальнені дані щодо дотримання зобов’язань з виконання плану управління ризиками або інших зобов’язань чи умов, що стосуються фармаконагляду, дотримання яких було умовою видачі реєстраційного посвідчення.
VII. Інформація про систему якості у фармаконагляді
Опис управління системою якості потрібно надати в рамках структури організації і застосування системи якості до фармаконагляду. Такий опис має включати інформацію про:
контроль документації та записів (надається опис механізмів архівування електронних та/або друкованих версій МФСФ, повідомлень про індивідуальні випадки, пов’язані з безпекою, регулярно оновлюваних звітів з безпеки, планів управління ризиками, інших записів і документів, що стосуються фармаконагляду);
процедурні документи (надається загальний опис документів, що використовуються у фармаконагляді (СОП, інструкції, робочі інструкції тощо), описується доступність різних документів в рамках підприємств, установ, організацій незалежно від форм власності, а також методів контролю їх доступності, впровадження та супроводу; надаються дані щодо системи ведення документації, що використовуються для відповідних процесуальних документів під контролем третіх осіб);
навчання (надається опис управління ресурсами для виконання діяльності з фармаконагляду (організаційна структура із зазначенням кількості персоналу заявника, залученого до діяльності з фармаконагляду. Ці дані можуть бути надані в розділі, який описує організаційну структуру організації); наводиться стислий опис концепції навчання персоналу (не лише співробітників підрозділів з фармаконагляду, а й будь-яких працівників, які можуть отримувати повідомлення про індивідуальні випадки, пов’язані з безпекою), в тому числі посилання на розміщення навчальних файлів);
аудити (надається інформація про аудити забезпечення якості у системі фармаконагляду. У додатку потрібно надати опис методів, що використовуються для планування аудитів системи фармаконагляду, механізмів звітності і строків, а також перелік запланованих і проведених аудитів, що стосуються системи фармаконагляду. Цей перелік повинен містити дати проведення аудиту, подання звіту, мету та інформацію про аудити третіх сторін згідно з договірними відносинами, специфічних видів діяльності з фармаконагляду або підрозділів, що здійснюють діяльність з фармаконагляду, та інформацію про їх взаємодію з іншими підрозділами організації, діяльність яких пов’язана із виконанням зобов’язань з фармаконагляду, і має охоплювати 5-річний період.
МФСФ повинен також містити стислу інформацію про всі аудити, в результаті яких було виявлено суттєві та критичні невідповідності, із наданням стислого опису коригуючих та/або запобіжних заходів щодо таких невідповідностей, зазначенням дат їх виявлення та очікуваних дат їх усунення з перехресним посиланням на звіт з аудиту та задокументований(і) план(и) коригуючих та інших заходів.
У переліку проведених аудитів, що надається у додатках, має бути позначено ті аудити, інформація про які міститься в МФСФ. Стисла інформація про аудити, в результаті яких було виявлено критичні дані, та стислий опис коригуючих і запобіжних заходів мають міститися в МФСФ доти, доки не буде досягнуто позитивного результату після вжиття коригуючих дій та/або надано підтвердження незалежною стороною про істотне покращення системи. Доповнення, зміни або видалення інформації про аудити в МФСФ мають реєструватися в журналі коригування.
Як засіб управління системою фармаконагляду та підстави для проведення аудиту МФСФ має також описувати процес обліку, управління та усунення виявлених відхилень в системі якості, а також документувати відхилення від процедур фармаконагляду, їх вплив і управління ними з дня їх вирішення. Відхилення можна документувати у вигляді переліку з посиланням на звіт про відхилення, його дату та процедуру.
Опис системи фармаконагляду передбачає наявність посилань на нормативно-правові акти, на підставі яких розроблена і функціонує система фармаконагляду, та стислого опису власника реєстраційного посвідчення/заявника.
Інформація у МФСФ має бути подана згідно зі структурою та змістом додатків. Додаток Е не може бути перейменований у додаток D у випадку, коли додаток щодо комп’ютеризованих систем і баз даних не використовується, додаток D має бути позначений у змісті до МФСФ як невикористаний для того, щоб одержувачі МФСФ були впевнені, що такий додаток відсутній не внаслідок помилки.
Інформація у додатках до МФСФ має бути подана відповідно до його розділів, в яких є посилання на відповідний додаток, та містити такі відомості (але не виключно):
додаток А до розділу I. Інформація про уповноважену особу з фармаконагляду;
додаток В до розділу II. Інформація про організаційну структуру заявника/власника реєстраційного посвідчення;
додаток С до розділу III. Інформація про джерела даних з безпеки;
додаток D до розділу IV. Інформація про комп’ютеризовані системи і бази даних;
додаток Е до розділу V. Інформація про процеси фармаконагляду (переліки СОП, інструкцій, робочих інструкцій);
додаток F до розділу VI. Інформація про продуктивність системи фармаконагляду (переліки показників ефективності, поточні результати оцінки ефективності відносно показників);
додаток G до розділу VII. Інформація про систему якості у фармаконагляді (графік аудитів, перелік проведених та завершених аудитів, інформація щодо застосованих заходів);
додаток H до опису системи фармаконагляду (перелік лікарських засобів, що охоплені цією системою фармаконагляду);
додаток I. Контроль документації та записів (журнал коригування, документація щодо історії змін змісту (відповідно проіндексовані) та опис таких змін).
Додаток 12
до Порядку здійснення фармаконагляду
(пункт 1 глави 3 розділу V)
СТРУКТУРА
регулярно оновлюваного звіту з безпеки лікарського засобу, вакцини, туберкуліну
Титульна сторінка
Загальні положення
Зміст регулярно оновлюваного звіту з безпеки
I. Вступ
II. Міжнародний реєстраційний статус
III. Заходи з безпеки, вжиті протягом звітного періоду
IV. Зміни у довідковій інформації з безпеки
V. Оцінка експозиції та схем застосування
V.1. Кумулятивна експозиція учасників клінічних випробувань
V.2. Кумулятивна та інтервальна експозиція пацієнтів у післяреєстраційному періоді
VI. Дані зведених таблиць
VI.1. Довідкова інформація
VI.2. Кумулятивні зведені таблиці про серйозні побічні явища, що виявлені під час клінічних випробувань
VI.3. Кумулятивні та інтервальні зведені таблиці згідно з даними щодо безпеки, отриманими у післяреєстраційному періоді
VII. Резюме значущих результатів клінічних випробувань протягом звітного періоду
VII.1. Завершені клінічні випробування
VII.2. Поточні клінічні випробування
VII.3. Тривале спостереження
VII.4. Інше терапевтичне застосування лікарського засобу, вакцини, туберкуліну (якщо застосовано)
VII.5. Нові дані з безпеки, пов’язані з фіксованим комбінованим лікуванням
VIII. Результати неінтервенційних досліджень
IX. Інформація з інших клінічних випробувань та джерел
IX.1. Інші клінічні випробування
IX.2. Помилки, пов’язані з лікарським засобом, вакциною, туберкуліном
X. Неклінічні дані
XI. Дані з літератури
XII. Інші регулярно оновлювані звіти з безпеки
XIII. Відсутність ефективності у контрольованих клінічних випробуваннях
XIV. Інформація, отримана в останній момент
XV. Огляд сигналів (нові, поточні та закриті)
XVI. Оцінка сигналів та ризиків
XVI.1. Резюме проблем безпеки
XVI.2. Оцінка сигналів
XVI.3. Оцінка ризиків та нової інформації
XVI.4. Характеристика ризиків
XVI.5. Ефективність заходів з мінімізації ризиків (якщо застосовано)
XVII. Оцінка користі
XVII.1. Важлива базова інформація з ефективності
XVII.2. Нова виявлена інформація з ефективності
XVII.3. Характеристика користі
XVIII. Комплексний/інтегрований аналіз співвідношення користь/ризик для зареєстрованих показань
XVIII.1. Контекст співвідношення користь/ризик (медична необхідність та важливі альтернативи)
XVIII.2. Оцінка аналізу співвідношення користь/ризик
XIX. Висновки та заходи
XX. Додатки до регулярно оновлюваного звіту з безпеки
ВИМОГИ ДО ЗАПОВНЕННЯ РЕГУЛЯРНО ОНОВЛЮВАНОГО ЗВІТУ З БЕЗПЕКИ
Титульна сторінка
Титульна сторінка має містити назву(и) лікарського(их) засобу(ів), вакцини (вакцин), туберкуліну (далі — лікарський засіб) (для регулярно оновлюваних звітів з безпеки (далі — регулярний звіт з безпеки), що включають декілька лікарських засобів, з практичних причин цю інформацію можна надавати на супровідній до титульної сторінки сторінці регулярного звіту з безпеки) та активного фармацевтичного інгредієнта (далі — АФІ), міжнародну дату народження лікарського засобу, звітний період, дату складання звіту, інформацію про заявника та твердження про конфіденційність інформації, що надана у регулярному звіті з безпеки.
Титульна сторінка має бути засвідчена підписом особи, яка склала регулярний звіт з безпеки.
Основні положення
Надається стислий виклад змісту та найбільш важливої інформації, що надана у регулярному звіті з безпеки:
вступ і звітний період;
лікарський(і) засіб (засоби), хіміко-терапевтична або фармакологічна група(и), механізм(и) дії, показання, форми випуску, доза(и) та спосіб (способи) застосування;
узагальнена оцінка кумулятивного впливу лікарського засобу на учасників клінічних випробувань;
узагальнена оцінка кумулятивного та інтервального впливу лікарського засобу на пацієнтів у післяреєстраційному періоді;
кількість країн, в яких лікарський засіб зареєстровано;
резюме загальної оцінки аналізу співвідношення користь/ризик (на основі даних, наданих у підрозділі XVIII.2 «Оцінка аналізу співвідношення користь/ризик» регулярного звіту з безпеки цього додатку);
вжиті та пропоновані заходи з питань безпеки (наприклад, важливі зміни до інформації про лікарський засіб чи інші заходи з мінімізації ризиків);
висновки.
Зміст регулярно оновлюваного звіту з безпеки
Розділ I. Вступ
Регулярний звіт з безпеки має бути автономним документом, але пов’язаним з попереднім регулярним звітом з безпеки шляхом стислого опису лікарського(их) засобу(ів), вакцини, туберкуліну та інших важливих даних. Вступ має містити таку інформацію:
міжнародна дата народження лікарського засобу та звітний період;
лікарський(і) засіб (засоби), хіміко-терапевтична або фармакологічна(і) група(и), механізм(и) дії, затверджене(і) показання, форма(и) випуску, доза(и) та спосіб (способи) застосування;
стислий опис пролікованих та досліджуваних популяцій.
Розділ II. Міжнародний реєстраційний статус
Надається стислий опис із зазначенням дати першої реєстрації у світі, показання, зареєстрованої(их) дози (доз), країни реєстрації лікарського засобу.
Розділ III. Заходи з безпеки, вжиті протягом звітного періоду
Надається опис важливих заходів з безпеки, що були вжиті у світі протягом звітного періоду власником реєстраційного посвідчення, спонсорами клінічних випробувань, етичними комітетами чи уповноваженими органами (незалежно від того, стосувалися вони застосування лікарського засобу, чи ні) при проведенні випробувань чи у післяреєстраційний період та мали значний вплив на співвідношення користь/ризик зареєстрованого лікарського засобу, та/або на проведення окремого клінічного випробування, та/або на загальну програму клінічних випробувань.
Слід надати обґрунтування кожного заходу та за необхідності включити до регулярного звіту з безпеки будь-яку додаткову важливу інформацію. У цьому розділі надаються в узагальненому вигляді відповідні оновлення до попередніх заходів з питань безпеки (наприклад, заходи, пов’язані із застосуванням лікарського засобу з дослідницькою метою (відмова у реєстрації клінічного випробування з етичних причин або з міркувань безпеки); часткове (може включати декілька заходів (наприклад, припинення досліджень повторних доз, але продовження досліджень однієї дози; припинення досліджень за одним показанням, але продовження за іншим та/або припинення застосування певної схеми прийому у дослідженні)) або повне припинення клінічного випробування або дострокове припинення поточного клінічного випробування з причин безпеки або відсутності ефективності; відкликання досліджуваного лікарського засобу або препарату порівняння; відмова у реєстрації для досліджуваних показань, включаючи добровільне відкликання заяви на реєстрацію; заходи з управління ризиками; заходи, пов’язані з досвідом перебування на ринку (відмова у перереєстрації чи неподання заяви на перереєстрацію; відкликання або призупинення дії реєстраційного посвідчення; заходи, вжиті через проблеми, пов’язані з якістю; призупинення постачання лікарського засобу власником реєстраційного посвідчення; заходи з управління ризиками)).
Розділ IV. Зміни у довідковій інформації з безпеки
Мають бути перелічені будь-які значні зміни до довідкової інформації з безпеки у звітний період. Такі зміни можуть стосуватися протипоказань, особливостей застосування, застережень, серйозних побічних реакцій, взаємодій, важливих результатів поточних чи завершених клінічних випробувань або важливих результатів неклінічних досліджень (наприклад, дослідження канцерогенності). Інформація стосовно таких змін повинна надаватися у відповідних розділах регулярного звіту з безпеки.
Розділ V. Оцінка експозиції та схем застосування
Надається точна оцінка популяцій, які піддавалися впливу лікарського засобу, включаючи обсяги продажів та кількість призначень. Така оцінка має супроводжуватися якісним та кількісним аналізом фактичного застосування лікарського засобу, який повинен (за потреби) показувати, наскільки фактичне застосування відрізняється від показаного на підставі всіх даних, доступних власнику реєстраційного посвідчення, включаючи результати обсерваційних досліджень чи досліджень застосування. Надається стислий опис методу(ів), що використовувався(лись) для підрахунку експозиції суб’єктів/пацієнтів, із зазначенням обмежень такого методу. Для підрахунку експозиції суб’єктів/пацієнтів у всіх регулярних звітах з безпеки для одного й того самого лікарського засобу слід використовувати одинакові методи. Якщо з об’єктивних причин метод був змінений, обидва методи та розрахунки потрібно надавати у регулярних звітах з безпеки із зазначенням такої зміни та будь-якої важливої відмінності між результатами при використанні обох методів.
Підрозділ V.1. Кумулятивна експозиція учасників клінічних випробувань
Цей підрозділ повинен містити інформацію про суб’єктів клінічних випробувань, спонсорованих власником реєстраційного посвідчення, подану (за можливості) у вигляді таблиці, а саме:
сукупна кількість учасників поточних та завершених клінічних випробувань, які піддавалися впливу досліджуваного лікарського засобу, плацебо та/або препарату(ів) порівняння, починаючи з міжнародної дати народження лікарського засобу, що перебуває в стадії розробки;
детальні дані про експозицію учасників клінічних випробувань (наприклад, дані, згруповані за віком, статтю та расовою приналежністю, для всієї програми випробування);
якщо можливо, в таблицях має бути зазначено суттєві розбіжності у випробуваннях у дозах, способах застосування чи популяціях пацієнтів. Можна також використовувати окремі таблиці;
якщо клінічні випробування проводилися або проводяться у спеціальних популяціях (наприклад, вагітні жінки, пацієнти з нирковою, печінковою чи серцевою недостатністю або пацієнти з відповідним генетичним поліморфізмом), необхідно надати дані про їх експозицію;
якщо існують значні розбіжності у тривалості експозиції між суб’єктами, рандомізованими до досліджуваного лікарського засобу чи компаратора, або у разі невідповідності щодо тривалості експозиції у різних клінічних випробуваннях потрібно надати інформацію про експозицію препарату у суб’єкто-часі (суб’єкто-днях, суб’єкто-місяцях або суб’єкто-роках);
експозиція досліджуваного лікарського засобу у здорових добровольців може бути менш важливою для оцінки загального профілю безпеки (залежно від типу побічної реакції, зокрема, у разі застосування суб’єктами однієї дози). Такі дані можуть бути надані окремо з відповідним поясненням;
якщо серйозні побічні явища, виявлені під час клінічних випробувань, надані у зведених таблицях за показаннями, експозиція пацієнтів має бути також наведена за показаннями (за можливості);
для окремих особливо важливих досліджень демографічні характеристики мають надаватися окремо.
Підрозділ V.2. Кумулятивна та інтервальна експозиція пацієнтів у післяреєстраційному періоді
Надаються кумулятивна експозиція (з міжнародної дати народження) та інтервальна експозиція (з моменту закриття бази даних попереднього регулярного звіту з безпеки). У випадку неможливості оцінити експозицію пацієнтів надається пояснення причин цього. У такому випадку, якщо можливо, надаються альтернативні розрахунки експозиції, а також методика(и) їх отримання. Для обчислення експозиції лікарського засобу можна також використовувати встановлену добову дозу (DDD).
Дані мають бути подані відповідно до таких категорій:
післяреєстраційна (неінтервенційні дослідження) експозиція (надається підрахована загальна експозиція пацієнтів. За можливості дані повинні бути розподілені за статтю, віком, показаннями, дозами, формою випуску тощо. Залежно від лікарського засобу може бути важливим розподіл за іншими параметрами — кількість курсів вакцинації, спосіб (способи) застосування та тривалість лікування. Якщо існують повідомлення про побічні реакції, що вказують на нову інформацію з безпеки, за можливості надаються дані експозиції препарату в межах формування відповідних підгруп);
післяреєстраційне застосування у спеціальних популяціях (якщо у післяреєстраційному періоді лікарський засіб застосовувався у спеціальних популяціях, надається інформація про загальну кількість пацієнтів, які його застосовували, та метод підрахунку. Джерела таких даних можуть включати неінтервенційні дослідження, що проводилися з метою отримання такої інформації, в тому числі реєстри, дані, зібрані не в умовах дослідження, включаючи інформацію, зібрану методом спонтанних повідомлень (наприклад, у цьому пункті може бути узагальнена інформація з повідомлень про вплив лікарського засобу в період вагітності без зв’язку з побічними реакціями). Популяції, які необхідно розглянути, включають (але не виключно) такі: педіатрична популяція; пацієнти похилого віку; вагітні або жінки, які годують груддю; пацієнти з печінковою та/або нирковою недостатністю; пацієнти з іншими відповідними супутніми захворюваннями; пацієнти з тяжкістю захворювання, що відрізняється від тієї, що досліджувалась у клінічних випробуваннях; субпопуляції з відповідним генетичним поліморфізмом(ами); пацієнти специфічного расового та/або етнічного походження);
інше застосування лікарського засобу у післяреєстраційному періоді (якщо власник реєстраційного посвідчення має інформацію про схеми застосування лікарського засобу, що можуть бути регіональними та вважаються важливими для інтерпретації даних з безпеки, необхідно надати їх стислий опис. Якщо ці дані впливають на оцінку безпеки та/або співвідношення користь/ризик, отримана інформація про схеми застосування без зареєстрованих побічних реакцій повинна бути узагальнено подана у цьому підрозділі. Така інформація може бути отримана за допомогою системи спонтанних повідомлень, запитів на надання медичної інформації, скарг пацієнтів чи за допомогою інших інформаційних джерел. Якщо відомі кількісні показники таких даних, необхідно викласти їх у цьому підрозділі. Якщо відомо, власник реєстраційного посвідчення має стисло прокоментувати, чи може бути пов’язане застосування лікарського засобу не у відповідності до довідкової інформації про нього з клінічними настановами, результатами клінічних досліджень, чи воно зумовлене відсутністю зареєстрованого альтернативного лікування. З метою виявлення схем застосування не у відповідності до довідкової інформації про лікарський засіб власник реєстраційного посвідчення має використовувати відповідні розділи довідкової інформації про лікарський засіб, що була дійсною на момент завершення звітного періоду (регулярного звіту з безпеки) (наприклад, зареєстровані показання, спосіб застосування, протипоказання). Виявлені з таких даних чи джерел інформації сигнали і ризики повинні розглядатися у відповідних розділах регулярного звіту з безпеки).
Розділ VI. Дані зведених таблиць
Надаються дані з безпеки у вигляді зведених таблиць щодо серйозних побічних явищ з клінічних досліджень, спонтанних повідомлень про серйозні та несерйозні реакції з післяреєстраційного досвіду застосування препарату (включаючи повідомлення працівників з медичною та фармацевтичною освітою, споживачів, дані з медичної наукової літератури, повідомлення уповноважених органів (на міжнародному рівні), дані про серйозні реакції з неінтервенційних досліджень та інших неінтервенційних джерел інформації про побічні реакції). При кодуванні термінів побічних явищ/реакцій з використанням медичного словника для регуляторної діяльності (Medical Dictionary for Regulatory Activities (MedDRA)) у зведених таблицях необхідно надавати дані на рівні термінів переважного застосування (preferred term (PT)) та класів систем і органів (system organ class (SOC)). Серйозність побічних явищ/реакцій у зведених таблицях повинна відповідати серйозності явищ/реакцій у повідомленнях про індивідуальні випадки побічних реакцій, що визначається із застосуванням критеріїв, наведених в ICH-E2А (ICH-E2А. Управління даними з клінічної безпеки: визначення та стандарти для термінового повідомлення). Якщо серйозні та несерйозні явища/реакції належать до одного й того самого випадку, у зведених таблицях необхідно надати інформацію про серйозність кожної реакції. Не можна змінювати серйозність побічного явища/реакції спеціально для підготовки регулярного звіту.
Підрозділ VI.1. Довідкова інформація
Вказується(ються) версія(ї) довідкової інформації (словника), що використовувалася(ися) для кодування побічних явищ/реакцій.
Підрозділ VI.2. Кумулятивні зведені таблиці про серйозні побічні явища, що виявлені під час клінічних випробувань
Надаються основні дані для додатка, у якому наводяться зведені таблиці серйозних побічних реакцій з клінічних досліджень власника реєстраційного посвідчення, починаючи з міжнародної дати розробки до дати закриття бази даних поточного регулярного звіту. Власник реєстраційного посвідчення повинен надавати пояснення з приводу будь-якого невключення даних до таблиць (наприклад, дані клінічного дослідження можуть бути недоступними для препаратів, присутніх на ринку впродовж багатьох років). Таблиці мають бути структуровані за MedDRA на рівні SOC (впорядкованими згідно з міжнародними правилами) як для досліджуваного препарату, так і для груп(и) препаратів порівняння (препарати порівняння, плацебо), що використовувалися у програмі клінічних досліджень. Дані можуть бути зібрані з усієї програми. Якщо доцільно та можливо, дані можуть бути розподілені за дослідженнями, показаннями, способами застосування чи за іншими параметрами. Цей підрозділ не повинен використовуватися для надання аналізу чи висновків на підставі серйозності побічних явищ.
При підготовці цього підрозділу потрібно враховувати таке:
оцінка причинно-наслідкового зв’язку зазвичай корисна для оцінки індивідуальних випадків рідкісних побічних реакцій. Ця оцінка має меншу цінність для аналізу узагальнених даних, коли стає можливим групове порівняння частоти випадків, тому до зведених таблиць потрібно включати усі серйозні побічні явища, а не лише серйозні побічні реакції досліджуваних препарату, компараторів та плацебо. Може бути доцільним надавати частоту відповідно до доз;
в цілому таблиці серйозних побічних явищ з клінічних досліджень повинні містити лише терміни, що використовувалися для визначення оцінки випадку як серйозного, а несерйозні побічні явища мають бути включені до звітів з дослідження;
таблиці повинні містити дані сліпих та відкритих клінічних досліджень. Інформація про серйозні побічні явища може формуватися із завершених досліджень та з індивідуальних випадків, що були виведені із сліпого дослідження з міркувань безпеки (наприклад, термінове повідомлення). Спонсорами клінічних досліджень та власниками реєстраційних посвідчень заборонено розкривати дані сліпих досліджень з метою підготовки регулярного звіту;
деякі побічні явища можуть бути виключені зі зведених таблиць клінічних досліджень, але у звіті такі виключення необхідно обґрунтувати (наприклад, побічні явища, які були визначені у протоколі як такі, що не підлягають спеціальному збору та внесенню до бази даних з безпеки, оскільки їх розвиток передбачався у популяції пацієнтів, а також ті, що представляють кінцеві точки клінічного дослідження (наприклад, повідомлення про смерть при дослідженні препарату для лікування застійної серцевої недостатності, коли смерть незалежно від її причини є первинною кінцевою точкою, чи прогресування захворювання у дослідженнях лікування онкології)).
Підрозділ VI.3. Кумулятивні та інтервальні зведені таблиці згідно з даними щодо безпеки, отриманими у післяреєстраційному періоді
Надаються основні дані для додатка, у якому надаються кумулятивні та інтервальні зведені таблиці побічних реакцій, зібраних за період від міжнародної дати народження лікарського засобу до дати закриття бази даних поточного регулярного звіту. Ці побічні реакції, отримані зі спонтанних повідомлень, що включають повідомлення працівників з медичною та фармацевтичною освітою, споживачів, дані з наукової літератури, повідомлення уповноважених органів, а також обов’язкові повідомлення з неінтервенційних досліджень (ICH-E2D. Управління даними з безпеки у післяреєстраційному періоді: визначення та стандарти для термінового повідомлення). Дані щодо серйозних та несерйозних реакцій зі спонтанних джерел, а також серйозних побічних реакцій з неінтервенційних досліджень та інших неінтервенційних джерел потрібно надавати в одній таблиці поряд з інтервальними та кумулятивними. Таблицю слід структурувати згідно з MedDRA на рівні SOC (впорядкувати згідно з міжнародними правилами). Дані зі специфічних проблем безпеки можуть бути надані у додаткових таблицях з розподілом за показаннями, способом застосування препарату чи іншими параметрами. У цьому підрозділі регулярного звіту не потрібно надавати аналіз чи висновки на підставі даних зведених таблиць.
Розділ VII. Резюме важливих результатів клінічних досліджень протягом звітного періоду
Надається стислий опис клінічно важливих результатів з ефективності та безпеки лікарського засобу, отриманих за звітний період із спонсорованих власником реєстраційного посвідчення клінічних досліджень, із джерел, зазначених у підрозділах, що викладаються нижче. Якщо можливо і доцільно, дані потрібно розподілити за статтю та віком (особливо діти у порівнянні з дорослими), показанням, дозою та адміністративно-територіальною одиницею.
Сигнали із джерел клінічних досліджень потрібно звести у таблиці в розділі XV регулярного звіту з безпеки «Огляд сигналів (нові, поточні та закриті)». Оцінка сигналів незалежно від того, чи це спростований сигнал, чи потенційний, чи виявлений ризик, що були закриті за звітний період, повинна бути надана у підрозділі ХVI.2 «Оцінка сигналів» регулярного звіту з безпеки. Нова інформація стосовно відомих потенційних чи виявлених ризиків, що не підпадає під поняття нового виявленого сигналу, повинна оцінюватися і характеризуватися у підрозділах ХVI.3 «Оцінка ризиків та нової інформації» і ХVI.4 «Характеристика ризиків» відповідно.
Результати клінічних досліджень, що не спонсорувалися власником реєстраційного посвідчення, мають описуватися у відповідних розділах регулярного звіту з безпеки.
Якщо інформація з клінічних досліджень про відсутність ефективності для лікування захворювань, що не загрожують життю, відповідно до зареєстрованих показань впливає на оцінку співвідношення користь/ризик, її необхідно стисло викласти у цьому розділі.
Інформація щодо відсутності ефективності лікарського засобу, отримана з клінічних досліджень, у яких препарат використовувався для лікування та профілактики серйозних або таких, що загрожують життю, захворювань, має узагальнюватися у розділі ХІІІ «Відсутність ефективності у контрольованих клінічних дослідженнях» регулярного звіту з безпеки.
Інформація з інших клінічних досліджень має бути включена до підрозділу IX.1 регулярного звіту з безпеки.
Крім того, власник реєстраційного посвідчення повинен навести у додатку перелік спонсорованих ним за звітний період завершених та поточних післяреєстраційних інтервенційних досліджень, основною метою яких було виявити, характеризувати чи кількісно визначити загрозу безпеці або підтвердити профіль безпеки лікарського засобу.
Перелік має містити щодо кожного дослідження таку інформацію:
ідентифікатор дослідження (наприклад, номер протоколу чи інший ідентифікатор);
назва дослідження (абревіатурна назва дослідження, якщо застосовується);
вид дослідження (наприклад, рандомізоване клінічне дослідження, когортне дослідження, дослідження випадок-контроль);
досліджувана популяція, включаючи країну та інші відповідні характеристики популяції (наприклад, педіатрична популяція або дослідження пацієнтів з нирковою недостатністю);
дата початку (визначена власником реєстраційного посвідчення) і планована дата завершення;
етап клінічного дослідження (триває (клінічне дослідження почалося) чи завершене (завершено написання звіту про клінічне дослідження)).
Підрозділ VII.1. Завершені клінічні дослідження
Надається стислий опис клінічно важливих результатів з ефективності та безпеки, отриманих з клінічних досліджень, завершених у звітний період. Ця інформація може бути подана у вигляді опису чи синопсису. Підрозділ може включати інформацію, яка підтверджує або спростовує попередні виявлені проблеми безпеки, а також докази нових сигналів з безпеки.
Підрозділ VII.2. Поточні клінічні дослідження
Якщо власнику реєстраційного посвідчення відомі клінічно важливі результати ефективності та безпеки, виявлені у поточних клінічних дослідженнях (наприклад, при проміжному аналізі даних з безпеки або внаслідок виведення із сліпого дослідження пацієнтів з побічними явищами), їх необхідно стисло узагальнити у цьому підрозділі. Це може бути інформація, що підтверджує чи спростовує попередні ідентифіковані проблеми безпеки, а також підтверджує нові сигнали з безпеки.
Підрозділ VII.3. Тривале спостереження
Наводиться відома інформація про тривале спостереження за суб’єктами клінічних досліджень, зокрема, високотехнологічними препаратами (наприклад, продукти генної інженерії, клітинна терапія та тканинний інжиніринг).
Підрозділ VII.4. Інше терапевтичне застосування лікарського засобу
Викладається клінічно важлива інформація з безпеки, виявлена в інших програмах, що проводилися власником реєстраційного посвідчення за спеціальним протоколом, з обов’язковим поданням повідомлень про побічні реакції (наприклад, програми розширеного доступу, програми застосування незареєстрованого лікарського засобу при тяжких патологіях, програми застосування певними пацієнтами та інший організований збір даних).
Підрозділ VII.5. Нові дані з безпеки, пов’язані з фіксованим комбінованим лікуванням
Враховується таке:
якщо діюча речовина, що є предметом регулярного звіту з безпеки, також зареєстрована чи розробляється як компонент фіксованого комбінованого препарату чи схеми комбінованої терапії, потрібно резюмувати важливі результати з безпеки комбінованої терапії;
якщо сам препарат, що є предметом регулярного звіту, є фіксованою комбінацією, потрібно узагальнити важливу інформацію з безпеки окремих його компонентів (як вже зареєстрованих, так і тих, що перебувають у розробці).
Дані, специфічні для комбінації, можуть надаватися в окремому(их) розділі(ах) регулярного звіту з безпеки за одним чи за всіма його компонентами.
Розділ VIII. Результати неінтервенційних досліджень
Узагальнюється відповідна інформація з безпеки чи інформація, що має потенційний вплив на оцінку співвідношення користь/ризик, отримана за звітний період із спонсорованих власником реєстраційного посвідчення неінтервенційних досліджень (наприклад, обсерваційні дослідження, епідеміологічні дослідження, реєстри та програми активного фармаконагляду). До цього розділу також потрібно включати відповідну інформацію з досліджень щодо використання препаратів, якщо вона властива багатьом адміністративно-територіальним одиницям. Власник реєстраційного посвідчення має надати додаток з переліком спонсорованих ним неінтервенційних досліджень, головною метою яких було ідентифікувати, характеризувати або кількісно визначити загрозу безпеці, підтвердити профіль безпеки лікарського засобу або оцінити ефективність заходів з управління ризиками, що були завершені або продовжувалися протягом звітного періоду.
Заключні звіти досліджень, завершених у звітний період, досліджень, зазначених у розділі VII цього додатку, включаються до відповідного додатка регулярного звіту з безпеки. У цьому розділі можна також надавати підсумкову інформацію, що ґрунтується на оцінці сукупних даних, згенерованих з програм підтримки пацієнтів, якщо вона не надавалася в інших розділах регулярного звіту з безпеки. Сигнали і ризики, виявлені з інших інформаційних джерел, власник реєстраційного посвідчення має надавати у відповідних розділах регулярного звіту з безпеки.
Розділ IX. Інформація з інших клінічних досліджень та джерел
Підрозділ IX.1. Інші клінічні дослідження
Узагальнюється інформація стосовно оцінки співвідношення користь/ризик лікарського засобу, доступна з інших джерел клінічних випробувань/джерел дослідження, що стала відомою власнику реєстраційного посвідчення під час звітного періоду (наприклад, результати узагальненого або мета-аналізу рандомізованих клінічних випробувань, інформація з безпеки, надана партнерами або ініціаторами досліджень).
Підрозділ IX.2. Помилки, пов’язані з лікарським засобом
Узагальнюється інформація про помилки, пов’язані з лікарським засобом, і потенційні помилки, навіть якщо вони не пов’язані з розвитком небажаних ефектів. Потенційні помилки, пов’язані з лікарським засобом, — розпізнавання обставин, що можуть призводити до помилок, пов’язаних з лікарським засобом, і можуть як включати пацієнта, так і не включати. Помилки, пов’язані з призначенням чи застосуванням лікарського засобу, можуть допускатися пацієнтами, споживачами, медичними працівниками. Ця інформація може стосуватися інтерпретації даних з безпеки чи загальної оцінки співвідношення користь/ризик лікарського засобу.
Розділ X. Неклінічні дані
Узагальнюються основні результати з безпеки з неклінічних in vivo та in vitro (наприклад, дослідження канцерогенності, репродуктивності та імунотоксичності), поточних чи завершених у звітний період досліджень. Результати з досліджень, що проводилися з метою вивчення специфічних проблем безпеки, повинні включатися до регулярного звіту з безпеки незалежно від наслідків. Наслідки цих результатів повинні обумовлюватися у відповідних розділах регулярного звіту з безпеки.
Розділ XI. Дані з медичної наукової літератури
Відображаються нові та важливі дані з безпеки, що стосуються лікарського засобу, опубліковані у науковій медичній літературі або доступні у вигляді неопублікованих рукописів, про які стало відомо власнику реєстраційного посвідчення у звітний період.
Літературний пошук для регулярного звіту з безпеки має бути більш розширеним, ніж при пошуку випадків побічних реакцій, оскільки він повинен також включати дані з безпеки з досліджень для груп пацієнтів та для інших препаратів, що містять однакову діючу речовину. Наприклад, інформація з безпеки, яка повинна бути включена до регулярного звіту з безпеки, але яку можна не знайти шляхом літературного пошуку випадків побічних реакцій, а саме:
результати вагітності (включаючи її завершення) без несприятливих наслідків;
застосування у педіатричних популяціях;
застосування незареєстрованого препарату тяжко хворими чи поіменованими пацієнтами;
відсутність ефективності;
безсимптомне передозування, зловживання або неправильне застосування;
лікопов’язана помилка без виникнення побічних реакцій;
важливі неклінічні результати з безпеки.
Якщо доцільно, слід розглянути інформацію про інші діючі речовини того самого класу.
Розділ XII. Інші регулярно оновлювані звіти з безпеки
Заповнюється тільки для фіксованих комбінованих препаратів чи лікарських засобів з багатьма показаннями та/або формами випуску у випадках, коли за погодженням з уповноваженим органом готується декілька регулярних звітів з безпеки. У такому разі у цьому розділі також необхідно навести важливі результати з інших регулярних звітів з безпеки, якщо вони не наведені в інших розділах регулярного звіту з безпеки. Керуючись контрактними домовленостями, власник реєстраційного посвідчення повинен узагальнити важливі дані з регулярних звітів з безпеки, надані у звітний період іншими сторонами (наприклад, спонсорами або іншими контрактними партнерами), якщо такі є доступними.
Розділ XIII. Відсутність ефективності у контрольованих клінічних дослідженнях
Резюмуються дані клінічних досліджень, що вказують на відсутність ефективності чи відсутність ефективності, пов’язану з обраним видом терапії, для препаратів, призначених для лікування і профілактики серйозних чи таких, що загрожують життю, захворювань, та можуть відображати значний ризик для лікованої популяції.
Розділ XIV. Інформація, отримана в останній момент
Узагальнюються потенційно важливі дані з безпеки, ефекту та ефективності препарату, про які стало відомо після дати закриття бази даних, але під час підготовки регулярного звіту з безпеки. Наприклад, клінічно значущі нові публікації, важливі дані спостережень, клінічні токсикологічні дані та будь-які заходи, вжиті власником реєстраційного посвідчення або уповноваженим органом з міркувань безпеки. Нові повідомлення про випадки побічних реакцій непотрібно включати у регулярний звіт з безпеки, крім важливих репрезентативних випадків (тобто перший приклад важливого явища) або даних щодо важливих сигналів з безпеки, коли вони можуть надати додаткову інформацію для оцінки проблем безпеки, що вже наведені у регулярному звіті з безпеки. Потрібно також включати усі значні зміни до довідкової інформації про лікарський засіб (наприклад, нова побічна реакція, застереження або протипоказання), внесені у цей період.
Наведені дані потрібно також враховувати при оцінці ризиків та нової інформації.
Розділ XV. Огляд сигналів (нові, поточні та закриті)
Надається загальний опис сигналів, що були закриті (тобто їх оцінка завершена) протягом звітного періоду, а також поточних сигналів, оцінка яких ще продовжувалася на момент завершення звітного періоду. До регулярного звіту з безпеки сигнал має включатися одразу після проходження початкового скринінгу чи класифікації, якщо власник реєстраційного посвідчення вирішив проводити його подальшу оцінку. Сигнали можуть бути якісними чи кількісними. Джерелами сигналів можуть бути інформаційні запити чи розслідування з питань безпеки уповноваженими органами в усьому світі. Рішення стосовно класифікації цих сигналів і висновки з їх оцінки потребують медичного аналізу і наукової інтерпретації доступних даних. Новим сигналом вважається сигнал, виявлений у звітному періоді. Якщо у звітному періоді стає відомою нова клінічно важлива інформація стосовно раніше закритого сигналу, вона буде новим сигналом на підставі того, що новий аспект попередньо спростованого сигналу або визнаного ризику потребує подальших кроків для його верифікації. Залежно від стадії оцінки сигналу на момент завершення звітного періоду та подання регулярного звіту з безпеки новий сигнал може бути класифікований як закритий чи поточний.
У цьому розділі або у додатку надаються у вигляді таблиці усі сигнали, поточні чи закриті на момент завершення звітного періоду. Така таблиця має містити стислий опис сигналу, дату, коли стало відомо про сигнал, статус сигналу на момент завершення звітного періоду (закритий чи поточний), дату закриття сигналу, якщо сигнал закритий, джерело сигналу, стислий опис ключових даних, плани щодо подальшої оцінки, вжиті чи заплановані заходи. Непотрібно надавати детальну оцінку закритих сигналів.
Оцінку нової інформації, пов’язаної з будь-якими раніше відомими виявленими і потенційними ризиками, яка не вважається новим сигналом, потрібно надавати у підрозділі XVI.3 «Оцінка ризиків та нової інформації» регулярного звіту з безпеки.
Якщо уповноважений орган рекомендував, щоб специфічне питання, що не вважається сигналом, моніторувалося та про нього звітували у регулярному звіті з безпеки, необхідно узагальнити результати аналізу у цьому розділі, якщо вони негативні. У разі якщо специфічне питання стає сигналом, воно має бути включене у таблицю сигналів і проаналізоване у підрозділі XVI.2 «Оцінка сигналів» регулярного звіту з безпеки.
Потрібно також включати усі значні зміни до довідкової інформації щодо лікарського засобу (наприклад, нова побічна реакція, застереження або протипоказання), внесені у цей період (розділ IV регулярного звіту з безпеки). Викладені у цьому розділі дані потрібно також враховувати при оцінці ризиків та нової інформації (підрозділі XVI.3 регулярного звіту з безпеки).
Розділ XVI. Оцінка сигналів та ризиків
Надаються стислий опис відомих даних про важливі виявлені і потенційні ризики і відсутня на початок звітного інтервалу інформація, що охоплює регулярний звіт з безпеки; оцінка усіх сигналів, закритих протягом звітного періоду; оцінка нової інформації стосовно раніше ідентифікованих і потенційних ризиків; оновлена характеристика важливих потенційних та ідентифікованих ризиків; резюме ефективності заходів з мінімізації ризику в будь-якій країні чи адміністративно-територіальній одиниці, що можуть бути корисними в інших країнах чи адміністративно-територіальних одиницях. Інформація у наведених нижче підрозділах не повинна дублювати інформацію, надану у попередніх розділах, а має інтерпретувати інформацію та надавати їй критичну оцінку з метою характеристики профілю ризиків, що були оцінені як важливі. Немає потреби у включенні описів випадків до розділів регулярного звіту з безпеки для оцінки ризиків (але якщо вони є частиною наукового аналізу сигналу або ризику, необхідно надати клінічну оцінку важливих або ілюстративних випадків).
Підрозділ XVI.1. Резюме проблем безпеки
Резюмуються важливі питання з безпеки, відомі на початку звітного періоду, за допомогою яких можна здійснити оцінку нової інформації. Для лікарських засобів, що мають специфікацію з безпеки, дані, наведені у цьому підрозділі, будуть або такими, як резюме специфікацій з безпеки дійсного на початок звітного періоду регулярного звіту з безпеки, або ґрунтуватимуться на ньому. Надаються відомості про важливі виявлені та потенційні ризики та важлива відсутня інформація.
Для лікарських засобів, що не мають специфікації з безпеки, надаються відомості про важливі виявлені та потенційні ризики і важлива відсутня інформація, що пов’язані з їх застосуванням, на підставі дореєстраційного та післяреєстраційного досвіду.
Підрозділ XVI.2. Оцінка сигналів
Узагальнюються результати оцінки усіх сигналів з безпеки, закритих у звітний період, незалежно від того, чи класифіковані вони як важливі, чи ні. Сигнал з безпеки після його оцінки може бути закритий або тому, що він спростований, або тому, що визначений як потенційний чи ідентифікований ризик. До підрозділу включаються дві головні категорії сигналів та надається детальний опис оцінки кожного сигналу з обох категорій закритих сигналів:
сигнали, які після їх оцінки були спростовані як помилкові на підставі наукової оцінки наявної на даний момент інформації;
сигнали, які після оцінки були класифіковані як потенційні або виявлені ризики, включаючи відсутність ефективності.
Якщо для закритих сигналів обох категорій використовуються різні оцінки, вони можуть бути надані у такому порядку:
закриті та спростовані сигнали;
закриті сигнали, класифіковані як важливі потенційні ризики;
закриті сигнали, класифіковані як важливі виявлені ризики;
закриті сигнали, що є потенційними ризиками, не класифіковані як важливі;
закриті сигнали, що є виявленими ризиками, не класифіковані як важливі.
Де доцільно, оцінку закритих сигналів можна надавати за показанням або популяцією.
Описи оцінки сигналів можуть бути включені до цього підрозділу або до додатка до регулярного звіту з безпеки. Кожна оцінка має містити таку інформацію (залежно від ситуації):
джерело або інформація, що стала підставою для формування сигналу;
основні дані, важливі для оцінки;
метод(и) оцінки, включаючи джерела даних, критерії пошуку (якщо можливо, із застосуванням спеціальних MedDRA-термінів (наприклад, на рівні PT, HLT, SOC тощо) або переглядом стандартизованих запитів (SMQs) MedDRA) та аналітичні підходи;
результати (резюме та критичний аналіз даних, що розглядаються при оцінці сигналу). Результати можуть містити опис серії випадків або окремого випадку (наприклад, випадок детально документованого агранулоцитозу або синдрому Стівенса — Джонсона), якщо вони є частиною оцінки;
обговорення;
висновок.
Наводяться оцінка та висновки власника реєстраційного посвідчення щодо спростованих сигналів.
Підрозділ XVI.3. Оцінка ризиків та нової інформації
Надається критична оцінка новій інформації, пов’язаній з раніше визнаними ризиками, що не була включена у підрозділ XVI.2 регулярного звіту з безпеки.
Нова інформація, що є сигналом для раніше визнаного ризику або для раніше спростованого сигналу, надається у таблиці сигналів та оцінюється у підрозділі XVI.2 регулярного звіту з безпеки, якщо сигнал був також закритий протягом звітного періоду.
Включається оновлена інформація, що стосується раніше визнаного ризику і не є сигналом. Нову інформацію можна надати у такому форматі:
нова інформація щодо важливих потенційних ризиків;
нова інформація щодо важливих виявлених ризиків;
нова інформація щодо інших потенційних ризиків, що не класифіковані як важливі;
нова інформація щодо інших виявлених ризиків, що не класифіковані як важливі;
оновлені дані щодо важливої відсутньої інформації.
При оцінці нової інформації основна увага приділяється інформації, що стала відомою у звітний період. Така оцінка є базовою для оновленої характеристики важливих потенційних та виявлених ризиків у підрозділі XVI.4 регулярного звіту з безпеки. Рівень деталізації оцінки, включеної у цей підрозділ, має бути пропорційним наявним доказам щодо ризику і його медичної важливості та впливу на громадське здоров’я.
Оцінка нової інформації та оновленої відсутньої інформації може наводитися у цьому підрозділі або надаватися у додатку у довільній формі. Кожна оцінка має включати таку інформацію:
джерело нової інформації;
основні дані, важливі для оцінки;
метод(и) оцінки, включаючи джерела даних, критерії пошуку та аналітичні підходи;
результати (резюме та критичний аналіз даних, що розглядаються при оцінці ризику);
обговорення;
висновок, в тому числі й про те, впливає чи ні ця оцінка на оновлення характеристик будь-яких важливих та виявлених ризиків, зазначених у підрозділі XVI.4 «Характеристика ризиків» регулярного звіту з безпеки.
Критично оцінюється будь-яка нова інформація щодо популяцій, які застосовують лікарський засіб, або даних, сформованих для аналізу раніше відсутньої інформації. Описуються також наявні невирішені проблеми та сумнівні питання.
Підрозділ XVI.4. Характеристика ризиків
Слід на основі узагальнених даних, не обмежених звітним періодом, охарактеризувати важливі виявлені та потенційні ризики та описати важливу відсутню інформацію.
Якщо відсутня інформація становить важливий ризик, вона повинна розглядатися як проблема безпеки. Необхідно також проаналізувати обмеження баз даних з безпеки (стосовно кількості досліджуваних пацієнтів, кумулятивної експозиції, тривалого застосування тощо).
У регулярних звітах з безпеки, що складаються для лікарських засобів з кількома показаннями, формами випуску, способами застосування, коли можуть мати місце значні розбіжності у виявлених та потенційних ризиках, може бути доцільним навести ризики за показаннями, формами випуску або способами застосування.
Підрозділ XVI.5. Ефективність заходів з мінімізації ризиків (якщо застосовувалися)
Надаються результати оцінки ефективності заходів з мінімізації ризиків, що стосуються оцінки користь/ризик, узагальнюється уся доступна за звітний період інформація щодо результативності та/або обмежень специфічних заходів з мінімізації важливих виявлених у будь-якій країні чи адміністративно-територіальній одиниці ризиків.
Якщо доречно і можливо, інформацію можна узагальнити по адміністративно-територіальних одиницях.
Якщо вимагається надання результатів оцінок ефективності заходів з мінімізації ризиків у звітний період стосовно окремої адміністративно-територіальної одиниці, вони мають надаватися у регіональному додатку до регулярного звіту.
Розділ XVII. Оцінка користі
Підрозділ XVII.1. Важлива базова інформація з ефективності лікарського засобу
Узагальнюється інформація щодо ефекту й ефективності лікарського засобу, відома на початку звітного періоду, що становить базис для оцінки користі. Така інформація має відповідати зареєстрованим показанням лікарського засобу, що містяться у довідковій інформації про лікарський засіб.
Щодо лікарських засобів з різними показаннями, популяціями та/або способами застосування користь лікарського засобу (якщо доцільно) потрібно характеризувати окремо за цими факторами. Якщо не було значних змін у профілях користі та ризику лікарського засобу у звітний період, резюме має бути стислим (переважно це має бути зміст довідкової інформації або показань, що перелічуються у вступній частині регулярного звіту з безпеки). Рівень деталізації інформації, що надається у цьому підрозділі, має бути достатнім для підтвердження характеристики користі у підрозділі XVIІ.3 «Характеристика користі» регулярного звіту з безпеки та оцінки співвідношення користь/ризик у розділі XVIІІ «Комплексний/інтегрований аналіз співвідношення користь/ризик для зареєстрованих показань» регулярного звіту з безпеки.
Підрозділ XVII.2. Нова виявлена інформація з ефективності
Надається додаткова інформація щодо ефекту та ефективності для зареєстрованих показань, яка з’явилася протягом звітного періоду. Також надається нова інформація щодо ефекту та ефективності для зареєстрованих показань стосовно умов фактичного (практичного) застосування, якщо вона доступна. Нова інформація щодо ефекту та ефективності при застосуванні за незареєстрованими показаннями не надається, крім випадків, коли вона є важливою для оцінки співвідношення користь/ризик препарату за зареєстрованими показаннями. Наводиться також нова інформація щодо показань, зареєстрованих у звітний період. Рівень деталізації інформації, що надається у цьому підрозділі, має бути достатнім для підтвердження характеристики користі та оцінки співвідношення користь/ризик.
Особлива увага приділяється вакцинам, антиінфекційним та іншим лікарським засобам, для яких зміна терапевтичних умов може з часом вплинути на їх ефект/ефективність.
Підрозділ XVII.3. Характеристика користі
Надається сукупна базова та нова інформація щодо користі для зареєстрованих показань, що стала доступною у звітний період. Рівень деталізації інформації має бути достатнім для забезпечення оцінки співвідношення користь/ризик. Якщо немає нових важливих даних щодо користі, надається характеристика інформації, викладеної у підрозділі XVIІ.1 регулярного звіту з безпеки. Якщо є нова позитивна інформація щодо користі, але немає значних змін у профілі ризику препарату у цей звітний період, сукупна базова та нова інформація мають наводитися досить стисло.
У цьому підрозділі надається стислий, але критичний опис як переваг лікарського засобу, так і недостатності доказів його ефекту та ефективності.
Розділ XVIII. Комплексний/інтегрований аналіз співвідношення користь/ризик для зареєстрованих показань
Надається загальна оцінка користі та ризику лікарського засобу при його застосуванні у клінічній практиці. При цьому інформація щодо користі та ризику, наведена в підрозділах XVI.2 «Оцінка сигналів», XVI.3 «Оцінка ризиків та нової інформації» та XVIІ.3 «Характеристика користі», не дублюється, а надається критичний аналіз та узагальнена ключова інформація щодо користі та ризику із цих розділів.
Підрозділ XVIII.1. Контекст користь/ризик (медична необхідність та важливі альтернативи)
Стисло описується медична потреба в лікарському засобі за зареєстрованими показаннями та надається резюме альтернатив (медичних, хірургічних або інших, включаючи відсутність лікування).
Підрозділ XVIII.2. Оцінка аналізу співвідношення користь/ризик
Оцінюється і наводиться профіль користь/ризик за кожним показанням окремо. Якщо в межах одного показання існують важливі розбіжності у профілі користь/ризик серед різних популяцій, оцінка користь/ризик надається для кожної популяції, якщо це можливо.
Оцінка користь/ризик наводиться й аналізується таким чином, щоб забезпечити порівняння користі і ризиків. При оцінці зазначаються ключові переваги та ризики, узагальнюється ключова інформація щодо користі та ризиків, наведена у попередніх розділах/підрозділах, враховуються обставини застосування лікарського засобу, розглядаються величина ефекту, всі елементи користі, клінічна серйозність ризику та умови його виявлення.
Надається пояснення методології та обґрунтувань, що використовувались для оцінки користь/ризик.
У разі якщо існує важлива нова інформація або вимагається надання спеціального регулярного звіту, детальний аналіз користь/ризик має ґрунтуватися на кумулятивних даних. І навпаки, якщо протягом звітного періоду отримано мало нової інформації, першочергова увага при оцінці користь/ризик може приділятися оцінці оновлених даних з безпеки за звітний період.
Розділ XIX. Висновки та заходи
Надаються висновки щодо будь-якої нової інформації, отриманої протягом звітного періоду, стосовно загальної оцінки користь/ризик препарату для кожного зареєстрованого показання, а також для відповідних підгруп пацієнтів. Оцінюється необхідність внесення змін до довідкової інформації і пропонуються зміни, якщо вони потрібні. У разі доцільності включаються попередні рекомендації щодо оптимізації чи подальшої оцінки балансу користь/ризик для наступного їх обговорення з відповідним уповноваженим органом. Також можуть бути включені пропозиції щодо додаткових заходів з мінімізації ризиків. Якщо для лікарського засобу розроблений план з фармаконагляду чи план управління ризиками, обумовлюються також пропозиції щодо них. З урахуванням оцінки зведених даних з безпеки та аналізу співвідношення користь/ризик надається висновок щодо необхідності змін та/або заходів, включаючи зміни до затвердженої короткої характеристики лікарського засобу.
XX. Додатки до регулярно оновлюваного звіту з безпеки
1. Довідкова інформація.
2. Зведені таблиці серйозних побічних явищ з клінічних випробувань; зведені та інтервальні таблиці серйозних і несерйозних побічних реакцій за даними післяреєстраційного нагляду.
3. Зведена таблиця сигналів з безпеки (якщо зведену таблицю сигналів з безпеки не включено до змісту відповідного розділу регулярного звіту з безпеки, рекомендується включати її до змісту відповідного розділу регулярного звіту з безпеки).
4. Перелік всіх інтервенційних та неінтервенційних досліджень, спонсорованих власником реєстраційного посвідчення, головною метою яких є ідентифікація, характеристика чи кількісне визначення загрози безпеці або підтвердження профілю безпеки лікарського засобу.
5. Перелік джерел інформації, що використовувалися для підготовки регулярного звіту з безпеки (за бажанням заявника).
6. Локальний додаток.
Додаток 13
до Порядку здійснення фармаконагляду
(пункт 6 глави 3 розділу V)
ФОРМА
надання заявником (або його представником) зведених даних про стан безпеки медичного застосування лікарського засобу, вакцини, туберкуліну в Україні за період дії останнього реєстраційного посвідчення
| Календарний рік | Кількість побічних реакцій (серйозних/несерйозних) | Обсяг продажу | Показник впливу лікарського засобу, вакцини, туберкуліну на пацієнтів |
| 1 | 2 | 3 | 4 |
| Усього |
ВИСНОВОК _______________________________________________________________________________
(зазначаються конкретні дані, аналіз необхідності внесення змін до
____________________________________________________________________________________________
інформації щодо безпеки лікарського засобу, вакцини, туберкуліну
_____________________________________________________________________________________________
(до інструкції для медичного застосування), запропоновані з цього приводу заявником (або
_____________________________________________________________________________________________
його представником) заходи тощо)
Примітки:
1. Форма заповнюється заявником (або його представником) за підписом уповноваженої особи/контактної особи, відповідальної за фармаконагляд.
2. Календарний рік (зазначаються календарні роки у хронологічному порядку за період дії останнього реєстраційного посвідчення).
3. Кількість побічних реакцій (серйозні/несерйозні) (зазначається співвідношення серйозних/несерйозних побічних реакцій, інформацію про які було отримано заявником (або його представником) на території України, за винятком інформації, отриманої від державного підприємства «Державний експертний центр Міністерства охорони здоров’я»).
4.Обсяг продажу (наводиться кількість в одиницях форми випуску (таблетки, ампули, флакони). Заповнюється у разі потреби, за вимогою Центру).
5. Показник впливу лікарського засобу на пацієнтів (показник впливу зазначається відповідно до показника, зазначеного у розділі «Розрахунок експозиції та схеми застосування» Доповнення до огляду клінічних даних відповідно до підпункту 2.3 пункту 2 додатка 15 до Порядку проведення експертизи реєстраційних матеріалів на лікарські засоби, що подаються на державну реєстрацію (перереєстрацію), а також експертизи матеріалів про внесення змін до реєстраційних матеріалів протягом дії реєстраційного посвідчення, затвердженого наказом Міністерства охорони здоров’я України від 26 серпня 2005 року № 426, зареєстрованого в Міністерстві юстиції України 07 жовтня 2015 року за № 1210/27655 (у редакції наказу Міністерства охорони здоров’я України від 23 липня 2015 року № 460), або у розділі V «Оцінка експозиції та схем застосування» останнього генерованого регулярно оновлюваного звіту з безпеки лікарського засобу відповідно до вимог додатка 12 до Порядку здійснення фармаконагляду, затвердженого наказом Міністерства охорони здоров’я України від 26 вересня 2016 року № 996).
Додаток 14
до Порядку здійснення фармаконагляду
(пункт 6 глави 4 розділу V)
СТРУКТУРА
плану управління ризиками
Частина І. Загальна інформація
Частина II. Специфікація з безпеки
Модуль СI. Епідеміологія показань до застосування та цільова(і) популяція(ї)
Модуль СII. Доклінічна частина специфікації з безпеки
Модуль СIII. Експозиція пацієнтів, залучених до клінічних випробувань
Модуль СIV. Популяції, які не вивчались під час клінічних випробувань
Модуль СV. Післяреєстраційний досвід
Модуль СVI. Додаткові вимоги України, ЄС до специфікації з безпеки
Модуль СVII. Ідентифіковані та потенційні ризики
Модуль СVIII. Резюме проблем безпеки
Частина III. План з фармаконагляду
Частина IV. Плани щодо післяреєстраційних досліджень ефективності
Частина V. Заходи з мінімізації ризиків
Частина VI. Резюме плану управління ризиками
Частина VII. Додатки
ВИМОГИ
щодо надання інформації у плані управління ризиками
| Вид нової заяви | Частина І | Частина ІІ — Модуль СI | Частина ІІ — Модуль СII | Частина ІІ — Модуль СIII | Частина ІІ — Модуль СIV | Частина ІІ — Модуль СV | Частина ІІ — Модуль СVI | Частина ІІ — Модуль СVII | Частина ІІ — Модуль СVIII | Частина ІІІ | Частина IV | Частина V | Частина VI | Частина VII |
| Нова діюча речовина | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ |
| Біоподібний лікарський засіб | √ | * | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ |
| Інформована згода | √ | √ | √ | √ | √ | √ | √ | √ | √ | ** | ** | √ | ** | √ |
| Генеричний лікарський засіб | √ | * | * | * | * | * | * | * | √ | ** | ** | √ | ** | √ |
| Гібридні лікарські засоби | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ |
| Фіксовані комбінації | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ | √ |
| Добре вивчене медичне застосування** | √ | √ | ** | ** | ** | √ | √ | √ | √ | √ | √ | √ | √ | √ |
| Така сама діюча речовина** | √ | √ | ** | ** | ** | √ | √ | √ | √ | √ | √ | √ | √ | √ |
Для гібридних лікарських засобів або фіксованих комбінацій у модулях СII (доклінічна частина) та СIII (експозиція клінічних досліджень) потрібно навести тільки дані про фіксовану комбінацію або про відмінності порівняно з референтним лікарським засобом.
ПЛАН УПРАВЛІННЯ РИЗИКАМИ
(титульна сторінка)
| Назва активного фармацевтичного інгредієнта за міжнародною непатентованою назвою | |
| Фармакотерапевтична група.Код АТХ | |
| Найменування власника реєстраційного посвідчення/заявника | |
| Лікарські засоби, вакцини, туберкулін, на які поширюється план управління ризиками | 1.2.3.… |
| Торговельна(і) назва(и) лікарського(их) засобу(ів), вакцини (вакцин), туберкуліну |
| Дата подання плану управління ризиками | Номер версії | __________ | |
| (дд/мм/рр) | |||
| Дата остаточного підписання плану управління ризиками | |||
| (дд/мм/рр) |
ОГЛЯД ЛІКАРСЬКИХ(ОГО) ЗАСОБІВ(У), ВАКЦИН(И), ТУБЕРКУЛІНУ*,
НА ЯКІ ПОШИРЮЄТЬСЯ ПЛАН УПРАВЛІННЯ РИЗИКАМИ
| Назва частини плану управління ризиками | Назва модуля/додатка ПУР | Дата останнього перегляду плану управління ризиками | Номер версії останнього перегляду плану управління ризиками** |
| ЧАСТИНА І.Загальна інформація | Адміністративні дані | ||
| ЧАСТИНА ІІ. Специфікація з безпеки | Модуль СI. Епідеміологія показань для застосування та цільова(і) популяція(ї) | ||
| Модуль СII. Доклінічна частина специфікації з безпеки | |||
| Модуль СIII. Експозиція пацієнтів, залучених до клінічних випробувань | |||
| Модуль СIV. Популяції, які не вивчались під час клінічних випробувань | |||
| Модуль СV. Післяреєстраційний досвід | |||
| Модуль СVI. Додаткові вимоги України, ЄС до специфікації з безпеки | |||
| Модуль СVII. Ідентифіковані та потенційні ризики | |||
| Модуль СVIII. Резюме проблем з безпеки | |||
| ЧАСТИНА III. План з фармаконагляду (у тому числі післяреєстраційні дослідження з безпеки) | |||
| ЧАСТИНА IV. Плани щодо післяреєстраційних досліджень ефективності | |||
| ЧАСТИНА V. Заходи з мінімізації ризиків (включно з оцінкою ефективності діяльності з мінімізації ризиків) | |||
| ЧАСТИНА VI. Резюме плану управління ризиками | |||
| ЧАСТИНА VII. Додатки*** | Додаток 1.Основна інформація плану управління ризиками в структурованому електронному форматі (якщо застосовано) | ||
| Додаток 2.Затверджені (діючі) або пропоновані (якщо лікарський(і) засіб(оби) не зареєстровано) коротка характеристика на лікарський засіб, інструкція для медичного застосування, листок-вкладка | |||
| Додаток 3.Міжнародний реєстраційний статус лікарського засобу | |||
| Додаток 4.Стислий огляд (синопсис) протоколу клінічного випробування, що триває, або завершеного клінічного випробування | |||
| Додаток 5.Стислий огляд (синопсис) протоколу фармакоепідеміологічногодослідження, що триває, або завершеного фармакоепідеміологічного дослідження | |||
| Додаток 6.Протоколи досліджень, що тривають, та пропонованих досліджень, що зазначені в категоріях 1–3 розділу «Зведена таблиця додаткових заходів з фармаконагляду» частини ІІІ плану управління ризиками | |||
| Додаток 7.Спеціальні форми для подальшого збору (follow-up) інформації щодо спостереження за випадком побічної реакції | |||
| Додаток 8.Протоколи досліджень, що тривають, та пропонованих досліджень, що зазначені в частині IV плану управління ризиками | |||
| Додаток 9.Стислий огляд (синопсис) звітів про дослідження, що зазначені в частинах III, IV плану управління ризиками | |||
| Додаток 10.Деталізована інформація щодо додаткових заходів з мінімізації ризиків (якщо такі були) | |||
| Додаток 11.Приклади макетів матеріалів для медичних працівників та пацієнтів | |||
| Додаток 12.Інші супровідні/допоміжні дані |
ЧАСТИНА І. Загальна інформація
АДМІНІСТРАТИВНІ ДАНІ
| Прізвище, ім’я, по батькові уповноваженої особи, відповідальної за фармаконагляд | |
| Підпис уповноваженої особи, відповідальної за фармаконагляд | |
| Контактна особа з питань, пов’язаних з планом управління ризиками | |
| Адреса електронної пошти або телефон контактної особи |
ОГЛЯД ВЕРСІЙ
| Номер останньої погодженої версії плану управління ризиками: | |
| номер версії | |
| погоджений в рамках | (вказується процедура погодження) |
ПОТОЧНА ВЕРСІЯ ПЛАНУ УПРАВЛІННЯ РИЗИКАМИ,
ЩО ОЦІНЮЄТЬСЯ
| Номер версії плану управління ризиками | Дата подання | Процедура подання |
| Торговельна назва | |
| Процедура реєстрації | |
| Стислий опис лікарського засобу: | |
| Анатомо-терапевтично-хімічна класифікація | |
| Стислий виклад механізму дії | |
| Важлива інформація про склад лікарського засобу(зазначається інформація про склад лікарського засобу: активний фармацевтичний інгредієнт та його походження (наприклад, біологічне чи інше), допоміжні речовини або компоненти вакцин) | |
| Показання до застосування:затверджені (поточні) (якщо є);пропоновані до затвердження(якщо є) | |
| Дозування і спосіб застосування:затверджені (поточні) (якщо є);пропоновані до затвердження(якщо є) | |
| Лікарська форма (форма випуску) і кількість | |
| Країна і дата першої реєстрації лікарського засобу | |
| Країна і дата першого запуску у виробництво лікарського засобу | |
| Країна і дата першої реєстрації лікарського засобу в ЄС |
ЧИ Є ЦЕЙ ЛІКАРСЬКИЙ ЗАСІБ ПРЕДМЕТОМ ДОДАТКОВОГО МОНІТОРИНГУ
| ТАК | НІ |
ЧАСТИНА ІІ. Специфікація з безпеки
МОДУЛЬ СI. Епідеміологія Показань ДО ЗАСТОСУВАННЯ та ЦІЛЬОВА(І) ПОПУЛЯЦІЯ(Ї)
(заповнюється для кожного показання)
| Показання до застосування | |
| Торговельна назва лікарського засобу |
Якщо лікарський засіб призначений для профілактики або лікування одного захворювання (наприклад, малярія), але використовується в комбінації з іншими видами терапії (наприклад, антинеопластичні препарати), доцільно навести «пов’язані» показання разом.
Якщо показання спрямоване на частину популяції пацієнтів із захворюванням, потрібно надати інформацію як для цільової популяції, так і для захворювання в цілому (наприклад, для пацієнтів з метастатичним раком молочної залози, які мають невдалі результати одного або більше попередніх лікувань).
Якщо хвороба може виникати у осіб обох статей, незважаючи на переважання в одній із них, інформація надається для обох статей (наприклад, рак молочної залози) за умови, що цей лікарський засіб не протипоказаний для однієї із статей.
СI.1.Епідеміологія захворювання
| Показання до застосування | |
| Захворюваність | |
| Поширеність | |
| Демографічні дані цільової популяції | |
| Важливі супутні захворювання у цільової популяції(зазначаються важливі супутні захворювання в цільовій популяції, якщо можливо (наприклад, лікарський засіб для лікування раку простати: цільова популяція — чоловіки старше 50 років, але в цьому віці збільшується ризик інфаркту міокарда. Для визначення, чи підвищує застосування лікарського засобу ризик розвитку інфаркту міокарда, важливо знати, скільки випадків інфаркту міокарда очікується в цільовій популяції (в ідеалі) або у чоловіків цієї самої вікової групи, які не застосовують лікарський засіб. Оцінка ризику у цільовій популяції порівняно з такою віковою групою може бути дуже важлива, якщо саме захворювання підвищує ризик будь-яких небажаних явищ)) | |
| Відмінності в епідеміології в різних регіонах (країнах світу) з акцентом на епідеміологію в Україні в межах показань до застосування(у разі наявності відмінностей у різних країнах надається їх аналог, якщо можливо, наводяться дані з розподілом за віком, статтю, расою та/або етнічним походженням) | |
| Фактори ризику виникнення захворювання(зазначаються фактори ризику, що сприяють виникненню захворювання, якщо можливо (наприклад, стать, вік, вага, шкідливі звички, фізичні або емоційні перевантаження, надмірне заняття спортом, гіподинамія, супутні захворювання, прийом лікарського засобу, недоїдання, обтяжений алергоанамнез, генний поліморфізм тощо)) | |
| Основні методи лікування(зазначаються методи лікування, які, як правило, використовуються при лікуванні цього захворювання) | |
| Смертність (природна динаміка)(зазначається, якими є показники смертності при цьому захворюванні, якщо можливо) |
СI.2.Супутнє лікування в цільовій популяції
Зазначається, які супутні лікарські засоби часто використовуються з лікарським засобом, з приводу якого створюється план управління ризиками, для лікування захворювання або його ускладнень (наприклад, антигіпертензивні препарати часто використовуються разом з гіпоглікемічними лікарськими засобами у хворих на цукровий діабет тощо).
СI.3. Важливі супутні захворювання, виявлені у пацієнтів цільової популяції
Зазначається, які супутні захворювання зустрічаються у цільової популяції. Якщо є можливим, надаються дані про захворюваність, поширеність і смертність від супутніх захворювань у пацієнтів цільової популяції. Якщо частота супутніх захворювань, які, зазвичай, зустрічаються у пацієнтів цільової популяції, збільшилася порівняно із захворюваністю на цю патологію в загальній популяції того самого віку/статі, це має бути спеціально обумовлено (наприклад, у пацієнтів, хворих на ревматоїдний артрит, які застосовують лікарський засіб з метою його лікування, захворюваність на ішемічну хворобу серця збільшується порівняно з пацієнтами, які не хворіють на ревматоїдний артрит, того самого віку і статі).
МОДУЛЬ СII. ДОКЛІНІЧНА ЧАСТИНА СПЕЦИФІКАЦІЇ З БЕЗПЕКИ
У цьому модулі надається резюме важливих висновків щодо безпеки лікарського засобу за даними неклінічних досліджень. Зазначаються негативні результати і потенціал їх впливу на цільову популяцію (наприклад, негативний токсичний вплив на репродуктивну функцію). У цьому модулі мають надаватися дані, наведені нижче (але не виключно).
| Основні висновки щодо безпеки за даними неклінічних досліджень | Важливість для застосування у людини |
| Токсичність, у тому числі:токсичність при одноразовому і повторному введенні дози;репродуктивна токсичність (обумовлюється, якщо лікарський засіб може застосовуватися у жінок дітородного віку);експериментальна токсичність;нефротоксичність;гепатотоксичність;генотоксичність;канцерогенність | |
| Загальна фармакологія:з боку серцево-судинної системи (у тому числі щодо збільшення QT-інтервалу);з боку нервової системи;тощо | |
| Механізми взаємодії з іншими лікарськими засобами | |
| Інша інформація, що стосується токсичності, або дані щодо токсичності |
Надаються, якщо необхідно, додаткові дані за результатами неклінічних досліджень, якщо лікарський засіб буде використовуватися у спеціальних популяціях.
СII.1. Висновки згідно з даними за результатами неклінічних досліджень
Зазначаються проблеми безпеки згідно з даними за результатами неклінічних досліджень, що:
були підтверджені клінічними даними;
не були належним чином спростовані клінічними даними;
потребують подальших досліджень;
значення яких невідомо.
| Проблеми безпеки | Перелік |
| Важливі ідентифіковані ризики (підтверджені клінічними даними) | |
| Важливі потенційні ризики (які не були належним чином спростовані клінічними даними або значення яких невідомо) | |
| Відсутня інформація |
Ці дані з безпеки мають бути перенесені/відображені в модулі СVIII частини ІІ.
Модуль СIII. Експозиція пацієнтів, ЗАЛУЧЕНИХ ДО клінічнИХ випробувань
СIII.1. Стислий огляд «життєвого» циклу лікарського засобу
Надається детальна інформація про те, як затверджені (поточні) показання і популяції змінювалися протягом життєвого циклу лікарського засобу. Така інформація має включати:
оригінальні показання/торговельну(і) назву(и) лікарського(их) засобу(ів);
нові популяції (наприклад, розширення показань/нові(ий) лікарські(ий) засоби(іб);
будь-які інші важливі зміни (наприклад, зміни способу уведення).
СIII.2. Експозиція пацієнтів, які брали участь у клінічних випробуваннях
Надається інформація згідно з наведеними нижче таблицями для кожного показання, а також зведена таблиця, в якій зазначається загальна експозиція. Де можливо, кожна таблиця заповнюється з урахуванням експозиції пацієнтів відносно лікарського засобу:
тільки популяція, залучена в рандомізованих сліпих клінічних випробуваннях;
вся популяція, залучена до клінічних досліджень (включаючи клінічні дослідження щодо розширення популяції для застосування лікарського засобу).
Наведені в таблицях дані мають бути зведеними, тобто окремі таблиці для кожного випробування не складаються, крім випадків, коли за певних обґрунтованих причин деякі дані не повинні бути об’єднані (причини зазначаються). Коли причиною надання оновленого плану управління ризиками є нова популяція (або розширення показань, або новий лікарський засіб з тим самим активним фармацевтичним інгредієнтом) або нова доза чи лікарська форма, нові дані необхідно спочатку навести окремо, а потім також включити їх до зведених таблиць.
Дані надаються або у вигляді таблиць, або у вигляді графіків. Наведений нижче розподіл за категоріями є прикладом і залежатиме від лікарського засобу. У разі якщо пацієнти брали участь у більше ніж одному випробуванні, вони повинні бути включені до таблиць лише один раз за віком, статтю, етнічною групою (наприклад, відкриті випробування). Якщо існує різниця в загальній кількості пацієнтів згідно з таблицями, такі таблиці мають супроводжуватися поясненням причини розбіжностей.
Якщо лікарський засіб має тільки одне показання, таблиці 2, 4, 7, 9, 11 не надаються. У разі якщо план управління ризиками складається тільки для одного лікарського засобу, таблиця 6 не надається.
| Таблиця 1. Тривалість впливу на пацієнтів (за показаннями) | ||
| Показання 1 (пацієнто-час вказується тільки для фінальної та загальної тривалості впливу на пацієнтів) | ||
| Тривалість впливу на пацієнтів (принаймні) | Кількість пацієнтів | Пацієнто-час |
| 1 місяць | ||
| 3 місяці | ||
| 6 місяців | ||
| 12 місяців і так далі | ||
| Усього пацієнто-часу | ||
| Показання 2 (пацієнто-час вказується тільки для фінальної та загальної тривалості впливу на пацієнтів) | ||
| Тривалість впливу на пацієнтів (принаймні) | Кількість пацієнтів | Пацієнто-час |
| 1 місяць | ||
| 3 місяці | ||
| 6 місяців | ||
| 12 місяців і більше | ||
| Усього пацієнто-часу | ||
| Таблиця 2. Тривалість впливу на пацієнтів (для всіх пацієнтів) | ||
| Тривалість впливу на всіх пацієнтів (пацієнто-час вказується тільки для фінальної та загальної тривалості впливу на пацієнтів) | ||
| Тривалість впливу на пацієнтів (принаймні) | Кількість пацієнтів | Пацієнто-час |
| 1 місяць | ||
| 3 місяці | ||
| 6 місяців | ||
| 12 місяців і більше | ||
| Усього пацієнто-часу | ||
| Таблиця 3. Розподіл пацієнтів з урахуванням застосованої дози (за показаннями) | ||
| Показання 1 | ||
| Прийняті дози | Кількість пацієнтів | Пацієнто-час |
| Доза 1 | ||
| Доза 2 і так далі | ||
| Усього | ||
| Показання 2 | ||
| Прийняті дози | Кількість пацієнтів | Пацієнто-час |
| Доза 1 | ||
| Доза 2 і так далі | ||
| Усього | ||
| Таблиця 4. Загальний розподіл пацієнтів з урахуванням застосованої дози (за показаннями) | ||
| Для всіх пацієнтів | ||
| Прийняті дози | Кількість пацієнтів | Пацієнто-час |
| Доза 1 | ||
| Доза 2 і так далі | ||
| Усього | ||
Розподіл даних за віковими групами залежатиме від цільової популяції. Потрібно уникати таких штучних категорій, як (наприклад) <65, >65. Дані в педіатричній віковій групі мають бути розподілені за категоріями (наприклад, згідно з ICH HARMONISED TRIPARTITE GUIDELINE. CLINICAL INVESTIGATION OF MEDICINAL PRODUCTS IN THE PEDIATRIC POPULATION). Аналогічно дані про літніх пацієнтів мають бути розподілені на такі категорії, як 65 — 69 років; 70 — 74 роки; 75 — 79 років. Для препаратів, що мають тератогенний вплив, розподіл за віковими категоріями жіночої популяції має бути пов’язаний з дітородним віком. Якщо план управління ризиками складається для більше ніж одного лікарського засобу, складаються зведені таблиці для всієї популяції для кожного лікарського засобу, а також зведена таблиця.
| Таблиця 5. Розподіл пацієнтів за віком та статтю (за показаннями) | ||||
| Показання 1 | ||||
| Вікова група | Кількість пацієнтів | Пацієнто-час | ||
| Ч | Ж | Ч | Ж | |
| Вікова група 1 | ||||
| Вікова група 2 і так далі | ||||
| Усього | ||||
| Показання 2 | ||||
| Вікова група | Кількість пацієнтів | Пацієнто-час | ||
| Ч | Ж | Ч | Ж | |
| Вікова група 1 | ||||
| Вікова група 2 і так далі | ||||
| Усього | ||||
| Таблиця 6. Розподіл пацієнтів за віком та статтю (для лікарського засобу) | ||||
| Загальна популяція для лікарського засобу № 1 | ||||
| Вікова група | Кількість пацієнтів | Пацієнто-час | ||
| Ч | Ж | Ч | Ж | |
| Вікова група 1 | ||||
| Вікова група 2 і так далі | ||||
| Усього | ||||
| Загальна популяція для лікарського засобу № 2 | ||||
| Вікова група | Кількість пацієнтів | Пацієнто-час | ||
| Ч | Ж | Ч | Ж | |
| Вікова група 1 | ||||
| Вікова група 2 і так далі | ||||
| Усього | ||||
| Таблиця 7. Загальний розподіл пацієнтів за віком та статтю (усього) | ||||
| Вся популяція | ||||
| Вікова група | Кількість пацієнтів | Пацієнто-час | ||
| Ч | Ж | Ч | Ж | |
| Вікова група 1 | ||||
| Вікова група 2 і так далі | ||||
| Усього | ||||
| Таблиця 8. Розподіл за етнічним чи расовим походженням (за показаннями) | ||
| Показання 1 | ||
| Етнічне/расове походження | Кількість пацієнтів | Пацієнто-час |
| Етнічне походження 1 | ||
| Етнічне походження 2 і так далі | ||
| Усього | ||
| Показання 2 | ||
| Етнічне/расове походження | Кількість пацієнтів | Пацієнто-час |
| Етнічне походження 1 | ||
| Етнічне походження 2 і так далі | ||
| Усього | ||
| Таблиця 9. Загальний розподіл за етнічним чи расовим походженням (усього) | ||
| Уся популяція | ||
| Етнічне/расове походження | Кількість пацієнтів | Пацієнто-час |
| Етнічне походження 1 | ||
| Етнічне походження 2 і так далі | ||
| Усього | ||
| Taблиця 10. Розподіл за особливими популяціями (за показаннями) | ||
| Показання 1 | Кількість пацієнтів | Пацієнто-час |
| Вагітні жінки | ||
| Жінки, які годують груддю | ||
| Пацієнти з порушенням функції нирок (яке саме порушення) | ||
| Пацієнти з порушенням функції печінки (яке саме порушення) | ||
| Пацієнти з порушеннями з боку серцево-судинної системи (яке саме порушення) | ||
| Частина популяції з генетичним поліморфізмом (зазначити, яким саме) | ||
| Імунокомпрометовані пацієнти | ||
| Показання 2 | Кількість пацієнтів | Пацієнто-час |
| Вагітні жінки | ||
| Жінки, які годують груддю | ||
| Пацієнти з порушенням функції нирок (специфікувати або категоризувати) | ||
| Пацієнти з порушенням функції печінки (специфікувати або категоризувати) | ||
| Пацієнти з порушеннями з боку серцево-судинної системи (специфікувати або категоризувати) | ||
| Частина популяції з генетичним поліморфізмом (зазначити, яким саме) | ||
| Імунокомпрометовані пацієнти | ||
| Taблиця 11. Загальний розподіл за спеціальними популяціями (усього) | ||
| Загальна популяція | Кількість пацієнтів | Пацієнто-час |
| Вагітні жінки | ||
| Жінки, які годують груддю | ||
| Пацієнти з порушенням функції нирок (специфікувати або категоризувати) | ||
| Пацієнти з порушенням функції печінки (специфікувати або категоризувати) | ||
| Пацієнти з порушеннями з боку серцево-судинної системи (специфікувати або категоризувати) | ||
| Частина популяції з генетичним поліморфізмом (зазначити, яким саме) | ||
| Імунокомпрометовані пацієнти | ||
МОДУЛЬ СIV. ПОПУЛЯЦІЇ, ЯКІ НЕ вивчались ПІД ЧАС клінічних випробувань
Надаються дані щодо обмеження популяції, що вивчалась під час клінічних випробувань, в частині прогнозування безпеки лікарського(их) засобу(ів) на фармацевтичному ринку. Припущення і міркування, наведені в модулі СIV.3, мають враховувати специфіку лікарського(их) засобу(ів) і його (їх) передбачуваного використання, тому можуть включати інші категорії, що досліджувалися обмежено або не досліджувалися взагалі. Обмеження можуть також виникати через застосування в різних умовах.
СIV.1. Обмеження виявлення побічних реакцій, загальні для програм клінічних випробувань
Під час клінічних випробувань через наявність відомих обмежень (швидше за все) не можуть бути виявлені види побічних реакцій, що зазначені нижче. Залежно від кількості пацієнтів, які брали участь у клінічних випробуваннях, тривалості експозиції, сумарної дози лікарського(их) засобу(ів), дії лікарського(их) засобу(ів) тощо потрібно обумовити, які саме побічні реакції можна виявити.
| Здатність виявлення побічних реакцій | Обмеження програми клінічних випробувань | Наслідки для цільової популяції |
| Рідкісні побічні реакції (може бути доцільним обрання інших методів визначення частоти розвитку побічних реакцій) | (наприклад, 12600 пацієнтів піддавалися впливу лікарського засобу протягом всієї програми клінічних випробувань) | (наприклад, побічні реакції з частотою більше ніж 1 на 4200 пацієнтів могли бути виявлені у випадку, коли не було фонових випадків) |
| Побічні реакції внаслідок тривалого застосування | (наприклад, 3000 жінок приймали препарат X більше 4 років і у них не було виявлено жодного випадку карциноми ендометрію. У 42 жінок, які приймали препарат Х, спостерігалася гіперплазія ендометрію порівняно з 35 жінками в групі без експозиції (2000)) | (наприклад, згідно з отриманими даними препарат Х не впливає на проліферацію ендометрію протягом перших 4 років лікування. Передбачається, що препарат Х (наводиться, що саме передбачається)) |
| Побічні реакції внаслідок кумулятивного ефекту | (наприклад, специфічна органна токсичність) | |
| Побічні реакції, що мають тривалий латентний період |
СIV.2. Вплив критеріїв виключення згідно з програмою клінічних випробувань
Надаються критерії виключення при проведенні клінічних випробувань. Інформація щодо критеріїв виключення має відображати їх вплив на програму клінічних випробувань та результати лікування цільової популяції.
| Критерії виключення, що є протипоказаннями до застосування | |
| Критерії | Значення для цільової популяції |
| 1 | |
| 2 і так далі | |
| Критерії виключення, що не є протипоказаннями до застосування | ||
| Критерії | Причина, через яку критерії віднесені до критеріїв виключення | Обґрунтування для невиконання критеріїв протипоказань до застосування |
| 1 | ||
| 2 і так далі | ||
СIV.3. Обмеження стосовно популяцій, які (як правило) недостатньо визначені в програмах клінічних випробувань
Перелічені нижче категорії популяцій недостатньо висвітлені в програмах клінічних випробувань. Їх актуальність залежатиме від лікарського(их) засобу(ів), показань до застосування і програми клінічних випробувань. Можуть бути й інші обов’язкові для врахування категорії.
1. Діти.
Особлива увага приділяється досвіду застосування в різних педіатричних вікових групах (наприклад, згідно з розподілом за ICH HARMONISED TRIPARTITE GUIDELINE. CLINICAL INVESTIGATION OF MEDICINAL PRODUCTS IN THE PEDIATRIC POPULATION), оскільки такі пацієнти перебувають на різних фізіологічних та анатомічних стадіях розвитку. Якщо педіатричний досвід застосування обмежений певними віковими категоріями, слід обумовити наслідки для інших педіатричних вікових груп:
недоношені;
новонароджені (від народження до 27 днів);
немовлята і малюки (від 28 днів до 23 місяців);
діти (від 2 років до (наприклад) 11 років);
підлітки (наприклад, з 12 до 18 років).
2. Літні пацієнти.
Обумовлюються наслідки застосування у пацієнтів 65 років і старше з належним розглядом початкового діапазону цього вікової групи. Ефект індивідуальних супутніх захворювань має обговорюватися в наступних розділах, але в цьому розділі потрібно розглянути вплив безлічі (помірних) супутніх захворювань, а також побічних реакцій, що потребують особливої уваги у літніх людей.
Застосування лікарського(их) засобу(ів) у різних вікових групах (наприклад, 65 — 69 років; 70 — 74 роки; 75 — 79 років).
Необхідність лабораторного скринінгу перед застосуванням лікарського(их) засобу(ів).
Вплив декількох супутніх захворювань.
ПР, що потребують особливої уваги у літніх людей (наприклад, запаморочення, вплив на ЦНС).
Вплив застосування декількох лікарських засобів.
3. Вагітні жінки та/або жінки, які годують груддю.
Якщо цільова популяція включає жінок дітородного віку, варто обумовити наслідки для вагітності та/або годування груддю. Якщо застосування контрацепції було критерієм включення в клінічне випробування, цей пункт має містити також таке:
кількість вагітностей і їх результат;
аналіз того, чому заходи контрацепції не подіяли (була це людська помилка чи взаємодія лікарських засобів (наприклад, з пероральними контрацептивами));
наслідки застосування в менш контрольованих умовах (наприклад, чи матимуть засоби контрацепції, ефективні у відносно суворих умовах проведення клінічного випробування, таку саму ефективність у реальному житті) і, якщо необхідно, пропозиції щодо поліпшення.
4. Пацієнти з порушенням функції печінки.
5. Пацієнти з порушенням функції нирок.
6. Пацієнти з іншими супутніми захворюваннями, наприклад:
з порушеннями з боку серцево-судинної системи;
імунокомпрометовані пацієнти (з імунодефіцитом), включаючи пацієнтів з трансплантацією органів.
7. Пацієнти, тяжкість захворювання яких відрізняється від критеріїв залучення пацієнтів до клінічних випробувань.
8. Частина популяції з відомим та відповідним поліморфізмом.
У випадках, коли необхідно, аналізується ступінь фармакогенетичних ефектів і наслідків застосування генетичних біомаркерів в цільовій популяції. Вказуються результати застосування у пацієнтів з певним генетичним маркером/специфічною мутацією чи без або з невідомим статусом, зокрема, коли показання до застосування потребують проведення генетичного тестування.
9. Пацієнти з різним расовим та/або етнічним походженням.
Обумовлюються результати застосування препарату пацієнтами різного расового та/або етнічного походження. Зокрема, відмінності в частоті або типах варіантів гена для ензимів метаболізму лікарського(их) засобу(ів) можуть призвести до важливих відмінностей у фармакокінетиці та/або частоті розвитку побічних реакцій. Такі відмінності в частоті окремих алелів можуть мати наслідки у разі застосування лікарського(их) засобу(ів) або бути передумовою для тестування перед призначенням у окремих частин популяції (наприклад, HLA-B* 1502 алель пов’язаний з розвитком серйозних побічних реакцій з боку шкіри при застосуванні карбамазепіну і виявляється приблизно в 10% деяких азіатських популяцій, але рідко у людей європеоїдної раси).
СIV.4. Висновки щодо популяцій, які не вивчалися під час клінічних випробувань, та інші обмеження програми клінічних випробувань
Відсутня інформація
У разі якщо відсутня інформація згідно з протоколом клінічних випробувань може становити суттєвий ризик для цільової популяції, такий факт вважається проблемою безпеки і має бути описаний в цьому розділі. Якщо відсутня інформація була добре вивчена поза програмою клінічних випробувань, про це необхідно зазначити (з перехресним посиланням на відповідний розділ плану управління ризиками) в коментарях. Лише проблеми безпеки, які все ще не вирішено, мають бути перенесені до модуля СVIII частини II плану управління ризиками.
| Проблеми безпеки, пов’язані з обмеженнями програми клінічних випробувань | Стан вирішення проблеми | |
| проблема безпеки | коментар | та/ні |
| 1 | ||
| 2 | ||
| … | ||
МОДУЛЬ СV. Післяреєстраційний ДОСВІД
Метою цього модуля є надання інформації про кількість пацієнтів, які зазнали впливу лікарського(их) засобу(ів) в післяреєстраційний період, про дані щодо його застосування в клінічній практиці (застосування за затвердженими показаннями і не за показаннями, включаючи застосування у спеціальних популяціях, зазначених в модулі СIV плану управління ризиками). Надається стисла інформація про кількість пацієнтів, залучених до клінічних досліджень, що тривають або завершені, які проводяться або з метою вивчення проблеми безпеки, або з метою вивчення застосування лікарського(их) засобу(ів). В деяких випадках детальні дані можуть бути недоступні. Наведені нижче таблиці є прикладами для пояснення, як саме можуть надаватися наявні дані. У цьому модулі також має бути надано детальну інформацію про важливі заходи, вжиті для оновлення інформації про безпеку лікарського(их) засобу(ів).
СV.1. заходи, вжиті регуляторними органами та/або власником реєстраційного посвідчення/заявником з питань безпеки
Надається перелік усіх значущих регуляторних заходів з питань безпеки (у тому числі з ініціативи власника реєстраційного посвідчення/заявника), вжитих у будь-якій країні. Важливі регуляторні заходи включають (але не виключно) обмеження затверджених показань до застосування, нові протипоказання, нові чи посилені попередження в розділах «Особливості застосування» та/або «Належні заходи з безпеки» інструкції для медичного застосування/короткої характеристики лікарського засобу або будь-яку дію щодо призупинення чи відкликання дозволу на маркетинг.
Такий перелік має бути кумулятивним, але вжиті нещодавно заходи (з моменту останнього оновлення цього модуля) повинні бути наведені спочатку окремо, а потім — у зведеному переліку. Заходи з безпеки, розпочаті з ініціативи власника реєстраційного посвідчення/заявника в декількох країнах, можуть бути викладені як одна дія (але мають бути перелічені всі країни і діапазон дат (наприклад, березень — вересень 2017)). Можуть надаватися коментарі, якщо така дія не застосовується до певного(их) лікарського(их) засобу(ів)/форми випуску.
Таблиця 1. Детальний опис заходів, вжитих регуляторними органами та/або власником реєстраційного посвідчення/заявником з питань безпеки з моменту останнього оновлення цього модуля
| Проблема безпеки | |
| Передумови | |
| Джерела, що підтверджують проблеми безпеки | |
| Вжиті заходи | |
| Країни, в яких застосовано заходи | |
| Дата(и) | |
Таблиця 2. Кумулятивний перелік заходів, вжитих регуляторними органами та/або власником реєстраційного посвідчення/заявником з міркувань безпеки
| Проблема безпеки 1 | ||||
| Країна(и) | Вжиті заходи | Коментар | Дата(и) | |
| Проблема безпеки 2 і так далі | ||||
| Країна(и) | Вжиті заходи | Коментар | Дата(и) | |
СV.2. Експозиція у післяреєстраційному періоді (за винятком досліджень)
В наведених нижче таблицях надаються (де є можливим) дані про пацієнтів, які застосовували лікарський засіб в післяреєстраційному періоді, за даними дослідження ринку. При розрахунку кількості пацієнтів на підставі даних про продаж деталізуються та обґрунтовуються одиниці виміру, що використовуються для розрахунку експозиції. Таблиці мають бути надані щодо кожного показання та способу застосування (де це можливо).
СV.2.1. Методи, що використовувались для розрахунку експозиції
Якщо в деяких таблицях використовуються різні методи для обчислення експозиції, цей розділ необхідно повторити перед відповідною(ими) таблицею(ями).
СV.2.2. Експозиція
| Розподіл за віковими групами та статтю | ||||
| Показання | ||||
| Вікова група | Кількість пацієнтів | Експозиція (наприклад, упаковки або пацієнто-роки) | ||
| Ч | Ж | Ч | Ж | |
| Вікова група 1 | ||||
| Вікова група 2 | ||||
| … | ||||
| Розподіл за показаннями | ||
| Показання | Кількість пацієнтів | Експозиція (наприклад, упаковки або пацієнто-роки) |
| Показання 1 | ||
| Показання 2 | ||
| … | ||
| Розподіл за способом застосування | ||
| Показання | ||
| Спосіб введення | Кількість пацієнтів | Експозиція (наприклад, упаковки або пацієнто-роки) |
| Перорально | ||
| Внутрішньовенно | ||
| … | ||
| Розподіл за дозами | ||
| Показання | ||
| Зазначення доз | Кількість пацієнтів | Експозиція (наприклад, упаковки або пацієнто-роки) |
| Доза 1 | ||
| Доза 2 | ||
| … | ||
| Розподіл за країнами | ||
| Показання | ||
| Країни | Кількість пацієнтів | Експозиція (наприклад, упаковки або пацієнто-роки) |
| Україна | ||
| Країни ЄС | ||
| Інші країни | ||
| … | ||
За можливості дані щодо застосування в країнах ЄС та країнах, які не входять до ЄС, мають бути надані за країнами або адміністративно-територіальними одиницями продажу лікарського засобу. Наведені категорії є прикладами, тому можуть бути використані інші відповідні категорії (наприклад, тривалість лікування тощо).
СV.3. Післяреєстраційне застосування в популяціях, які не брали участь у клінічних випробуваннях
Надаються (якщо є) дані про застосування лікарського(их) засобу(ів) в післяреєстраційному періоді в особливих популяціях, зазначених в модулі СIV плану управління ризиками як такі, що не вивчалися або обмежено піддавалися впливу лікарського(их) засобу(ів) у клінічних випробуваннях. Наводяться розрахунок числа експозиції та метод, що використовується для розрахунку експозиції, незалежно від того, застосовувався(лися) лікарський(і) засіб(оби) в цих групах за показаннями чи ні. Коментуються всі відмінності стосовно користі чи ризику лікарського(их) засобу(ів), виявлені в особливій популяції і цільовій популяції в цілому.
Таблиця 1
| Застосування в педіатрії | ||
| Застосування (теоретичне/заплановане) | Кількість пацієнтів | Коментар щодо будь-яких відмінностей стосовно користі чи ризику (в цільовій популяції в цілому) |
| Недоношені;новонароджені (від народження до 27 днів);немовлята і малюки (від 28 днів до 23 місяців);діти (від 2 років до (наприклад) 11 років);підлітки (наприклад, з 12 до 18 років) | ||
| Джерело даних | ||
| Метод розрахунку | ||
Таблиця 2
| Застосування у літніх пацієнтів | ||
| Застосування (теоретичне/заплановане) | Кількість пацієнтів | Коментар щодо будь-яких відмінностей стосовно користі чи ризику (в цільовій популяції в цілому) |
| 65 — 69 років70 — 74 роки75 — 79 років | ||
| Джерело даних | ||
| Метод розрахунку | ||
Таблиця 3
| Застосування у вагітних і жінок, що годують груддю | ||
| Застосування (теоретичне/заплановане) | Кількість пацієнтів | Коментар щодо будь-яких відмінностей стосовно користі чи ризику (в цільовій популяції в цілому) |
| ВагітніЖінки, які годують груддю | ||
| Джерело даних | ||
| Метод розрахунку | ||
Таблиця 4
| Застосування у пацієнтів з порушеннями функції печінки | ||
| Застосування (теоретичне/заплановане) | Кількість пацієнтів | Коментар щодо будь-яких відмінностей стосовно користі чи ризику (в цільовій популяції в цілому) |
| ЛегкеПомірнеВажке | ||
| Джерело даних | ||
| Метод розрахунку | ||
Таблиця 5
| Застосування у пацієнтів з порушеннями функції нирок | ||
| Застосування (теоретичне/заплановане) | Кількість пацієнтів | Коментар щодо будь-яких відмінностей стосовно користі чи ризику (в цільовій популяції в цілому) |
| ЛегкеПомірнеВажке | ||
| Джерело даних | ||
| Метод розрахунку | ||
Таблиця 6
| Інше застосування | ||
| Застосування | Кількість пацієнтів | Коментар щодо будь-яких відмінностей стосовно користі чи ризику (в цільовій популяції в цілому) |
| КатегоріяКатегоріяКатегорія | ||
| Джерело даних | ||
| Метод розрахунку | ||
СV.4. Застосування не за показаннями в післяреєстраційному періоді
Надається інформація про застосування лікарського засобу не за показаннями, тобто умисне використання лікарського(их) засобу(ів) з лікувальною метою за показаннями, що не зазначені в інструкції для медичного застосування лікарського(их) засобу(ів). Застосування не за показаннями включає застосування лікарського(их) засобу(ів) в педіатричній популяції, якій він (вони) не показаний(і) відповідно до затвердженої інструкції щодо застосування.
| Застосування не за показаннями | |||
| Категорія застосування | Країна | Джерело інформації | Коментар |
| (зазначається незареєстроване показання, за яким було призначено лікарський засіб) | (зазначається джерело отримання інформації про застосування лікарського засобу за незареєстрованим показанням) | ||
CV.5. Експозиція пацієнтів за даними епідеміологічних досліджень
Власники реєстраційних посвідчень/заявники повинні надати перелік епідеміологічних досліджень, що проводяться або проводились з метою вивчення питань безпеки або ефективності, досліджень застосування лікарського засобу з метою оцінки ефективності заходів з мінімізації ризиків. Перелік має включати дослідження, проведені самим власником реєстраційного посвідчення/заявником та/або де він є їх спонсором. До переліку потрібно включити також дослідження, проведені маркетинговим партнером власника реєстраційного посвідчення/заявника і ті, результати яких власник реєстраційного посвідчення/заявник отримав від третьої сторони.
| Назва та вид дослідження (наприклад, когортне або дослідження випадок-контроль) | Мета | Досліджу-вана популяція (джерело даних і країна) | Тривалість(період дослідження) | Кількість досліджуваних (у кожній групі або випадках), контроль і людино-година (якщо доречно) | Коментар |
| Дослідження 1 | |||||
| Дослідження 2 | |||||
| … |
МОДУЛЬ CVI. ДОДАТКОВІ ВИМОГИ України, ЄС ДО СПЕЦИФІКАЦІЇ З БЕЗПЕКИ
CVI.1. Потенційна шкода від передозування
Описується потенційна шкода від передозування — навмисного або випадкового. Особлива увага приділяється лікарським засобам з підвищеним ризиком передозування або внаслідок вузького терапевтичного діапазону, або внаслідок потенційної високої дозозалежної токсичності та/або високого ризику навмисного передозування у цільової популяції. Описуються випадки передозування, виявлені при проведенні клінічних випробувань. У разі необхідності передозування включається як проблема з безпеки до модуля CVIII плану управління ризиками.
CVI.2. Можливість (потенціал для) передачі збудника інфекції
Описується можливість (потенціал для) передачі збудника інфекції. Передача збудника інфекції може бути пов’язана з процесом виробництва або матеріалом, який використовується. Щодо вакцин обумовлюється будь-який потенціал для передачі живого вірусу. Щодо лікарських засобів сучасної терапії може бути надано перехресне посилання на модуль CVII плану управління ризиками.
CVI.3. Потенціал для зловживання у протиправних цілях
Обумовлюєтьсяпотенціал для використання як наркотичної речовини або спонукання до фізичного насильства тощо. За необхідності наводяться заходи з мінімізації ризиків.
CVI.4. Потенціал для медичних помилок
За необхідності цей розділ може бути складений окремо для кожного лікарського засобу.
CVI.4.1. Опис медичних помилок, виявлених під час проведення клінічних випробувань
| Торговельна назва лікарського(их) засобу(ів) | ||||
| Опис помилки | Кількість випадків | Аналіз причини | Заходи, вжиті для усунення медичних помилок | Коментар |
CVI.4.2. Заходи, вжиті для усунення медичних помилок щодо кінцевого(их) продукту(ів) (лікарського(их) засобу(ів)) на ринку
Обумовлюється, яких помилок вдалося уникнути за допомогою дизайну лікарського засобу, упаковки, маркування тощо, а саме:
уникнення помилок через помилковий вибір препарату;
уникнення помилок через неправильне дозування (дозування, форма випуску, концентрація);
уникнення помилок через неправильний спосіб уведення.
CVI.4.3. Ефект несправності пристроїв для введення
Інформація надається для лікарських засобів, що вводяться за допомогою спеціального пристрою.
CVI.4.4. Повідомлення про медичні помилки
| Торговельна назва лікарського(их) засобу(ів) | ||||
| Опис помилки | Кількість випадків | Аналіз причини | Заходи, вжиті для усунення медичних помилок | Коментар |
Щодо лікарських засобів однієї групи з різними силою дії, дозуванням або концентрацією, різним складом слід розглянути питання про визначення медичної помилки та включення її до проблеми безпеки.
CVI.5. Потенціал для застосування не за показаннями
Обумовлюється потенціал для застосування лікарського засобу не за показаннями. Це особливо актуально, коли лікарський засіб показаний тільки для обмеженої частини популяції в популяції або існують ситуації, коли лікарський засіб не повинен застосовуватися в цілях безпеки. Враховується також потенціал застосування лікарського засобу для лікування інших захворювань, якщо це ймовірно.
CVI.6. Специфічні педіатричні питання
CVI.6.1. Проблеми, виявлені у планах педіатричних досліджень
Детально викладаються всі проблеми, виявлені в планах педіатричних досліджень, і зазначається їх зв’язок з показаннями, що охоплені планом управління ризиками. Надається детальна інформація про те, які саме рекомендації, визначені в плані педіатричних досліджень, необхідно розглянути. Можна робити перехресні посилання на інші модулі/частини плану управління ризиками.
| Торговельна назва лікарського(их) засобу(ів) | ||
| Проблема (безпека або довгострокова ефективність) | Пояснення | Значення проблеми для даних, наданих у плані управління ризиками, та механізм її вирішення в разі потреби |
CVI.6.2. Потенціал для застосування у педіатричній популяції не за показаннями
Якщо захворювання або розлад, для лікування якого призначений лікарський засіб, зустрічається в педіатричній популяції, а лікарський засіб не зареєстрований для всіх педіатричних вікових груп, зазначається потенціал використання такого лікарського засобу не за показаннями у вікових групах, у яких він не показаний для застосування. Оскільки при обмеженому виборі лікування є ймовірність того, що лікарі не будуть суворо дотримуватися зареєстрованих показань до застосування, тому важливо обумовити потенціал педіатричних проблем і розглянути можливість їх включення до проблем безпеки. Також обумовлюються всі виявлені випадки реального застосування (за необхідності), робляться перехресні посилання на інші відповідні розділи плану управління ризиками.
CVI.7. Висновки
| Проблеми безпеки з цього модуля (переносяться до модуля CVIII частини ІІ) | |
| Проблема безпеки | Коментар |
МОДУЛЬ CVII. ІДЕНТИФІКОВАНІ ТА ПОТЕНЦІЙНІ РИЗИКИ
Надається більш детальна інформація про важливі виявлені та потенційні ризики. Цей модуль має бути стислим (без нагромаджень даних в таблицях або переліку побічних реакцій за даними клінічних випробувань, без дублювання фактичного змісту розділу «Побічні реакції» інструкції для медичного застосування та/або короткої характеристики на лікарський засіб) та містити лише інформацію про важливі виявлені та потенційні побічні реакції, важливі виявлені та потенційні взаємодії з іншими лікарськими засобами, продуктами харчування та іншими речовинами, а також важливі ефекти, властиві фармакологічній групі лікарського засобу.
При визначенні, який саме з ризиків є важливим, потрібно враховувати декілька факторів, включаючи вплив на конкретного пацієнта, серйозність ризику та вплив на здоров’я населення. До цього модуля слід включити будь-який ризик, який є клінічно значущим і який внесений/найімовірніше буде внесений до розділу «Протипоказання» або «Особливості застосування» інструкції для медичного застосування та/або короткої характеристики на лікарський засіб. Крім того, необхідно розглянути включення ризиків, які хоча й не настільки серйозні, щоб вимагати специфічних попереджень або застережних заходів, але спостерігаються у значної кількості пацієнтів, впливають на якість їх життя і можуть призвести до серйозних наслідків, якщо їх не лікувати (наприклад, болісна нудота і блювання при хіміотерапії).
Щодо деяких лікарських засобів проблему для безпеки може становити утилізація використаного препарату (наприклад, трансдермальні пластирі, оскільки вони після використання можуть містити значну кількість активного фармацевтичного інгредієнта). Можуть вказуватися також випадки ризику для довкілля при утилізації лікарського засобу через відомий шкідливий вплив на навколишнє середовище (наприклад, речовини, що особливо небезпечні для водної флори і фауни, які не повинні утилізуватися на звалищах).
Оскільки існують різні додаткові категорії ризиків, що стосуються тільки високотехнологічних лікарських засобів, для таких лікарських засобів цей модуль має бути поданий за іншою структурою. План управління ризиками повинен містити лише одну версію модуля CVII.
CVII.1. Нещодавно виявлені проблеми з безпеки
(з моменту останньої редакції цього модуля)
| Проблема безпеки | |
| Подробиці | |
| Джерело | |
| Запропоновано нові дослідження у плані з фармаконагляду | Так/Ні |
| Запропоновано нові заходи з мінімізації ризику | Так/Ні |
CVII.2. Звіти про нещодавнє(і) дослідження, результати якого(их) вказують на проблеми з безпеки
Розглядаються звіти про дослідження (проміжні або заключні будь-якого виду), що містять результати, які справляють значний вплив на існуючі питання безпеки. Такі звіти опрацьовуються за період з моменту останньої версії плану управління ризиками. Висновки мають бути включені до інших частин і модулів специфікації безпеки (де це доречно) з наданням детальної інформації про ризик у модулі CVII.3. Інформація щодо вищевказаних проблем з безпеки має також надаватись в інших модулях.
CVII.3. Детальна інформація про важливі ідентифіковані і потенційні ризики, виявлені у дореєстраційному та післяреєстраційному періодах (включаючи вперше виявлені)
Наводиться інформація щодо важливих ідентифікованих і важливих потенційних ризиків. Цей модуль має бути стислим (без нагромаджень даних в таблицях або переліку побічних реакцій за даними клінічних випробувань, без дублювання пропонованого чи фактичного змісту розділу «Побічні реакції» інструкції для медичного застосування та/або короткої характеристики на лікарський засіб). Для планів управління ризиками, що складаються для одного лікарського засобу, ризики, пов’язані з показаннями до застосування або лікарською формою (за необхідності), можуть бути обумовлені як окремі проблеми безпеки (наприклад, випадкове внутрішньовенне введення може бути проблемою безпеки одного лікарського засобу для перорального і підшкірного застосування). Може бути доцільним включення ризиків, пов’язаних зі значною зміною у виробничому процесі (зокрема, для біологічних лікарських засобів), і ризиків, пов’язаних з медичними помилками.
У планах управління ризиками, що охоплюють кілька лікарських засобів, у випадку, коли ідентифіковані і потенційні ризики істотно відрізняються для різних лікарських засобів, може бути доцільним таке класифікування ризиків, яке дасть змогу визначити, які саме ризики пов’язані з певним лікарським засобом. Розподіл ідентифікованих і потенційних ризиків за наведеними нижче категоріями необхідно проводити тільки у випадку, коли ризики точно не пов’язані з деякими лікарськими засобами, що охоплені планом управління ризиками, а відсутність розподілу може призвести до плутанини. Категорії, що можуть бути розглянуті, включають:
ризики, пов’язані з активним фармацевтичним інгредієнтом.
До цієї категорії слід віднести важливі ідентифіковані або потенційні ризики, які є загальними для всіх лікарських форм, способів введення та цільових популяцій. Є ймовірним, що для більшості лікарських засобів переважна частина ризиків потрапляє до цієї категорії;
ризики, пов’язані зі специфічними формою випуску, показанням або шляхом введення.
Приклади можуть включати план управління ризиками, що охоплює два лікарських засоби з абсолютно різними показаннями до застосування (наприклад, силденафіл для одного лікарського засобу має показання для лікування еректильної дисфункції, а для іншого — лікування легеневої артеріальної гіпертензії);
ризики, пов’язані зі специфічною цільовою популяцією.
Прикладом такої цільової популяції є педіатрична, у якої можуть існувати додаткові ризики, пов’язані з фізичним, розумовим і статевим розвитком, що не є актуальним для лікарського засобу, призначеного виключно для застосування у дорослих пацієнтів;
ризики, пов’язані з переведенням лікарського засобу до групи таких, що відпускаються без рецепта.
Для кожного важливого ідентифікованого і важливого потенційного ризику надається (у разі наявності) викладена нижче інформація (така інформація може викладатися не лише у табличному варіанті. У такому разі у структурі тексту мають використовуватися розділи та пункти).
| Ідентифікований/потенційний ризик (зазначається ідентифікований або потенційний ризик) | |
| Частота з 95% довірчим інтервалом | Чітко зазначається, який частотний параметр використовувався (наприклад, показник частоти захворюваності або частота ризику і джерело даних, популяція сліпого клінічного випробування, епідеміологічного дослідження). Для визначення частоти виявлених ризиків надаються дані для всієї популяції та відповідної частини популяції.Якщо є явні відмінності в частоті між популяціями, про це має бути зазначено |
| Серйозність/наслідки | Надається розподіл за наслідками (наприклад, …% летальних випадків, …% видужали, …% з лікуванням/без лікування (з наслідками/без наслідків),…% не видужали, …% госпіталізованих тощо) |
| Тяжкість і характер ризику | Надається інформація про ступінь тяжкості (якщо є) |
| Фонова частота/поширеність | Надається фонова частота/поширеність ризику в цільовій(их) популяції(ях), що не піддавалася(ися) впливу лікарського засобу |
| Групи ризику та фактори ризику | Надається опис груп та факторів пацієнта, дози, часу або інших факторів, якщо такі є, включаючи кумулятивні або синергічні чинники |
| Потенційний механізм | Надається опис потенційного механізму |
| Запобігання | Надаються дані щодо прогнозування або запобігання розвитку побічних реакцій, ефекту відомих факторів ризику, пом’якшення наслідків шляхом раннього виявлення |
| Вплив на пацієнта | Наводяться дані щодо впливу на якість життя |
| Потенційний вплив проблеми безпеки на здоров’я населення | Надаються опис та інформація з використанням за можливості, наприклад, даних про кількість випадків потенційної шкоди та/або очікувану кількість пацієнтів, на яких вплине проблема безпеки, кількість госпіталізацій, летальних випадків, враховуючи передбачене використання в популяції |
| Ідентифікований/потенційний ризик (зазначається ідентифікований або потенційний ризик) | |
| Джерело даних | Надається стислий опис та робиться перехресне посилання на підтвердні дані в CTD або додатку |
| MedDRA-терміни | Зазначаються терміни, що використовуються у відповідному додатку до плану управління ризиками, для післяреєстраційного нагляду |
CVII.4. Ідентифіковані і потенційні взаємодії
CVII.4.1. Огляд потенційних взаємодій
Обумовлюються основні шляхи метаболізму та елімінації і потенціал для взаємодії у зв’язку з впливом на CYP-ензими, виведенням лікарського засобу тощо.
CVII.4.2. Важливі ідентифіковані і потенційні взаємодії
Розглядаються ідентифіковані і потенційні фармакокінетична та фармакодинамічна взаємодії не лише з лікарськими засобами, що застосовуються для лікування певного захворювання, але й з тими, що найчастіше використовуються в цій цільовій популяції. Обумовлюються також важливі взаємодії з рослинними лікарськими засобами або з їжею.
| Взаємодіюча(і) субстанція(ї) | |
| Ефект взаємодії | |
| Джерело даних | |
| Можливий механізм | |
| Потенційний ризик для здоров’я | |
| Висновок |
Розглядається питання щодо необхідності включення взаємодії як проблеми з безпеки до модуля CVIII частини II.
CVII.5. Ефекти, властиві фармакологічній групі лікарського засобу, що охоплений планом управління ризиками
Зазначаються ризики, які (як вважається) є спільними для фармакологічної групи.
CVII.5.1. Важливі ідентифіковані або потенційні ризики, властиві фармакологічній групі, які вже враховано
Щодо ризиків, включених до розділу «Детальна інформація про важливі ідентифіковані і потенційні ризики, виявлені у дореєстраційному та післяреєстраційному періодах», слід надати таку інформацію:
| Ризик | Частота розвитку при застосуванні лікарського засобу за даними клінічних випробувань | Частота розвитку при застосуванні інших лікарських засобів цієї самої фармакологічної групи (джерело даних / посилання) | Коментар |
| Ризик 1 | Наприклад,лікарський засіб A; лікарський засіб B; лікарський засіб C; Огляд побічних реакцій BMJ 2008:5; 214–217 |
||
| Ризик 2 | |||
| … |
CVII.5.2. Важливі ефекти фармакологічної групи, що не наводилися вище
Надається інформація згідно з наведеною нижче таблицею щодо кожного з важливих ризиків, що не були включені до модуля CVII «Детальна інформація про важливі ідентифіковані і потенційні ризики, виявлені у дореєстраційному та післяреєстраційному періодах», але (як вважається) є загальними для фармакологічної групи. Якщо важливий потенційний ризик, пов’язаний з іншими лікарськими засобами цієї фармакологічної групи, не вважається проблемою безпеки лікарського засобу, для якого розробляється план управління ризиками, це необхідно обґрунтувати та надати відповідні докази.
| Потенційний ризик | |
| Серйозність/наслідки | |
| Тяжкість і характер ризику | Наприклад, надаються дані за ступенем тяжкості у вигляді таблиці, якщо такі дані наявні |
| Частота ризику при застосуванні лікарських засобів цієї або подібної фармакологічної групи з довірчим інтервалом 95% | |
| Групи ризику та фактори ризику | Надаються дані щодо застосування, дози, часу та щодо чутливості й інших факторів (якщо такі дані наявні) |
| Потенційний механізм | Надається інформація щодо потенційного механізму |
| Коментар | |
МОДУЛЬ CVIII. РЕЗЮМЕ ПРОБЛЕМ БЕЗПЕКИ
Складається резюме проблем безпеки, зазначених у модулях CII, CIV, CVI, CVII частини II плану управління ризиками. Проблемою безпеки може бути:
важливий ідентифікований ризик;
важливий потенційний ризик;
відсутня інформація.
У плані управління ризиками, що охоплюють кілька лікарських засобів, для яких можуть існувати істотні відмінності у важливих ідентифікованих і важливих потенційних ризиках для різних препаратів, подібно викладенню інформації щодо ризиків в модулі CVII може бути доцільним виділення в резюме проблем безпеки окремих підрозділів із зазначенням в заголовках цих підрозділів відповідних ідентифікованих та потенційних ризиків. Підрозділи, що можуть бути розглянуті, включають:
проблеми безпеки, пов’язані з активним фармацевтичним інгредієнтом;
проблеми безпеки, пов’язані зі специфічними формою випуску або шляхом уведення;
проблеми безпеки, пов’язані з цільовою популяцією;
ризики, пов’язані з переведенням лікарського засобу до складу безрецептурних.
Виділення проблем безпеки в окремі підрозділи слід розглядати тільки тоді, коли ризики чітко не стосуються певних лікарських засобів і включення їх до загального переліку може призвести до плутанини.
ЗВЕДЕНА ТАБЛИЦЯ ПРОБЛЕМ БЕЗПЕКИ
| Основні проблеми безпеки | |
| Важливі ідентифіковані ризики | (перелік) |
| Важливі потенційні ризики | (перелік) |
| Відсутність інформації | (перелік) |
ЧАСТИНА III. ПЛАН З ФАРМАКОНАГЛЯДУ
План з фармаконагляду має містити детальну інформацію про діяльність з фармаконагляду/досліджень, що призначені для виявлення та/або вивчення будь–яких питань, пов’язаних з безпекою та ефективністю застосування лікарського засобу у цільовій популяції, проблем безпеки та етапу життєвого циклу, на якому знаходиться лікарський засіб. План з фармаконагляду може включати дані досліджень для оцінки ефективності заходів з мінімізації ризику для важливих ризиків, коли потрібне проведення дослідження.
Якщо деякі проблеми безпеки добре вивчені, достатнім буде здійснення рутинного фармаконагляду. Залежно від проблеми безпеки, а також досліджуваного аспекту план з фармаконагляду, крім епідеміологічних (неінтервенційних) досліджень (наприклад, когортне, дослідження випадок-контроль, витяг з реєстрів, дослідження утилізації лікарського засобу тощо), може також включати інтервенційні дослідження або ще рідше — доклінічні дослідження (наприклад, клінічні випробування, випробування in vivo або in vitro).
У розділі III.1 плану з фармаконагляду потрібно розглянути кожну з проблем безпеки і питання, що потребують дослідження. Розділ III.2 повинен містити детальну інформацію про всі вжиті заходи для встановлення (визначення) ефективності діяльності з мінімізації ризиків. У розділі III.3 мають бути стисло викладені результати будь-яких досліджень. Якщо результати дослідження стосуються ефективності заходів з мінімізації ризиків, їх стисло наводять у розділі III.3. Якщо результати свідчать, що заходи з мінімізації ризиків неефективні, необхідно в частині V плану управління ризиками надати аналіз цієї ситуації та пропозиції щодо виправлення допущених помилок. У розділі III.4 надається детальна інформація щодо кожного з досліджень і основних етапів. Розділ III.5 містить підсумок всіх даних, наведених у плані з фармаконагляду, — завершених, поточних та запланованих заходів.
III.1. ПИТАННЯ БЕЗПЕКИ ТА РОЗГЛЯД ЗАПЛАНОВАНИХ ЗАХОДІВ З ФАРМАКОНАГЛЯДУ
Щодо кожної проблеми безпеки, зазначеної в модулі CVIII частини II, необхідно навести деталі конкретного аспекту, що досі потребує підтвердження або подальшого дослідження (наприклад, підтвердження охоплення дослідженням факторів ризику). Якщо проблему безпеки добре вивчено, запропоновані заходи обмежуватимуться лише рутинним фармаконаглядом. Для деяких аспектів, можливо, знадобиться більше одного виду діяльності для вивчення проблеми безпеки з різними заходами, що мають різну мету. Складання (якщо планується) спеціального опитувальника для збору структурованих даних з безпеки, що становлять особливий інтерес, хоча й вважається рутинним фармаконаглядом, але все одно вказується і включається до додатка 7 до плану управління ризиками. Вимога щодо повідомлення про специфічні побічні реакції при застосуванні лікарського засобу за певні проміжки часу в результаті попередньої оцінки (наприклад, регулярно оновлюваний звіт з безпеки/регулярний звіт з оцінки користь/ризик) теж вважається рутинним фармаконаглядом, але детально описується у таблиці навпроти специфічної проблеми безпеки. Невиконані додаткові заходи з фармаконагляду повинні детально описуватись в розділі III.4.
| Проблема безпеки 1 | ||
| Аспекти, що вимагають підтвердження або подальшого дослідження | Пропонована рутинна і додаткова діяльність з фармаконагляду | Мета |
| 1 | ||
| 2 | ||
| … | ||
| Проблема безпеки 2 і так далі | ||
| Аспекти, що вимагають підтвердження або подальшого дослідження | Пропонована рутинна і додаткова діяльність з фармаконагляду | Мета |
| 1 | ||
| 2 | ||
| … | ||
III.2. ДОДАТКОВА ДІЯЛЬНІСТЬ З ФАРМАКОНАГЛЯДУ ДЛЯ ОЦІНКИ ЕФЕКТИВНОСТІ ЗАХОДІВ З МІНІМІЗАЦІЇ РИЗИКІВ
Надається інформація щодо використання заходів з мінімізації ризику, які потребують використання нестандартної діяльності з фармаконагляду для оцінки ефективності.
| Заходи з мінімізації ризику | ||
| Причина, що оцінюється та потребує подальшої активності | Назва заходу | Обґрунтування |
| Причина 1 | ||
| Причина 2 | ||
| … | ||
ІII.3. ДОСЛІДЖЕННЯ ТА ІНШІ ЗАХОДИ, ЩО ПРОВОДЯТЬСЯ З МОМЕНТУ ОСТАННЬОГО ОНОВЛЕННЯ ПЛАНУ З ФАРМАКОНАГЛЯДУ
Надається стисле резюме завершених досліджень та/або заходів з моменту останнього оновлення плану з фармаконагляду. Стислий звіт про дослідження має бути поданий у відповідному додатку до плану управління ризиками.
| Назва дослідження/заходу | |
| Досліджувана(і) проблема(и) безпеки/вивчення заходів з мінімізації ризику | |
| Стисле резюме результатів | |
| Висновки | |
III.4. ІНФОРМАЦІЯ ПРО НЕРЕАЛІЗОВАНІ ДОДАТКОВІ ЗАХОДИ З ФАРМАКОНАГЛЯДУ
Власник реєстраційного посвідчення/заявник у плані з фармаконагляду повинен запропонувати види для нових додаткових досліджень з фармаконадгляду/заходів, які будуть підтверджені або перекласифіковані при оцінці плану управління ризиками. Оновлений план управління ризиками має відображати погоджену з регуляторним органом (уповноваженою експертною установою) (поряд з будь-якими пропонованими новими дослідженнями) інформацію щодо нових додаткових досліджень з фармаконагляду/заходів у плані з фармаконагляду.
III.4.1. Запропоновані обов’язкові додаткові заходи з фармаконагляду (ключові для співвідношення користь/ризик)
Призначені заходи, що вважаються ключовими для співвідношення користь/ризик лікарського засобу
| № з/п | Опис заходу (або назва дослідження, якщо відомо) | Етап(и) | Дата(и) |
| 1 | 1. (наприклад, подання протоколу для затвердження) | ||
| 2. (наприклад, початок дослідження) | |||
| 3. (наприклад, завершення дослідження) | |||
| 4. (наприклад, заключний звіт) | |||
| 2 | 1. (наприклад, подання протоколу для затвердження) | ||
| 2. (наприклад, початок дослідження) | |||
| 3. (наприклад, завершення дослідження) | |||
| 4. (наприклад, заключний звіт) |
III.4.2. Обов’язкові додаткові заходи з фармаконагляду (спеціальні зобов’язання)
| № з/п | Опис заходу (або назва дослідження, якщо відомо) | Етап(и) | Дата(и) |
| 1 | 1. (наприклад, подання протоколу для затвердження) | ||
| 2. (наприклад, початок дослідження) | |||
| 3. (наприклад, завершення дослідження) | |||
| 4. (наприклад, заключний звіт) | |||
| 2 | 1. (наприклад, подання протоколу для затвердження) | ||
| 2. (наприклад, початок дослідження) | |||
| 3. (наприклад, завершення дослідження) | |||
| 4. (наприклад, заключний звіт) |
Неінтервенційні дослідження, включені до категорій 1 і 2, є предметом нагляду, що здійснюється відповідно до глави 5 розділу V Порядку здійснення фармаконагляду щодо неінтервенційних досліджень.
III.4.3. Необхідні додаткові заходи з фармаконагляду для вирішення специфічних проблем безпеки або для оцінки ефективності заходів з мінімізації ризиків
Надається інформація про категорію заходів, які проводяться або фінансуються власником реєстраційного посвідчення/заявником для вирішення специфічних проблем безпеки, але не включають призначених досліджень або є спеціальним зобов’язанням (тобто належать до категорій 1 або 2, що наведені вище). Заходи можуть включати випробування або дослідження, які ще проводяться (наприклад, для клінічних випробувань діяльність включатиме надання звіту) або плануються (у цьому разі діяльність полягатиме в проведенні дослідження). До таких заходів слід включити дослідження або заходи з питань безпеки, проведення яких вимагає інший регуляторний орган. Дослідження, що проводяться за запитом регуляторного органу (але не є умовою отримання реєстраційного посвідчення) або можуть бути запропоновані власником реєстраційного посвідчення/заявником з метою вивчення питання безпеки, також мають бути включені до цього розділу. Дослідження, що проводяться з метою оцінки ефективності заходів з мінімізації ризиків також, як правило, належать до цієї категорії.
Необхідні додаткові заходи з фармаконагляду
| № з/п | Опис заходу (або назва дослідження, якщо відомо) | Етап(и) | Дата(и) |
| 1 | 1. (наприклад, подання протоколу для затвердження) | ||
| 2. (наприклад, початок дослідження) | |||
| 3. (наприклад, завершення дослідження) | |||
| 4. (наприклад, заключний звіт) | |||
| 2 | 1. (наприклад, подання протоколу для затвердження) | ||
| 2. (наприклад, початок дослідження) | |||
| 3. (наприклад, завершення дослідження) | |||
| 4. (наприклад, заключний звіт) |
III.4.4. Заявлені додаткові заходи з фармаконагляду
Надається інформація про діяльність, яка може забезпечити додаткові докази, але головною метою якої не є вивчення конкретного питання безпеки. Така діяльність включає дослідження утилізації лікарського засобу, що проводяться як умова для реімбурсації, дослідження, що проводяться на вимогу інших регуляторних органів з причин, не пов’язаних зі специфічною проблемою безпеки, або дослідження безпеки, проведені третьою стороною, про які власник реєстраційного посвідчення/заявник знає, але не фінансує.
Додаткові заходи з фармаконагляду.
| № з/п | Опис заходу (або назва дослідження, якщо відомо) | Очікувана дата звіту |
| 1 |
III.5. РЕЗЮМЕ ПЛАНУ З ФАРМАКОНАГЛЯДУ
III.5.1. Поточні і плановані додаткові дослідження з фармаконагляду (заходи згідно з планом з фармаконагляду)
Надається повний огляд всіх поточних і запланованих досліджень згідно з категоріями 1–3.
| Дослідження/захід, вид, назва та категорія (1–3) | Мета | Досліджувана проблема безпеки | Статус (планується, розпочато) | Дата надання проміжних або заключного звітів (запланована або фактична) |
| (наприклад, реєстр онкологічних пацієнтів CRUCIAL Медичного коледжу Айдахо (неінтервенційне когортне, 3)) | (наприклад, дослідження тривалості виживання, часу до прогресува-ння, профілю безпеки та якості життя пацієнтів з первинним раком печінки або мета-стазами солідної пухлини) | (наприклад, брадикардія, тромбоз, лейкопенія, використання у пацієнтів з порушеннями функції нирок) | (наприклад, протокол, наданий PRAC) | (наприклад, проміжні звіти плануються у червні 2018, 2019, заключний — грудні 2020) |
| (наприклад, валідація тесту на антитіла (доклінічне дослідження, 3)) | (наприклад, порівняння тесту Supertest з поточним золотим стандартом) | (наприклад, розвиток антитіл) | (наприклад, заплановане на початок березня 2017) | (наприклад, заключний звіт — грудень 2018) |
ІII.5.2. Таблиця завершених досліджень/заходів плану з фармаконагляду
Надається інформація про всі завершені дослідження категорій 1–3.
| Дослідження/захід, вид, назва та категорія (1–3) | Мета | Досліджувана проблема безпеки | Статус (завершення) | Дата надання заключного звіту |
| (наприклад, ABC-124(рандомізоване контрольоване дослідження, 3)) | (наприклад, порівнюється до прогресування захворювання для 3 різних доз, порівнюється профіль безпеки різних доз) | (наприклад, брадикардія, поява антитіл, застосування у пацієнтів з нирковою недостатністю) | (наприклад, завершено,надано заключний звіт) | (наприклад, заключний звіт поданий 31 березня 2012) |
ЧАСТИНА IV. ПЛАНИ ЩОДО ПІСЛЯРЕЄСТРАЦІЙНИХ ДОСЛІДЖЕНЬ ЕФЕКТИВНОСТІ
IV.1. ЗАСТОСОВНІСТЬ ДАНИХ ЩОДО ЕФЕКТИВНОСТІ ДЛЯ ВСІХ ПАЦІЄНТІВ ЦІЛЬОВОЇ ПОПУЛЯЦІЇ
Стисло викладається інформація щодо наявності будь-яких прогалин у знаннях про ефективність застосування лікарського засобу в цільовій популяції та щодо необхідності (у разі потреби) проведення подальших досліджень ефективності в післяреєстраційному періоді. Не надається інформація про дослідження ефективності, метою яких було розширення показань. Зазначена інформація має бути надана власником реєстраційного посвідчення/заявником на підставі даних модулів СIII, СIV і СV частини II плану управління ризиками.
Фактори, що можуть стати підставою для розгляду:
застосовність даних про ефективність лікарського засобу для всіх пацієнтів цільової популяції (наприклад, якщо 98% пацієнтів у випробуваннях були європеоїдної раси, потрібно вивчати, чи буде такою самою ефективність в інших расових групах цільової популяції);
фактори, які можуть вплинути на ефективність лікарського засобу при його застосуванні в повсякденній медичній практиці (наприклад, застосування в загальній практиці, а не клінічних дослідженнях у відділенні лікарні);
тривала ефективність;
будь-які докази того, що може існувати варіабельність ефективності лікування у частини популяції.
IV.2. ДАНІ ЩОДО ДОСЛІДЖЕНЬ ЕФЕКТИВНОСТІ В ПІСЛЯРЕЄСТРАЦІЙНОМУ ПЕРІОДІ
Власник реєстраційного посвідчення/заявник має надати перелік всіх післяреєстраційних досліджень ефективності, запропонованих ним, а також перелік тих досліджень, що були вимогою регуляторного органу або є спеціальним зобов’язанням. Синопсис протоколів необхідно викласти у відповідному додатку до плану управління ризиками.
Дослідження ефективності, які є спеціальним зобов’язанням та/або умовою отримання реєстраційного посвідчення:
| Опис дослідження (включаючи мету і номер дослідження) | Етап(и) | Дата(и) |
| 1. (наприклад, подання протоколу для затвердження) | ||
| 2. (наприклад, початок дослідження) | ||
| 3. (наприклад, завершення дослідження) | ||
| 4. (наприклад, заключний звіт) |
Інші дослідження ефективності:
| Опис дослідження (включаючи мету і номер дослідження) | Етап(и) | Дата(и) |
| 1. (наприклад, подання протоколу для затвердження) | ||
| 2. (наприклад, початок дослідження) | ||
| 3. (наприклад, завершення дослідження) | ||
| 4. (наприклад, заключний звіт) |
IV.3. РЕЗЮМЕ ПЛАНУ ПІСЛЯРЕЄСТРАЦІЙНИХ ДОСЛІДЖЕНЬ ЕФЕКТИВНОСТІ
Повний огляд всіх досліджень (тих, що тривають, запланованих)
| Дослідження (тип і номер) | Мета | Досліджувані питання ефективності | Статус (заплановане, розпочате) | Дата подання проміжних та заключного звітів |
IV.4. РЕЗЮМЕ ЗАВЕРШЕНИХ ПІСЛЯРЕЄСТРАЦІЙНИХ ДОСЛІДЖЕНЬ ЕФЕКТИВНОСТІ
| Дослідження (тип і номер) | Мета | Досліджувані питання ефективності | Статус (завершено, надано заключний звіт) | Дата подання проміжних та заключного звітів |
ЧАСТИНА V. ЗАХОДИ З МІНІМІЗАЦІЇ РИЗИКІВ
Надається інформація щодо всіх проблем безпеки, що зазначені в модулі СVIII «Резюме проблеми безпеки», в частині необхідності заходів з мінімізації ризиків. Якщо жодні заходи з мінімізації ризиків не пропонуються, навпроти мети слід написати «нічого не пропонується».
Якщо кілька компонентів складають один захід з мінімізації ризиків (наприклад, план щодо запобігання вагітності може містити надання навчального матеріалу для лікарів та пацієнтів, алгоритми для вирішення питання дітородного потенціалу, картки нагадування пацієнтам тощо), вони мають бути об’єднані.
Щодо кожної проблеми безпеки потрібно вказати детальну інформацію про те, які критерії використовуватимуться для визначення успішності заходів з мінімізації ризиків (наприклад, менше 2 повідомлень про вагітність за певний період Х; відсутність повідомлень про випадки печінкової недостатності; дослідження застосування лікарського засобу показало <5% вживання препарату не за призначенням тощо).
V.1. ЗАХОДИ З МІНІМІЗАЦІЇ РИЗИКІВ ДЛЯ ПРОБЛЕМ БЕЗПЕКИ
| Проблема безпеки | |
| Мета заходів з мінімізації ризику | |
| Рутинні заходи з мінімізації ризику | Синопсис (пропонованого) тексту з інструкції для медичного застосування/короткої характеристики на лікарський засіб(наприклад, зниження дози в розділі «Спосіб застосування та дози»; застереження в розділі «Особливості застосування»; додавання інформації до розділу «Побічні реакції» тощо) |
| Коментар (наприклад, щодо будь-яких відмінностей в інструкції для медичного застосування/короткій характеристиці на лікарський засіб) | |
| Інші рутинні заходи з мінімізації ризику (наприклад, лікарський засіб застосовується лише за рецептом; лікарський засіб можуть призначати тільки лікарі, які мають досвід лікування, тощо) |
|
| Додаткові заходи з мінімізації ризику (повторити, якщо необхідно) | Мета й обґрунтування, чому потрібні |
| Пропоновані заходи/причини й обґрунтування |
| Ефективність заходів з мінімізації ризиків | |
| Як визначатиметься ефективність заходів з мінімізації ризиків для проблеми безпеки | Якщо планується дослідження, воно також має бути включене до частини III.2 «Додаткова діяльність з фармаконагляду для оцінки ефективності заходів з мінімізації ризику» цього додатка |
| Критерії оцінки успішності пропонованих заходів з мінімізації ризику | |
| Запланована дата для оцінки | |
| Результати визначення ефективності | Забезпечується остання оцінка кожного оновлення плану управління ризиками. Для заходів з мінімізації ризику, для яких плануються дослідження, всі результати повинні бути зазначені в частині III.2 з висновками та іншими заходами щодо виправлення проблеми безпеки, зазначеної у розділі …, модулі… |
| Вплив заходів з мінімізації ризику | |
| Коментар | |
V.2. НЕЕФЕКТИВНІСТЬ ЗАХОДІВ З МІНІМІЗАЦІЇ РИЗИКІВ (ЯКЩО Є)
Надається перелік проблем безпеки та заходів з мінімізації ризиків, що вважаються неефективними.
| Проблема безпеки | Захід з мінімізації ризику |
V.2.1. Аналіз неефективних заходів з мінімізації ризиків
Якщо заходи з мінімізації ризику проблеми безпеки вважаються неадекватними, слід провести аналіз основних причин їх неефективності.
| Проблема безпеки | |
| Заходи з мінімізації ризику | |
| Компонент 1 (аналіз) | |
| Компонент 2 (аналіз) | |
| … | |
| Висновки | |
V.2.2. Переглянута позиція для мінімізації ризиків
Надається інформація про нові запропоновані (або переглянуті) заходи з мінімізації ризиків проблем безпеки. Такі дані ґрунтуються на аналізі недостатності/неефективності заходів з мінімізації ризиків.
| Проблема безпеки | |
| Мета заходів з мінімізації ризику | |
| Рутинні заходи з мінімізації ризику | Синопсис (пропонованого) тексту з інструкції для медичного застосування/короткої характеристики на лікарський засіб |
| Коментар (наприклад, щодо будь-яких відмінностей в інструкції для медичного застосування/короткій характеристиці на лікарський засіб) | |
| Інші рутинні заходи з мінімізації ризику | |
| Додаткові заходи з мінімізації ризику (повторити, якщо необхідно) | Мета й обґрунтування, чому потрібні |
| Пропоновані заходи/причини й обґрунтування | |
| Коментар про те, як переглянуті позиції впливатимуть на виявлені недоліки | |
| Ефективність заходів з мінімізації ризиків | |
| Як визначатиметься ефективність заходів з мінімізації ризиків для проблеми безпеки | Якщо планується дослідження, воно також має бути включене до частини III.2 «Додаткова діяльність з фармаконагляду для оцінки ефективності заходів з мінімізації ризику» цього додатка |
| Критерії оцінки успішності пропонованих заходів з мінімізації ризику | |
V.3. ЗВЕДЕНА ТАБЛИЦЯ ЗАХОДІВ З МІНІМІЗАЦІЇ РИЗИКІВ
| Проблема безпеки | Рутинні заходи з мінімізації ризику | Додаткові заходи з мінімізації ризику |
| Синопсис (пропонованого) формулювання з інструкції для медичного застосування/короткої характеристики на лікарський засіб та інші рутинні заходи з мінімізації ризику | Надається перелік з V.1 | |
| (наприклад, зазначення про зниження дози в розділі «Спосіб застосування та дози»; зазначення застереження в розділі «Особливості застосування»; доповнення інформації до розділу «Побічні реакції». Інші рутинні заходи (наприклад, лікарський засіб застосовується лише за рецептом;лікарський засіб можуть призначати тільки лікарі, які мають досвід лікування, тощо) |
ЧАСТИНА VI. РЕЗЮМЕ ПЛАНУ УПРАВЛІННЯ РИЗИКАМИ
Частина VI плану управління ризиками складається окремо для кожного лікарського засобу, що включений до плану управління ризиками.
VI.1. ЕЛЕМЕНТИ ДЛЯ ЗВЕДЕНОЇ ТАБЛИЦІ
VI.1.1. Зведена таблиця проблем безпеки
Переноситься інформація з модуля СVIII частини ІІ.
| Основні проблеми безпеки | |
| Важливі ідентифіковані ризики | (перелік) |
| Важливі потенційні ризики | (перелік) |
| Відсутня інформація | (перелік) |
VI.1.2. Поточні і заплановані дослідження в післяреєстраційному періоді плану з фармаконагляду
Переноситься інформація з частини ІІІ.5.1.
| Дослідження/захід, вид, назва та категорія (1–3) | Мета | Досліджувана проблема безпеки | Статус (заплановано, розпочато) | Дата надання проміжних або заключного звітів (запланована або фактична) |
| (наприклад, реєстр онкологічних пацієнтів CRUCIAL Медичного коледжу Айдахо (неінтервенційне когортне, 3)) | (наприклад, дослідження тривалості виживання, часу до прогресування, профілю безпеки та якості життя пацієнтів із захворюваннями печінки або метастазами солідної пухлини) | (наприклад, брадикардія, тромбоз, лейкопенія, використання у пацієнтів з порушеннями функції нирок) | (наприклад, протокол, наданий PRAC) | (наприклад, проміжні звіти плануються у червні 2018, 2019, заключний — грудні 2020) |
VI.1.3. Зведена таблиця планів проведення досліджень ефективності в післяреєстраційному періоді
Переноситься інформація з таблиці ІV.3 частини IV.
| Дослідження (тип і номер) | Мета | Досліджувані питання ефективності | Статус (заплановане, розпочате) | Дата подання проміжних та заключного звітів |
VI.1.4. Зведена таблиця заходів з мінімізації ризиків
Переноситься інформація з таблиці V.3 частини V.
| Проблема безпеки | Рутинні заходи з мінімізації ризику | Додаткові заходи з мінімізації ризику |
VI.2. ЕЛЕМЕНТИ РЕЗЮМЕ ДЛЯ ГРОМАДСЬКОСТІ
VI.2.1. Огляд епідеміології захворювання
Максимум 150 слів для кожного показання.
Скорочена версія модуля СI частини ІI плану управління ризиками, викладена непрофесійною/доступною для цільової популяції мовою.
VI.2.2. Резюме результатів лікування
Резюме щодо користі лікування лікарським засобом має бути викладено непрофесійною/доступною мовою, не перевищувати 200 слів (до 300, якщо лікарський засіб має кілька показань) та не повинно рекламувати лікарський засіб. При складанні резюме слід враховувати таке:
стислий опис кожного ключового дослідження із зазначенням загальної кількості учасників (рандомізації, де це застосовано) (зрозумілою мовою пояснюється, що таке первинна кінцева точка);
якщо є декілька показань, використовується маркований перелік для розділення досліджень за показаннями. Декілька аналогічних досліджень для одного показання в деяких випадках можуть бути описані разом;
щодо кожного дослідження описуються результати первинної кінцевої точки безпосередньо після опису дослідження (або в тому самому абзаці, або в окремому абзаці, якщо необхідно). При зазначенні даних у відсотках в дужках вказується абсолютна кількість (наприклад, середня тривалість життя пацієнтів в основному дослідженні, які застосовували лікарський засіб Х в дозі 475 мг разом з препаратами Y і Z, збільшувалася від 19,5 місяців до 55,5 місяців порівняно з лікуванням 2 місяці (36 місяців) і 17 місяців (57,5 місяця) та з лікуванням 3 місяці (40,5 місяця)).
VI.2.3. Невідомі дані щодо ефективності лікування
Один стислий абзац для кожного показання (максимум 50 слів).
Стисле резюме щодо ефективності для всіх пацієнтів в цільовій популяції та версія частин IV, IV.1 плану управління ризиками мають бути викладені непрофесійною/доступною мовою. Стисло описуються всі частини популяції цільової популяції, досвід застосування лікарського засобу в яких обмежений, та очікувані відмінності ефективності у цієї популяції за такими, наприклад, факторами, як вік, стать, раса, і порушення з боку організму. Якщо існують докази того, що ефективність або посилюється, або зменшується (наприклад, інгібітори АПФ у афро-карибської популяції), про це необхідно вказати (наприклад, в головних і допоміжних дослідженнях брали участь в основному пацієнти європеоїдної раси віком від 52 до 86 років (більшість пацієнтів віком старше 65 років). Не існує доказів того, що результати відрізнятимуться у пацієнтів іншої расової приналежності тощо).
VI.2.4. Резюме проблем безпеки
ВАЖЛИВІ ІДЕНТИФІКОВАНІ РИЗИКИ
| Ризик | Що відомо | Запобіжні заходи |
| Питання безпеки доступною мовою (медичний термін) | Стисле резюме доступною мовою | Способи мінімізації або пом’якшення ризику (якщо можливо) |
| (наприклад, порушення чутливості в руках і ногах (периферична нейропатія)) | (наприклад, приблизно кожна друга особа, яка приймала препарат Х, відчуватиме деяку ступінь порушення чутливості. Кількість таких осіб після 12 місяців лікування може зрости до трьох з кожних чотирьох. Порушення чутливості варіюється від м’якого поколювання і зміненого відчуття до незворотних ушкоджень у найважчих проявах. Ранні симптоми зазвичай зникають або стан поліпшується після корекції дози або припинення терапії) | (наприклад, за допомогою моніторингу ранніх симптомів) |
| (наприклад, утворення згустків крові (тромбоемболічні явища)) | (наприклад, лікарський засіб може впливати на артерії або вени. Це може призвести до хворобливих набряків ніг (тромбоз глибоких вен) і дуже рідко до виникнення тромбів у легенях, що загрожують життю або призводять до смерті. Згустки в артеріях можуть призвести до серцевого нападу або інсульту, особливо у пацієнтів, які вже мають проблеми з артеріями. Пацієнти із злоякісними новоутвореннями, які приймають естрогени, вже піддаються більш високому ризику утворення тромбів, тому важко оцінити, який додатковий ризик обумовлений препаратом Х) | (наприклад, профілактичне застосування антитромботичних препаратів) |
ВАЖЛИВІ ПОТЕНЦІЙНІ РИЗИКИ
| Ризик | Що відомо (у тому числі обґрунтування, чому вважається потенційним ризиком) |
| (наприклад, вторинні новоутворення) | (наприклад, пацієнти, які приймають препарат X, можуть мати підвищений ризик розвитку нових видів онкологічних захворювань. Існує теоретична ймовірність, що у більшості пацієнтів, які приймали препарат X, розвинулися нові види онкологічних захворювань порівняно з пацієнтами, які не приймали його) |
ВІДСУТНЯ ІНФОРМАЦІЯ
| Ризик | Що відомо |
| (наприклад, обмежена інформація про застосування у хворих з нирковою недостатністю) | (наприклад, препарат Х не виводиться у значній мірі через нирки, тому малоймовірно, що ниркова недостатність призведе до проблем. Деякі з його метаболітів виділяються через нирки, тому рекомендується ретельно контролювати стан пацієнтів з тяжкою нирковою недостатністю) |
VI.2.5. Резюме заходів з мінімізації ризиків для кожної проблеми безпеки
Для всіх лікарських засобів є інструкції для їх медичного застосування, що містять інформацію про застосування лікарського засобу, про ризики та рекомендації щодо їх мінімізації. Запобіжні заходи, що містяться в цьому документі, відомі як рутинні заходи з мінімізації ризиків.
Цей препарат не має додаткових заходів з мінімізації ризиків.
Цей препарат має спеціальні умови та обмеження для його безпечного та ефективного використання (додаткові заходи з мінімізації ризику).
Додаткові заходи з мінімізації ризиків наведені нижче.
ПРОБЛЕМА БЕЗПЕКИ НЕПРОФЕСІЙНОЮ/ДОСТУПНОЮ МОВОЮ (МЕДИЧНИЙ ТЕРМІН)
| Заходи з мінімізації ризику |
| Мета й обґрунтування |
| Стислий опис основних додаткових заходів з мінімізації ризиківКлючові моменти |
| Наприклад, порушення чутливості в руках і ногах (периферична нейропатія).Навчання фахівців охорони здоров’я та пацієнтів.Мета й обґрунтування.Пацієнти та фахівці охорони здоров’я повинні розуміти ризик периферичної нейропатії та знати процедури, пов’язані з належним управлінням цим ризиком, для того, щоб мінімізувати його виникнення і тяжкість.Пропоновані заходи:надання для лікарів і фармацевтів навчальних матеріалів, що містять рекомендації щодо:використання електроміограми до і під час лікування;важливості дотримання рекомендацій щодо дозування;заходів для усунення нейропатії, у тому числі зниження дози і припинення лікування;пряме інформування спеціалістів системи охорони здоров’я до розміщення препарату на ринок (інформаційний лист);буклет для пацієнтів з інформацією про симптоми пошкодження нервів і важливість інформування лікаря при появі симптомів |
VI.2.6. План післяреєстраційного розвитку (заплановані заходи у післяреєстраційному періоді)
Наводиться інформація зі зведених таблиць частин III і IV.
ПЕРЕЛІК ДОСЛІДЖЕНЬ В ПЛАНІ ПІСЛЯРЕЄСТРАЦІЙНОГО РОЗВИТКУ
| Дослідження/захід (включаючи номер дослідження) | Мета | Досліджувана проблема безпеки/ефективності | Статус | Дата надання проміжних і заключного звітів |
ДОСЛІДЖЕННЯ, ЩО Є УМОВОЮ ОТРИМАННЯ РЕЄСТРАЦІЙНОГО ПОСВІДЧЕННЯ
Жодне з вищезазначених досліджень не є умовою отримання реєстраційного посвідчення.
Дослідження (одне або декілька) є умовою отримання реєстраційного посвідчення.
Надається перелік всіх досліджень (включаючи спеціальні зобов’язання), що є умовою отримання реєстраційного посвідчення.
VI.2.7. Зведена таблиця змін до плану управління ризиками
Основні зміни в плані управління ризиками протягом часу.
| Версія | Дата | Проблема безпеки | Коментар |
| На момент реєстрації дд/мм/рррр | Ідентифіковані ризики.Потенційні ризики.Відсутня інформація | ||
| (наприклад, 7.0) | (наприклад, 17/08/2012) | (наприклад, алергічні прояви додані як ідентифікований ризик;підвищена чутливість видалена як ідентифікований ризик;важка інфекція додана як ідентифікований ризик;судоми додані як потенційний ризик) | (наприклад, попередній термін «гіперчутливість» був доповнений алергічними проявами, включаючи набряк Квінке та кропив’янку) |
ЧАСТИНА VII. ДОДАТКИ
Додаток 1. Основна інформація плану управління ризиками в структурованому електронному форматі (якщо застосовано).
Додаток 2. Затверджені (діючі) або пропоновані (якщо лікарський(і) засіб(оби) не зареєстровано) коротка характеристика на лікарський засіб, інструкція для медичного застосування, листок-вкладка.
Додаток 3. Інформація про реєстрацію у світі лікарського(их) засобу(ів), на який (які) розповсюджується план управління ризиками.
3.1. Інформація про реєстрацію в Україні.
3.2. Інформація про реєстрацію в ЄС.
3.3. Інформація про реєстрацію в інших країнах.
Додаток 4. Стислий огляд (синопсис) протоколу клінічного випробування, що триває, або завершеного клінічного випробування.
Додаток 5. Стислий огляд (синопсис) протоколу фармакоепідеміологічного дослідження, що триває, або завершеного фармакоепідеміологічного дослідження.
Додаток 6. Протоколи досліджень, що тривають, та пропонованих досліджень, що зазначені в категоріях 1–3 розділу «Зведена таблиця додаткових заходів з фармаконагляду» частини ІІІ плану управління ризиками.
Додаток 7. Спеціальні форми для подальшого збору (follow up) інформації про побічні реакції.
Додаток 8. Протоколи досліджень, що тривають, та пропонованих досліджень, що зазначені в частині IV плану управління ризиками.
Додаток 9. Стислий огляд (синопсис) звітів про дослідження, що зазначені в частинах III, IV плану управління ризиками.
Додаток 10. Деталізована інформація щодо додаткових заходів з мінімізації ризиків (якщо такі були).
Додаток 11. Приклади макетів матеріалів для спеціалістів з охорони здоров’я та пацієнтів.
Додаток 12. Інші супровідні/допоміжні дані.
Додаток 1. Основна інформація плану управління ризиками в структурованому електронному форматі (якщо застосовано)
Доступно тільки в електронному вигляді.
Додаток 2. Затверджені (діючі) або пропоновані (якщо лікарський(і) засіб(оби) не зареєстровано) коротка характеристика на лікарський засіб, інструкція для медичного застосування, листок-вкладка
Поточні діючі (або запропоновані, якщо лікарський засіб не зареєстрований) інструкції для медичного застосування/короткі характеристики на лікарський засіб і листки-вкладки для кожного лікарського засобу, охопленого планом управління ризиками.
Якщо включено кілька версій перелічених вище документів, необхідно вказати, в яких країнах вони застосовуються. Крім того, потрібно додати базову інструкцію для медичного застосування/коротку характеристику на лікарський засіб, якщо така є, з оглядом змін до неї в кожній країні, де зареєстровано лікарський засіб (подано заяву на реєстрацію).
Додаток 3. Інформація про реєстрацію у світі лікарського(их) засобу(ів), на які розповсюджується даний план управління ризиками
Для кожного лікарського засобу, включеного до плану управління ризиками.
3.1. Інформація про реєстрацію в Україні.
| Країна | Поточний реєстраційний статус | Дата початку дії реєстрації* | Дата першого розміщення на ринку країни | Торговельна назва | Коментарі |
| Обирається один з таких:зареєстровано;відмова у реєстрації;на розгляді;призупинено дію реєстраційного посвідчення;закінчився строк дії реєстраційного посвідчення;вилучено з ринку | |||||
3.2. Інформація про реєстрацію в ЄС.
| Країна | Поточний реєстраційний статус | Дата початку дії реєстрації* | Дата першого розміщення на ринку країни | Торговельна назва | Коментарі |
| Обирається один з таких: зареєстровано;відмова у реєстрації;на розгляді;призупинено дію реєстраційного посвідчення;закінчився строк дії реєстраційного посвідчення;вилучено з ринку | |||||
3.3. Інформація про реєстрацію в інших країнах.
| Країна | Поточний реєстраційний статус | Дата початку дії реєстрації* | Дата першого розміщення на ринку країни | Торговельна назва | Коментарі |
| Обирається одинз таких:зареєстровано;відмова у реєстрації;на розгляді;призупинено дію реєстраційного посвідчення;закінчився строк дії реєстраційного посвідчення;вилучено з ринку | |||||
Додаток 4. Стислий огляд (синопсис) протоколу клінічного випробування, що триває, або завершеного клінічного випробування
| Дослідження | Опис (фаза, стислий опис досліджень, 1–2 пропозиції, включаючи назви схожих лікарських засобів/плацебо | Країни | Дизайн (вид) дослідження | Запланована/фактична кількість пацієнтів | Тривалість спостереження (follow up) | Запланована/фактична дата завершення |
| Основні або базові дослідження | ||||||
| (наприклад, дослідження ABC) | (наприклад, вивчити застосування ібупрофену для зняття помірного післяопераційного болю у дорослих пацієнтів.Фаза III) | (наприклад,Німеччина, США, Чилі) | (наприклад,рандомізованеподвійне сліпе) | (наприклад, 4075) | (наприклад, 14 днів) | (наприклад, січень 2018) |
| Подальші дослідження безпеки / ефективності | ||||||
| Дослідження спеціальних популяцій (наприклад, діти, літні пацієнти) | ||||||
Додаток 5. Стислий огляд (синопсис) протоколу фармакоепідеміологічного дослідження, що триває, або завершеного фармакоепідеміологічного дослідження
| Дослідження | Питання, що вивчається | Дизайн (вид) до-слідження | Популяція і масштаб дослід-ження | Тривалість спостере-ження(follow up) | Етапи та дати | Статус |
| Обирається один із таких:заплановано;протокол в стадії розробки;протокол затверджено;почався збір даних;завершився збір даних;дослідження завершено | ||||||
Додаток 6. Протоколи досліджень, що тривають, та пропонованих досліджень, що зазначені в категоріях 1–3 розділу «Зведена таблиця додаткових заходів з фармаконагляду» частини ІІІ плану управління ризиками
Огляд включених протоколів.
| Назва дослідження | Статус протоколу* | Версія протоколу | Дата версії протоколу |
| Обирається один з таких:проект; затверджено;остаточна версія |
Додаток 7. Спеціальні форми для подальшого збору (follow up) інформації про побічні реакції
Додаються форми.
Додаток 8. Протоколи досліджень, що тривають, та пропонованих досліджень, що зазначені в частині IV плану управління ризиками
| Назва дослідження | Статус протоколу* | Версія протоколу | Дата версії протоколу |
| Обирається один з таких:проект; затверджено;остаточна версія |
Затверджено — затверджений регуляторним органом.
Остаточна версія — згода регуляторного органу не вимагається.
Додаток 9. Стислий огляд (синопсис) звітів про дослідження, що зазначені в частинах III, IV плану управління ризиками
Включається стислий опис дослідження. Для неінтервенційних досліджень використовується формат для післяреєстраційних досліджень з безпеки.
Додаток 10. Деталізована інформація щодо додаткових заходів з мінімізації ризиків (якщо такі були)
Додаток 11. Приклади макетів матеріалів для спеціалістів з охорони здоров’я та пацієнтів
Додаються приклади макетів матеріалів для медичних працівників та пацієнтів.
Додаток 12. Інші супровідні/допоміжні дані
Індексування включених матеріалів.
Додаток 15
до Порядку здійснення фармаконагляду
(підпункт 6 пункту 8 глави 5 розділу VІ)
СТРУКТУРА
протоколу, заключного звіту та резюме післяреєстраційного дослідження з безпеки
I. Структура протоколу
1. Назва (інформативна назва, що містить загальновживаний термін дизайну дослідження, досліджуваний лікарський засіб, вакцину, туберкулін (далі — лікарський засіб), діючу речовину або АТХ-код; підзаголовок з ідентифікатором версії та датою останньої версії).
2. Найменування власника реєстраційного посвідчення/заявника.
3. Інформація про місце проведення дослідження.
4. Резюме протоколу дослідження, що містить:
1) заголовок з підзаголовками, включаючи версію та дату протоколу, а також прізвище та найменування підприємства, установи, організації особи, яка розробила протокол;
2) обґрунтування та історію питання;
3) предмет дослідження та цілі;
4) дизайн дослідження;
5) досліджувану популяцію;
6) змінні дані;
7) джерела даних;
8) масштаб дослідження;
9) аналіз даних;
10) основні етапи.
5. Зміни та оновлення (будь-яка значна зміна та оновлення до протоколу дослідження після початку збору даних, включаючи обґрунтування кожної зміни або оновлення, дату кожної зміни та посилання на розділ протоколу, до якого було внесено зміну).
6. Основні етапи — таблиця із запланованими датами для таких основних етапів:
1) початок збору даних;
2) завершення збору даних;
3) звіт(и) про хід дослідження;
4) проміжний(і) звіт(и) за результатами дослідження (якщо застосовано);
5) заключний звіт за результатами дослідження.
7. Обґрунтування та історія питання (стислий опис загроз(и) безпеці, профілю безпеки або заходів з управління ризиками, які зумовили вимогу дослідження як зобов’язання).
8. Предмет та цілі дослідження відповідно до рішень компетентного органу, що призначив дослідження як зобов’язання.
9. Методи дослідження — опис методів дослідження, включаючи:
1) дизайн дослідження;
2) параметри дослідження (досліджувана популяція щодо осіб, місця, періоду часу та критеріїв відбору, включаючи обґрунтування будь-яких критеріїв включення до вибірки та виключення з неї та їх впливу на кількість осіб, доступних для аналізу. Якщо проводиться відбір з визначеної популяції, має бути наданий опис визначеної популяції та детальний опис методики формування вибірки. Якщо дизайн дослідження є систематичним оглядом або мета-аналізом, мають бути надані пояснення критеріїв вибору та правомірності досліджень);
3) змінні дані;
4) джерела даних (стратегії та джерела даних для визначення експозиції, результатів та всіх інших змінних даних, пов’язаних з цілями дослідження. Якщо дослідження використовуватиме існуюче джерело даних, таке як медична документація, має бути зазначено будь-яку інформацію щодо валідності записів та кодування даних. У випадку систематичного огляду або мета-аналізу описується стратегія та процедури пошуку, а також будь-які методи для підтвердження даних, отриманих від дослідників);
5) масштаб дослідження (будь-який запланований масштаб дослідження, точність оцінок дослідження та будь-який підрахунок розміру вибірки, який, як мінімум, здатен виявити попередньо визначений ризик з попередньо заданою статистичною точністю);
6) управління даними;
7) аналіз даних;
8) контроль якості;
9) обмеження методів дослідження.
10. Захист досліджуваних (заходи з безпеки з метою дотримання національних вимог щодо гарантування захисту прав учасників неінтервенційних післяреєстраційних досліджень безпеки).
11. Обробка та звітування про побічні явища/побічні реакції та інші медично важливі явища під час проведення дослідження.
12. Плани щодо розповсюдження та комунікації результатів дослідження.
13. Посилання.
II. Структура резюме заключного звіту
Заголовок та підзаголовки, включаючи дату резюме та прізвище, ім’я, по батькові і місце роботи особи, яка підготувала звіт.
Ключові слова (не більше п’яти ключових слів, що дають основну характеристику дослідження).
Обґрунтування та історія питання.
Предмет дослідження та цілі.
Дизайн дослідження.
Параметри дослідження.
Суб’єкти та масштаб дослідження, включаючи учасників, які вибули.
Змінні дані та джерела даних.
Результати.
Висновки (включаючи, якщо можливо, оцінку впливу результатів дослідження на співвідношення ризик-користь препарату).
Власник реєстраційного посвідчення.
Прізвища та місця роботи основних дослідників.
III. Структура заключного звіту
1. Назва (назва, що містить загальновживаний термін дизайну дослідження; підзаголовки з датою заключного звіту, прізвищем, ім’ям, по батькові та місцем роботи особи, яка підготувала звіт).
2. Резюме (окреме стисле резюме у форматі, структура якого наведена у розділі II цього додатка).
3. Найменування власника реєстраційного посвідчення/заявника, адреса.
4. Дослідники (прізвище, ім’я, по батькові, посади, вчені звання, наукова ступінь, місця роботи усіх основних дослідників і співдослідників, перелік усіх партнерських установ та відповідних дослідницьких баз).
5. Основні етапи — заплановані та фактичні дати для таких основних етапів:
1) початок збору даних (запланована і фактична дати);
2) завершення збору даних (запланована і фактична дати);
3) звіт(и) про хід дослідження;
4) проміжний(і) звіт(и) результатів дослідження (якщо необхідно);
5) заключний звіт про результати дослідження;
6) будь-які інші важливі етапи, що стосуються дослідження, включаючи дату реєстрації протоколу в переліку досліджень.
6. Обґрунтування та історія питання (опис проблем безпеки, що призвели до ініціювання дослідження, та критичний аналіз важливих опублікованих та неопублікованих відповідних даних і відсутньої інформації, яку дослідження призначене виявити).
7. Предмет дослідження та цілі (предмет та цілі дослідження, включаючи будь-які попередньо висунуті гіпотези, як зазначено у протоколі дослідження).
8. Зміни та оновлення до протоколу (перелік будь-яких значних змін та оновлень до початкового протоколу дослідження після початку збору даних, включаючи обґрунтування кожної зміни або оновлення).
9. Методи дослідження:
1) дизайн дослідження (основні елементи дизайну дослідження та обґрунтування його вибору);
2) параметри дослідження (місце проведення та відповідні дати дослідження, включаючи періоди набору пацієнтів, спостереження та збору даних. У разі якщо за дизайном дослідження є систематичним оглядом або мета-аналізом, характеристики дослідження використовуються як критерії відбору з обґрунтуванням);
3) суб’єкти дослідження (будь-яка первинна популяція та критерії відбору суб’єктів для дослідження. Необхідно навести джерела та методи відбору учасників, включаючи, якщо необхідно, методи підтвердження випадку, а також кількість та причини учасників дослідження, які вибули);
4) змінні дані (усі результати, експозиції, прогностичні параметри, потенційні систематичні помилки та модифікатори ефекту, включаючи робочі визначення та діагностичні критерії, якщо вони застосовуються);
5) джерела даних та вимірювання (щодо кожної суттєвої змінної джерела даних та детальний опис методів оцінки та вимірювання. Якщо дослідження використовує існуюче джерело даних, таке як медична документація, повідомляється будь-яка інформація щодо достовірності записів та кодування даних. У випадку систематичного огляду або мета-аналізу потрібно надати опис усіх інформаційних джерел, стратегії пошуку, методів відбору досліджень, методів добування даних та будь-яких процесів для отримання або підтвердження даних від дослідників);
6) систематичні помилки;
7) масштаб дослідження (масштаб дослідження, обґрунтування будь-якого підрахунку розміру вибірки та будь-якого методу досягнення запланованого розміру дослідження);
8) перетворення даних (перетворення, підрахунок або оперування даними, включаючи те, яким чином оброблялись кількісні дані при аналізі, яке групування було вибрано та чому);
9) статистичні методи — опис:
основних підсумкових показників;
статистичних методів, що застосовувалися;
будь-яких методів, що використовувалися для вивчення популяцій та взаємодій;
яким чином вирішувалась проблема відсутніх даних;
будь-яких аналізів чутливості;
будь-яких змін до плану аналізу даних, включеного до протоколу дослідження, з обґрунтуванням змін.
10) контроль якості (механізми гарантії якості та цілісності даних).
10. Результати:
1) учасники (кількість учасників на кожному етапі дослідження; у випадку систематичного огляду або мета-аналізу — кількість відібраних досліджень, оцінених на придатність та включених у дослідження, із зазначенням причин виключення на кожному етапі);
2) описові дані (характеристика учасників дослідження, інформація щодо експозиції, потенційних систематичних помилок та кількості учасників з відсутніми даними. У випадку систематичного огляду або мета-аналізу — характеристика кожного дослідження, з якого було взято дані);
3) дані про результати (кількість учасників за категоріями основних результатів);
4) основні результати (нескореговані і (якщо необхідно) скореговані показники та їх точність. Якщо доцільно, розрахункові показники відносного ризику потрібно трансформувати в абсолютний ризик за значний період часу);
5) інші розрахунки;
6) побічні явища та побічні реакції.
11. Висновки:
1) основні результати (основні результати з посиланням на цілі дослідження, попереднє дослідження на підтримку та на противагу результатам завершеного післяреєстраційного дослідження безпеки та (у відповідних випадках) вплив результатів на співвідношення ризик-користь лікарського засобу);
2) обмеження (обмеження дослідження, враховуючи обставини, які могли вплинути на якість або цілісність даних, обмеження підходу і методів дослідження, джерела потенційних систематичних помилок і неточностей та оцінка явищ. Описуються тенденція та масштаб потенційних систематичних помилок);
3) інтерпретація (інтерпретація результатів з урахуванням цілей, обмежень, складності аналізу, результатів подібних досліджень та інших відповідних доказів);
4) узагальнення.
12. Посилання.
ЗАТВЕРДЖЕНО
Наказ Міністерства охорони
здоров’я України
26.09.2016 № 996
Зареєстровано в Міністерстві
юстиції України
19 грудня 2016 р.
за № 1650/29780
ПОЛОЖЕННЯ
про центральну і регіональні групи оперативного реагування на несприятливі події після імунізації/туберкулінодіагностики
1. Це Положення визначає діяльність центральної і регіональних груп оперативного реагування на несприятливі події після імунізації/туберкулінодіагностики (далі — група оперативного реагування на НППІ).
2. До складу груп оперативного реагування на НППІ входять фахівці за спеціальностями «неврологія» («дитяча неврологія»), «інфекційні хвороби» («дитячі інфекційні хвороби»), «алергологія» («дитяча алергологія»), «імунологія» («дитяча імунологія»), «анестезіологія» («дитяча анестезіологія»), «епідеміологія», «педіатрія»/«терапія» (залежно від спеціальності голови), «судово-медична експертиза», «патологічна анатомія».
3. Групу оперативного реагування на НППІ очолює голова, який має спеціальність «педіатрія» або «терапія».
4. Голова групи оперативного реагування на НППІ:
1) визначає заступника голови групи оперативного реагування на НППІ та секретаря;
2) відповідає за підготовку документів до засідання групи оперативного реагування на НППІ та дотримання строків їх розгляду.
5. У разі відсутності голови групи оперативного реагування на НППІ роботу організовує заступник голови.
6. Рішення групи оперативного реагування на НППІ ухвалюється простою більшістю голосів членів групи оперативного реагування на НППІ за умови присутності на засіданні двох третин її складу. У разі рівності голосів голос голови групи оперативного реагування на НППІ є вирішальним.
7. Завдання групи оперативного реагування на НППІ:
1) аналіз карт-повідомлень про несприятливу подію після імунізації/туберкулінодіагностики (далі — карта-повідомлення) за формою, наведеною у додатку 6 до Порядку здійснення фармаконагляду, затвердженого наказом Міністерства охорони здоров’я України від 26 вересня 2016 року № 996 (далі — Порядок);
2) встановлення причинно-наслідкового зв’язку між НППІ та застосуванням вакцини, туберкуліну.
8. Група оперативного реагування на НППІ у своїй діяльності керується Конституцією України, законами України, актами Президента України, Верховної Ради України, Кабінету Міністрів України, нормативно-правовими актами МОЗ України і цим Положенням.
9. Групи оперативного реагування на НППІ розподіляються на центральну та регіональні.
10. Центральна група оперативного реагування на НППІ є постійно діючим дорадчим органом Міністерства охорони здоров’я України.
11. Голова та склад центральної групи оперативного реагування на НППІ затверджуються наказом Міністерства охорони здоров’я України.
12. Центральна група оперативного реагування на НППІ:
1) проводить аналіз інформації за даними копій (у паперовому та/або електронному вигляді) отриманих від державного підприємства «Державний експертний центр Міністерства охорони здоров’я України» (далі — Центр):
карт-повідомлень про НППІ, що містять інформацію про клінічні прояви побічних реакцій, що не зазначені в інструкції для медичного застосування або переліку клінічних проявів побічних реакцій після застосування вакцин, туберкуліну, за наявності причинно-наслідкового зв’язку між такими НППІ та застосуванням серії/серій вакцини/вакцин, туберкуліну;
карт-повідомлень, що стали підставою для формування сигналів, за наявності причинно-наслідкового зв’язку між такими НППІ та застосуванням серії/серій вакцини/вакцин, туберкуліну;
карт-повідомлень про НППІ, що пов’язані з програмною помилкою імунізації/туберкулінодіагностики при застосуванні вакцини, туберкуліну, за наявності інформації згідно з протоколом розслідування та встановлення причинно-наслідкового зв’язку між серйозними та/або груповими несприятливими подіями після імунізації/туберкулінодіагностики й застосуванням вакцини, туберкуліну (далі — протокол розслідування) за формою, наведеною у додатку до цього Положення, що підтверджує наявність причинно-наслідкового зв’язку між ними та застосуванням вакцини, туберкуліну.
2) надає консультативну допомогу у разі питань, пов’язаних з безпекою та ефективністю застосування вакцин, туберкуліну тощо.
13. Центральна група оперативного реагування на НППІ залучається до дій протягом 48 годин після отримання від Центру інформації, зазначеної у підпункті 1 пункту 12 цього Положення, у разі наявності питань, пов’язаних з безпекою та ефективністю застосування вакцин, туберкуліну тощо.
14. За результатами роботи центральна група оперативного реагування на НППІ надає до Міністерства охорони здоров’я України та/або заявника (за необхідності) рішення у формі протоколу засідання, що має рекомендаційний характер.
15. Рішення центральної групи оперативного реагування на НППІ є обов’язковим для виконання у разі введення в дію наказом Міністерства охорони здоров’я України.
16. Копії протоколів засідання центральної групи оперативного реагування на НППІ надаються до Центру.
17. Регіональні групи оперативного реагування на НППІ є постійно діючими дорадчими органами при структурних підрозділах з питань охорони здоров’я Автономної Республіки Крим, обласних, Київської та Севастопольської міських державних адміністрацій (далі — структурні підрозділи з питань охорони здоров’я).
18. Голова та склад регіональної групи оперативного реагування на НППІ затверджуються наказом відповідного структурного підрозділу з питань охорони здоров’я.
19. Регіональна група оперативного реагування на НППІ:
1) отримує карти-повідомлення про усі випадки НППІ, що сталися в адміністративно-територіальній одиниці;
2) здійснює аналіз карт-повідомлень про усі випадки НППІ, що сталися в адміністративно-територіальній одиниці, на предмет визначення категорії серйозності;
3) направляє усі отримані карти-повідомлення до Центру;
4) проводить розслідування усіх серйозних та групових НППІ та встановлює причинно-наслідковий зв’язок між НППІ та застосуванням вакцини, туберкуліну;
5) за результатами розслідування заповнює протокол розслідування та надає його до Центру разом із копією відповідної карти-повідомлення не пізніше 15 днів з дня реєстрації НППІ.
6) при отриманні додаткових даних щодо серйозної та/або групової НППІ, що потребує переоцінки причинно-наслідкового зв’язку між НППІ та застосуванням вакцини, туберкуліну, складає оновлений протокол розслідування і надає його до Центру не пізніше 15 днів з дня отримання додаткових даних. У разі якщо цей строк припадає на вихідний або святковий день, інформація надається у перший після нього робочий день.
20. Голова регіональної групи оперативного реагування на НППІ надає копії карт-повідомлень головному штатному/позаштатному спеціалісту за спеціальністю «терапія» відповідного структурного підрозділу з питань охорони здоров’я.
| Начальник Управління фармацевтичної діяльності та якості фармацевтичної продукції |
Т.М. Лясковський |
Додаток
до Положення про центральну
і регіональні групи оперативного
реагування на несприятливі події
після імунізації/туберкулінодіагностики
(підпункт 1 пункту 12)
ПРОТОКОЛ
розслідування та встановлення причинно-наслідкового зв’язку між серйозними та/або груповими несприятливими подіями після імунізації/туберкулінодіагностики й застосуванням вакцини, туберкуліну
Розслідування та встановлення причинно-наслідкового зв’язку між серйозними та/або груповими несприятливими подіями після імунізації/туберкулінодіагностики й застосуванням вакцини, туберкуліну складається з 4 етапів.
2 ЕТАП. Збір інформації для встановлення причинно-наслідкового зв’язку між серйозними та/або груповими НППІ й застосуванням вакцини, туберкуліну
| І. Чи є вагомі докази наявності інших причин | ||
| Чи підтверджують результати клінічного або лабораторного обстеження особи, якій застосувалася (застосовувався) вакцина/туберкулін, наявність іншої причини виникнення серйозної та/або групової НППІ | Так*/Ні/Невідомо/Не застосовано | Примітки |
| ІІ. Чи існує відомий причинно-наслідковий зв’язок між розвитком НППІ та застосуванням вакцини/туберкуліну або проведенням імунізації/туберкулінодіагностики | ||
| Реакція, пов’язана з властивостями вакцини, туберкуліну (підкреслити потрібне) | ||
| 1. Чи існують у медичній науковій літературі дані про те, що ця (цей) вакцина/туберкулін може викликати зареєстровану НППІ навіть при застосуванні згідно з інструкцією для медичного застосування | Так*/Ні/Невідомо/Не застосовано | Примітки |
| 2. Чи підтверджують результати спеціального(их) лабораторного(их) дослідження (досліджень) наявність причинно-наслідкового зв’язку між цією НППІ та вакциною(ами)/туберкуліном, що застосовувалась(вся)/застосовувалися | Так*/Ні/Невідомо/Не застосовано | Примітки |
| Реакція, пов’язана з програмною помилкою при імунізації/туберкулінодіагностиці | ||
| 3. Чи була допущена особою, яка проводила імунізацію/туберкулінодіагностику, помилка при застосуванні вакцини/туберкуліну внаслідок недотримання інформації щодо їх використання (наприклад, імунізація та/або туберкулінодіагностика після закінчення терміну придатності вакцини/туберкуліну, недотримання протипоказань тощо)(зазначається, чи застосовувались вакцина, туберкулін відповідно до інструкції для медичного застосування в частині показань, протипоказань, доз, схеми, умов зберігання тощо. Вакцини різних виробників, але одного типу можуть мати різні специфікації для медичного застосування, їх недотримання може призвести до розвитку НППІ) | Так*/Ні/Невідомо/Не застосовано | Примітки |
| 4. Чи були вакцина/туберкулін введені з порушенням умов стерильності(зазначається інформація щодо наявності або відсутності симптомів, характерних для синдрому токсичного шоку (блювота, діарея, ціаноз, підвищення температури), та строків їх появи (протягом декількох годин), а також місцевої чутливості та інфільтрації тканин) | Так*/Ні/Невідомо/Не застосовано | Примітки |
| 5. Чи відповідав нормі фізичний стан вакцини/туберкуліну (колір, помутніння, присутність сторонніх часточок тощо) при її (його) застосуванні(зазначається інформація щодо наявності або відсутності незвичайного кольору (помутніння або присутність сторонніх часточок), що підтверджує порушення вмісту вакцини та може бути причиною НППІ) | Так*/Ні/Невідомо/Не застосовано | Примітки |
| 6. Чи була допущена особою, яка проводила імунізацію/туберкулінодіагностику, помилка при:1) розведенні/приготуванні вакцини (застосовувався інший лікарський засіб або розчинник, порушено процедуру змішування, заповнення шприца, не дотримано рекомендованої дози тощо);2) застосуванні туберкуліну (застосовувався інший лікарський засіб, порушено процедуру заповнення шприца, недотримано рекомендовану дозу тощо) | Так*/Ні/Невідомо/Не застосовано | Примітки |
| 7. Чи була допущена помилка відповідальною особою при транспортуванні/зберіганні вакцини/туберкуліну (недотримано «холодовий ланцюг») | Так*/Ні/Невідомо/Не застосовано | Примітки |
| 8. Чи була допущена помилка особою, яка проводила імунізацію/туберкулінодіагностику, при введенні/застосуванні вакцини/туберкуліну (неправильно вибрано дозу або шлях введення, неправильне місце введення, неправильний розмір голки тощо)(зазначається, чи відповідають вікова доза, місце та шлях введення вимогам інструкції для медичного застосування конкретної вакцини) | Так*/Ні/Невідомо/Не застосовано | Примітки |
| Реакція, пов’язана зі страхом при імунізації/туберкулінодіагностиці | ||
| 9. Чи міг страх перед імунізацією/туберкулінодіагностикою викликати НППІ (вагусна судинна реакція, гіпервентиляційний синдром або розлад, пов’язаний зі стресом, тощо)(зазначається вік дитини (характерна подія для підлітків), місце проведення імунізації (дошкільний дитячий заклад, школа)) | Так*/Ні/Невідомо/Не застосовано | Примітки |
| ІІІ. Строки розвитку НППІ з урахуванням типу вакцини/туберкуліну, що застосовувалась(вся) | ||
| Чи розвинулась НППІ у строки розвитку, характерні для цієї (цього) вакцини/туберкуліну | Так*/Ні/Невідомо/Не застосовано | Примітки |
| ІV. Вагомі докази відсутності причинно-наслідкового зв’язку | ||
| Чи є вагомі докази відсутності причинно-наслідкового зв’язку | Так*/Ні/Невідомо/Не застосовано | Примітки |
| У разі якщо так, надається підтвердження | ||
| V. Інші фактори, що дають змогу провести диференціацію між розвитком НППІ та застосуванням вакцини/туберкуліну | ||
| 1. Чи могла НППІ статися незалежно від щеплення/туберкулінодіагностики (враховується фоновий рівень захворюваності по Автономній Республіці Крим/області/містам Київ, Севастополь, де зареєстрована НППІ)(зазначаються фонові рівні соматичних та інфекційних захворювань для різних вікових груп населення адміністративно-територіальної одиниці, що дає змогу порівняти частоту розвитку НППІ серед щеплених та нещеплених осіб однієї вікової групи, які мешкають в одній адміністративно-територіальній одиниці) | Так*/Ні/Невідомо/Не застосовано | Примітки |
| 2. Чи могла НППІ бути проявом іншої патології | Так*/Ні/Невідомо/Не застосовано | Примітки |
| 3. Чи мала місце подібна НППІ після введення будь-якої попередньої дози аналогічної (аналогічного) вакцини/туберкуліну(зазначається попередній щеплювальний анамнез, який повинен бути детально проаналізований) | Так*/Ні/Невідомо/Не застосовано | Примітки |
| 4. Чи мав місце вплив потенційних факторів ризику або токсинів до виникнення НППІ(зазначається, чи не передувало щепленню хірургічне втручання, проведення хіміотерапії, застосування будь-яких лікарських засобів) | Так*/Ні/Невідомо/Не застосовано | Примітки |
| 5. Чи передувало НППІ захворювання(зазначається, чи не передувало щепленню будь-яке захворювання, можливо розвиток НППІ у післявакцинальному періоді міг стати причиною цього захворювання) | Так*/Ні/Невідомо/Не застосовано | Примітки |
| 6. Чи спостерігався подібний стан в минулому незалежно від шеплення/туберкулінодіагностики(зазначається, чи виникала подібна НППІ у щепленої особи та її родині у минулому незалежно від імунізації) | Так*/Ні/Невідомо/Не застосовано | Примітки |
| 7. Чи приймала особа, якій проведено щеплення/туберкулінодіагностику, будь-який лікарський засіб перед щепленням/туберкулінодіагностикою(зазначається, чи приймала щеплена особа у день вакцинації будь-який лікарський засіб, оскільки НППІ може бути як наслідком застосування лікарського засобу, так і вакцини) | Так*/Ні/Невідомо/Не застосовано | Примітки |
| 8. Чи існує біологічна ймовірність того, що вакцина могла спричинити виникнення НППІ(зазначається, чи є подібними прояви НППІ природньому перебігу інфекції, включаючи результати лабораторних, інструментальних досліджень як додаткові уточнюючі фактори) | Так*/Ні/Невідомо/Не застосовано | Примітки |
3 ЕТАП. Алгоритм визначення причинно-наслідкового зв’язку між серйозними та/або груповими НППІ та застосуванням вакцини, туберкуліну
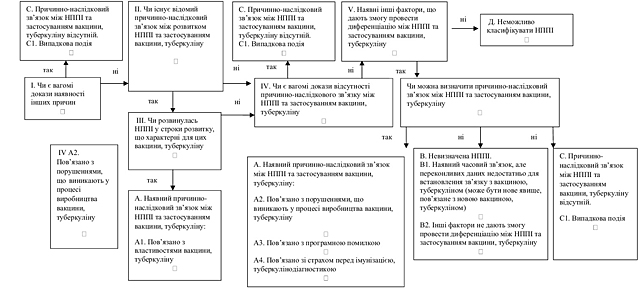
4 ЕТАП. Категорії причинно-наслідкового зв’язку між серйозними та/або груповими НППІ та застосуванням вакцини, туберкуліну згідно з алгоритмом визначення 3 етапу

Стисле обґрунтування визначення категорії причинно-наслідкового зв’язку між серйозними та/або груповими НППІ та застосуванням вакцини, туберкуліну:_____________.
На підставі доступних даних регіональна/центральна група оперативного реагування
(необхідне підкреслити)
дійшла висновку, що категорію причинно-наслідкового зв’язку визначено як
_______________________________________________________________________________,
оскільки ________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Голова групи ________________________ ______________________ _____________
(П.І.Б.) (підпис) (дата)

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим