В п. 15 Протокольного решения по результатам совещания у первого вице-премьер-министра Украины Н.Я. Азарова от 07.09.2006 г. № 32286/0/1-06 совмещены два вида продукции: лекарственные средства и изделия медицинского назначения, которые, на наш взгляд, следует рассматривать отдельно друг от друга.
При производстве изделий медицинского назначения сертифицируют системы управления качеством на соответствие стандартам ДСТУ ISO серии 9000; качество изделий медицинского назначения регламентируется государственными стандартами Украины (ДСТУ) и техническими условиями (ТУ), то есть нормативными документами, которые входят в сферу компетенции национального органа по стандартизации – Держспоживстандарта. Регистрация этих нормативных документов не может быть передана МЗ Украины, поскольку это будет противоречить действующему законодательству нашей страны.
В письме Держспоживстандарта от 26 октября 2006 г. № 9453-5-4/19 резонно указано, что система регистрации изделий медицинского назначения может базироваться на процедуре оценки соответствия, установленной в законах Украины, в частности, в законе «Про підтвердження відповідності».
В настоящее время в рамках МЗ Украины Государственная служба лекарственных средств и изделий медицинского назначения проводит регистрацию изделий медицинского назначения, что является элементом сертификации. Эта система регистрации предполагает доклинические и клинические исследования для всех изделий медицинского назначения, включая те, которые непосредственно не контактируют с организмом пациента (пробки, баллоны аэрозольные, клапаны для ингаляторов, распылители и т.д.). Очевидно, что клинические испытания могут быть предусмотрены в отношении лекарственных препаратов, а не элементов их первичной упаковки, которые относят к изделиям медицинского назначения. То есть, система регистрации изделий медицинского назначения нуждается в доработке и пересмотре. Поэтому мы поддерживаем мнение специалистов Держспоживстандарта о том, что технические регламенты относительно изделий медицинского назначения должны базироваться на положениях соответствующих директив ЕС.
В отношении стандартизации и сертификации лекарственных средств дело обстоит иначе. Аргументы Держспоживстандарта в отношении стандартизации и сертификации лекарственных средств противоречат положениям, принятым в Европейском Союзе (ЕС); эти аргументы базируются также на ошибочном толковании устаревших положений Закона Украины «Про лікарські засоби», которые давно нуждаются в пересмотре.
|
В рамках законодательства ЕС полномочия по подготовке руководств, конкретизирующих практическое действие закона, переданы Европейской Комиссии. Эти руководства, как правило, подготавливают при консультациях с государствами ЕС, Европейским агентством по оценке лекарственных средств (ЕМЕА) и заинтересованными сторонами. Европейская Комиссия может также делегировать разработку проектов таких руководств ЕМЕА, например, научных руководств. В ЕС основными специализированными органами по стандартизации лекарственных средств являются ЕМЕА, Европейский Директорат по качеству лекарственных средств (European Directorate for the Quality of Medicines – EDQM) и Европейская Фармакопея. Эти европейские организации не представляет в Украине Держспоживстандарт и они не являются членами ISO, IEC или ITU.
Лекарственные средства — продукция, от которой непосредственно зависит здоровье, а часто и жизнь человека. Поэтому стандартизация в этой сфере приобретает особое значение. Однако после принятия Закона Украины «Про стандартизацію», начиная с мая 2001 г., фармацевтический сектор оказался без законов и норм, регулирующих систему стандартизации, поскольку в Законе Украины «Про лікарські засоби» нет статей о стандартизации.
 |
|
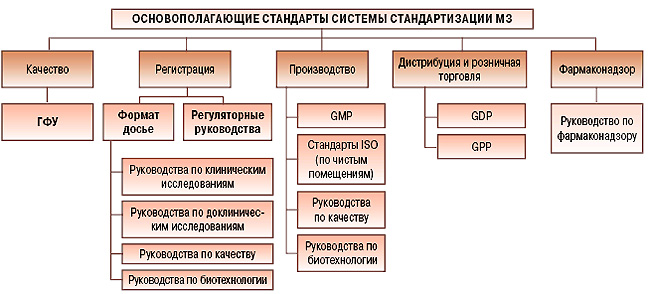
В частности, приказами МЗ Украины была введена в действие Государственная Фармакопея Украины, являющаяся сборником нормативных документов (но не нормативно-правовым актом), в которых устанавливаются современные стандарты качества лекарственных форм, лекарственных средств и их компонентов, а также методы анализа и испытаний. По плану стандартизации МЗ Украины были разработаны и приняты гармонизированные руководства по GMP, GDP и GCP, руководство по биодоступности и биоэквивалентности, 6 гармонизированных руководств по качеству. Приказом МЗ Украины от 26.08.2005 г. № 426, зарегистрированным в Министерстве юстиции Украины, введен Порядок проведения экспертизы на лекарственные средства, которые подаются на государственную регистрацию (перерегистрацию), включающий структуру регистрационного досье, гармонизированную с европейскими и международными нормами, и т.д.
К сожалению, в МЗ Украины отсутствовали собственные стандарты, регламентирующие систему стандартизации фармацевтической продукции, правила разработки нормативных документов, правила и методы принятия и применения международных и региональных стандартов, их оформления и т.д. В этих вопросах приходилось руководствоваться положениями национальной стандартизации, то есть соответствующими национальными стандартами (ДСТУ), принятыми Держспоживстандартом.
Приказом МЗ Украины от 14 сентября 2005 г. № 471 введен в действие первый основополагающий стандарт системы стандартизации фармацевтической продукции СТ МОЗУ 42-1.0:2005 «Фармацевтическая продукция. Система стандартизации. Основные положения». Цель введения этого стандарта – установить в Украине требования к системе стандартизации фармацевтической продукции и правила ее функционирования.
Этот стандарт предусматривает, что МЗ Украины является органом по стандартизации фармацевтической продукции и формирует систему и службу стандартизации. При этом руководством МЗ Украины и руководством Держспоживстандарта были согласованы обозначения и категории нормативных документов, которые должно было регистрировать МЗ Украины: стандарт МОЗ України (СТ МОЗУ), настанова (руководство) МОЗ України (СТ-Н МОЗУ), класифікатор МОЗ України (СТ-К МОЗУ).
К сожалению, до сих пор этот стандарт не опубликован и не работает. По нашему мнению, постановлением Кабинета Министров МЗ Украины должны быть делегированы полномочия органа по стандартизации фармацевтической продукции.
Следующий основополагающий стандарт должен будет установить правила разработки нормативных документов МЗ Украины.
Существуют ошибочные мнения, что система и правила стандартизации являются прерогативой ISO и Держспоживстандарта, а для фармацевтической продукции в ЕС такие правила отсутствуют и, следовательно, не нужны МЗ Украины. Существует неправильная точка зрения, что принятие стандартов и руководств (укр.: настанов), которые не зарегистрированы в Министерстве юстиции и не находятся в законодательном поле, противоречит Конституции Украины (несмотря на правила национальной стандартизации, установленные Держспоживстандартом) и что нет необходимости в Государственной Фармакопее Украины. Высказывалось также мнение, что категория нормативного документа «руководство» (настанова) не имеет права на жизнь в Украине, а вместо него должен быть национальный стандарт, утверждаемый Держспоживстандартом.
Система и правила стандартизации — вопрос государственной важности, имеющий социальное, экономическое и политическое значение. Без системы стандартизации и правил ее функционирования не могут соблюдаться принципы стандартизации, установленные ВТО, в частности, открытость и прозрачность процедур разработки и принятия стандартов с учетом всех мнений заинтересованных сторон, не может быть и речи о постоянном повышении конкурентоспособности отечественных препаратов и адекватных технических барьерах в сфере международной торговли лекарственными средствами, а Украина не может участвовать в международной и региональной стандартизации в области лекарственных средств.
Учитывая важность вопроса создания системы стандартизации фармацевтической продукции в рамках МЗ Украины, нами был осуществлен перевод нормативного документа ЕМЕА «Procedure for European Union Guidelines and Related Documents within the Pharmaceutical Legislative Framework» («Процедура в отношении руководств и сопутствующих документов Европейского Союза в рамках фармацевтического законодательства»), который был принят ЕМЕА 20 июня 2005 г. Этот перевод опубликован выше.
Исходя из документа ЕМЕА, очевидно, что:
- функции органов стандартизации в ЕС принадлежат уполномоченным Комиссией ЕС специализированным организациям, функционирующим в фармацевтическом секторе;
- существуют стройная система и правила разработки и принятия нормативных документов, обеспечивающие соблюдение принципов стандартизации; они не противоречат национальной системе стандартизации, принятой в Украине;
- основной категорией нормативных документов в фармацевтическом секторе ЕС является guideline (рус.: руководство, укр.: настанова);
- руководства могут иметь различные цели и разную правовую основу/статус; они либо находятся в рамках законодательства и предназначены для выполнения положений, установленных фармацевтическим законодательством ЕС, либо рассматриваются как документы для предоставления консультаций или выполнения определенных работ, как гармонизированная позиция Сообщества, в отношении которой допускается альтернативный подход при достаточной аргументации; такие два аспекта правовой основы руководств соответствуют понятиям «стандарт» и «технический регламент», принятым в национальной стандартизации Украины;
- в ЕС существует несколько блоков нормативных документов (руководств), регламентирующих разные виды деятельности и разные элементы системы сертификации лекарственных средств; эти гармонизированные документы должны быть приняты и в Украине;
- система стандартизации в ЕС работает на постоянной основе, позволяющей создавать новые руководства, а также пересматривать и актуализировать ранее принятые нормативные документы.
Нормативный документ ЕМЕА наряду с ДСТУ 1.2:2003 может послужить основой для создания стандарта МЗ Украины, регламентирующего правила разработки нормативных документов.
Работы в области стандартизации и система сертификации неразрывны и являются двумя сторонами одной медали.
В ЕС при производстве лекарственных средств сертификация систем управления качеством на соответствие стандартам ISO серии 9000 находится в законодательно нерегулируемой сфере.
В законодательно регулируемой сфере принята другая система сертификации лекарственных средств, установленная в директивах и постановлениях ЕС. Она является комплексной и включает такие элементы:
- лицензирование лекарственных средств, что во многом соответствует регистрации лекарственных средств в Украине;
- лицензирование производства лекарственных средств на основании инспектирования на соответствие руководству по GMP;
- независимый контроль качества, осуществляемый на предприятии-производителе и в официальных контрольных лабораториях;
- лицензирование дистрибуции лекарственных средств на основании инспектирования на соответствие руководству по GDP;
- фармакологический надзор за лекарственными средствами, находящимися на рынке;
- сертификация субстанций Европейской Фармакопеей.
Для управления системой сертификации лекарственных средств должен быть единый орган по сертификации. Чтобы создавать руководства и технические регламенты для системы сертификации лекарственных средств, необходим специализированный орган по стандартизации, управляющий разработкой нормативных документов, гармонизированных с международными нормами.
В письме Держспоживстандарта Украины от 26 октября 2006 г. № 9453-5-4/19 отмечалось, что «…розробку таких стандартів доцільно доручити компетентним установам МОЗ за участю технічного комітету стандартизації ТК 95 «Системи управління якістю, довкіллям та безпечністю харчових продуктів» у зв’язку з тим, що згадані міжнародні документи базуються на вимогах стандартів серії ISO 9000».
Как следует из представленного нами перевода документа ЕМЕА, Европейские руководства в фармацевтическом секторе не базируются на требованиях стандартов серии ISO 9000. Невозможно вычленить из системы сертификации лекарственных средств отдельные элементы и передавать их в ведение Держспоживстандарта, например, разработку руководства по GMP и сертификацию на соответствие GMP, поскольку элементы системы сертификации взаимопроникают и дополняют друг друга. Так, инспектирование на соответствие GMP осуществляется на этапах регистрации, лицензирования производства и серийного производства. Передать полностью систему стандартизации и сертификации лекарственных средств Держспоживстандарту также невозможно, поскольку компетентным органом центральной исполнительной власти в этих вопросах является МЗ Украины.
Кроме того, инспектирование на соответствие правилам GMP существенно отличается от аудита систем управления качеством на соответствие стандартам ISO серии 9000 и требует специальной подготовки инспекторов, специализированного органа — Инспектората по GMP/GDP, работающего по определенной системе качества и представляющего государство в Системе сотрудничества по фармацевтическим инспекциям (PIC/S).
|
В п. 15 Протокольного решения по результатам совещания у первого вице-премьер-министра Украины Н.Я. Азарова от 07.09.2006 г. № 32286/0/1-06 предполагается создание программы принятия и поэтапного внедрения стандартов GMP, GLP, GCP и GDP в Украине. При создании такой программы следует обратить внимание на то, что, кроме руководств по GMP, GLP, GCP и GDP, которые в ЕС являются обязательными, необходимы еще многочисленные руководства и другие документы, имеющие как обязательный, так и рекомендательный характер (см. выше перевод документа ЕМЕА). Такие гармонизированные нормативные документы должны разрабатываться компетентными специалистами и утверждаться МЗ Украины. Руководства, которые не должны входить в законодательное поле, не могут регистрироваться в Министерстве юстиции Украины.
 |
В Украине уже разработаны руководства по GMP, GCP и GDP; необходимо лишь пересмотреть и актуализировать руководства по GMP, разработанные ГП «ГНЦЛС» и другими профильными организациями и принятые МЗ Украины в 2001–2202 гг., и разработать руководство по GLP, что может быть сделано в 2007 г.
Весь текст руководств по GMP, принятых МЗ Украины, не нуждается в кардинальной переработке или новом переводе; их следует актуализировать и пересмотреть в соответствии с незначительными изменениями, внесенными с 2002 по 2006 гг. в Руководство по GMP EC. Вся эта работа проведена специалистами ГП «ГНЦЛС» и актуализированное руководство по GMP может быть издано в 2007 г.
Разработка и принятие правил GMP относительно производства стерильных лекарственных средств не может происходить отдельно от общих правил GMP и ряда приложений, которые также применяют при производстве стерильных лекарственных средств. Актуализированное руководство по GMP следует вводить как целостный документ; при этом в приказе МЗ Украины, зарегистрированном в Министерстве юстиции, должны быть заранее указаны сроки поэтапного введения этого документа в качестве обязательного для отдельных видов лекарственных форм (например, стерильной продукции). Также заранее должны быть установлены сроки введения руководств по GDP, GCP, GLP в качестве обязательных.
Однако переход на работу по правилам GMP, GLP, GCP и GDP потребует другого огромного объема работ по стандартизации и обучению. Только для того чтобы разрабатывать лекарственные средства и составлять регистрационные досье в современном международном формате необходимы около 200 руководств (в настоящее время в Украине принято всего 8 гармонизированных руководств). Эти руководства следует постоянно актуализировать, для чего на постоянной основе должны работать орган по стандартизации и система стандартизации.
Для работы по правилам GMP при производстве стерильной продукции необходимо разработать, а Держспоживстандарту принять около 30 идентичных стандартов ДСТУ ISO. По международному соглашению вводить идентичные стандарты ДСТУ/ISO в Украине может только Держспоживстандарт, который должен включить их в план стандартизации, назначить разработчиков (например, МЗ Украины), провести экспертизу проектов и ввести в действие в соответствии с правилами Национальной стандартизации. Проекты 5 стандартов ДСТУ/ISO по чистым помещениям были разработаны ГП «ГНЦЛС» и представлены в 2003 г. в Государственную службу лекарственных средств и изделий медицинского назначения, которая до сих пор не вышла с ходатайством в Держспоживстандарт о внесении этих нормативных документов в национальный план стандартизации.
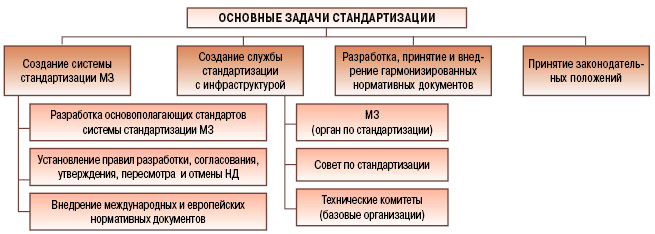
Для поэтапного внедрения надлежащих практик GMP, GLP, GCP, GDP необходимо решить такие задачи:
1. Постановлениями Кабинета Министров МЗ Украины должен официально получить статус органа по стандартизации и сертификации фармацевтической продукции.
2. Должны быть приняты, по крайней мере, два основополагающих стандарта системы стандартизации фармацевтической продукции, регламентирующие:
- систему стандартизации фармацевтической продукции;
- правила принятия нормативных документов.
Кроме того, должна быть организована работа информационной сети.
3. При МЗ Украины должен быть создан Совет по стандартизации, на котором следует обсуждать также и этапы внедрения надлежащих практик. Технические комитеты по стандартизации, базовые организации или рабочие группы рационально создать или уполномочить по таким направлениям:
- регистрация лекарственных средств;
- производство и дистрибуция лекарственных средств;
- биологические лекарственные средства;
- Государственная Фармакопея Украины и руководства по качеству;
- доклинические исследования (фармакология, токсикология, фармакокинетика);
- клинические исследования, включая биодоступность и биоэквивалентность;
- фармакологический надзор;
- розничная реализация лекарственных средств.
4. Подготовка программы по разработке и поэтапному внедрению надлежащих практик GMP, GLP, GCP, GDP должна включать разработку и других нормативных документов, без которых эти практики не могут быть внедрены, в частности:
- регуляторных руководств относительно регистрации лекарственных средств и руководства в отношении препаратов-сирот;
- руководств по качеству, биотехнологии и лекарственным препаратам из растительного сырья, которые при внедрении GMP являются необходимыми нормативными документами;
- руководств по доклиническим испытаниям и руководств OECD, которые при внедрении GLP являются необходимыми нормативными документами;
- руководств по клиническим испытаниям, которые при внедрении GСP являются необходимыми нормативными документами;
- гармонизированного руководства по фармаконадзору, без которого не может быть целостной системы стандартизации и сертификации;
5. Необходимо актуализировать и пересмотреть руководство по GMP на основании руководства по GMP EC и введенных ранее в действие МЗ Украины двух руководств по GMP:
- Настанова 42-01-2001 «Лікарські засоби. Належна виробнича практика»;
- Настанова 42-02-2002 «Лікарські засоби. Належна виробнича практика активних фармацевтичних інгредієнтів».
6. Разработка и принятие правил GMP относительно производства стерильных лекарственных средств должна происходить параллельно с разработкой и принятием Держспоживстандартом стандартов ISO относительно различных аспектов работы в чистых помещениях.
7. Что касается изменений в Лицензионные условия проведения хозяйственной деятельности по производству, дистрибуции и испытаниям лекарственных средств, а также их сроков, то они должны вноситься тогда, когда МЗ Украины обеспечит заявителей, производителей, разработчиков, исследователей, инспекторов и экспертов соответствующей целостной нормативной базой, без которой внедрение надлежащих практик в качестве обязательных невозможно.
8. Пересмотреть и ввести в действие в качестве обязательных соответствующими нормативно-правовыми актами руководства по GDP и GCP, принятые ранее МЗ Украины.
9. Необходимо на постоянной основе планировать актуализацию, пересмотр и издание новых дополнений к Государственной Фармакопее Украины, без которой не может быть внедрено GMP. В ЕС установлена неразрывность требований Европейской Фармакопеи к качеству лекарств и обеспечению их качества при производстве по правилам GMP.
10. Требуются срочные мероприятия по созданию Инспектората по GMP/GDP при МЗ Украины и нормализации работы курсов по обучению GMP/GDP, поскольку в настоящее время все квалифицированные и компетентные специалисты, подготовленные для этих целей в рамках программы TACIC, в МЗ Украины не работают. Без квалифицированной и компетентной инспекторской службы и качественного обучения о внедрении GMP/GDP в Украине не может быть и речи.
11. Для эффективной работы Инспектората по GMP/GDP следует разработать руководство по качеству и методике инспектирования в соответствии с рекомендациями PIC/S, сделать переводы руководств, входящих в сборник, применяемый инспекторатами по GMP, входящими в PIC/S.
12. Продолжить процедуру вступления Инспектората по GMP/GDP в PIC/S.
Таким образом, чтобы вывести фармацевтический сектор Украины на цивилизованный путь развития и интегрировать его в мировой фармацевтический рынок, необходима большая работа, требующая соответствующего управления и организации, финансирования, а также усилий достаточно большого количества специалистов-профессионалов в разных областях знаний и должностных лиц МЗ Украины. Эта государственная задача имеет важное значение для Украины и может быть решена только при всестороннем комплексном подходе.
После принятия соответствующего комплекта нормативных документов станет реальным принятие и нового Закона Украины «Про лікарські засоби», в котором должна быть установлена система сертификации лекарственных средств, гармонизированная с европейскими требованиями. В действующем ныне Законе Украины «Про лікарські засоби» отсутствуют такие понятия, как стандартизация, обеспечение качества, надлежащая производственная практика, надлежащая клиническая практика и т.д. Спецификации и методы контроля качества производителей лекарственных средств называют устаревшим термином «фармакопейная статья», а фармакопею — нормативно-правовым актом, что неправильно характеризует ее статус.
Хочется надеяться, что Кабинет Министров и руководство МЗ Украины примет конструктивные решения, которые будут способствовать дальнейшему развитию фармацевтического сектора Украины. n
В.П. Георгиевский, Н.А. Ляпунов, Е.П. Безуглая, ГП «Государственный научный центр лекарственных средств» (Харьков)

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим