Раніше ми аналізували проект Національного переліку , який було оприлюднено на офіційному сайті МОЗ України для громадського обговорення. Прийнятий 13 грудня документ дещо відрізняється від редакції проекту. Зокрема, змінено дозування і форми випуску препаратів певних міжнародних непатентованих назв (МНН). Щодо кількості нових МНН, які включено до нової редакції Національного переліку, то всі МНН, які було наведено в проекті, увійшли до нової редакції Національного переліку. Єдиним винятком є те, що проектом пропонувалося включити до Національного переліку препарати епоетину альфа, бета та тета, дарбeпоетину альфа, метоксипропіленгліколю-епоетину бета та їх відповідних біосимілярів (Epoetin alfa, beta and theta, Darbepoetin alfa, Methoxy polyethylene glycol-epoetin beta and their respective biosimilars), однак до Національного переліку включено лише епоетин альфа (Epoetin alfa). Також у згаданому вище аналізі представлено порівняння з 20-м виданням Базового переліку ВООЗ.
Порівняння з попередньою редакцією Нацпереліку
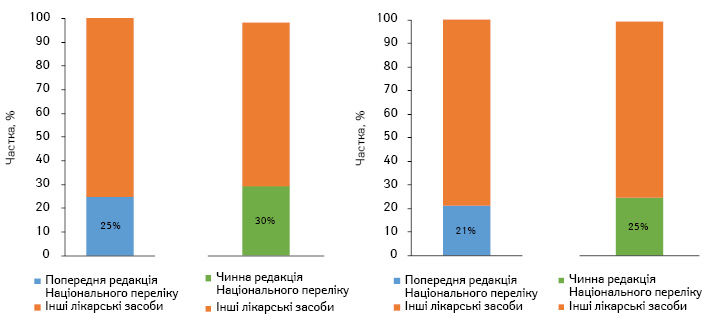
Попередня редакція Національного переліку налічувала 367 МНН лікарських засобів, а частка їх роздрібної реалізації і госпітальних поставок у загальному обсязі ринку лікарських засобів за підсумками 2016 р. становить 25% у натуральному та 21% — у грошовому вираженні. Нова редакція Національного переліку налічує 421 МНН, а їх частка в загальному обсязі ринку лікарських засобів у той же період становить 30% та 25% відповідно (рис. 1).
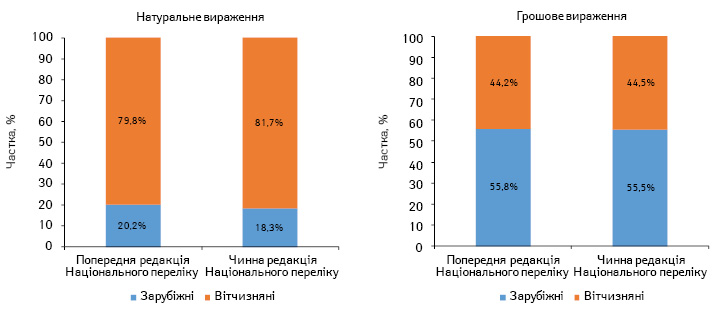
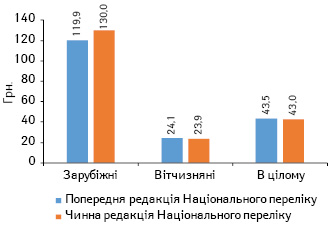
За підсумками 2016 р., частка препаратів вітчизняного виробництва (за власником ліцензії), включених до нової редакції Національного переліку, збільшилася з 80 до 82% порівняно з попередньою. При цьому у грошовому вираженні їх частка майже не змінилася (рис. 2). У зв’язку зі зміною структури препаратів, включених до нової редакції Національного переліку у порівнянні з попередньою змінилася і середньозважена вартість 1 упаковки. При цьому для вітчизняних препаратів вона дещо знизилася, а для зарубіжних, навпаки, підвищилася (рис. 3). Загалом середньозважена вартість 1 упаковки препаратів, включених до нової редакції Національного переліку, знизилася з 43,5 до 43,0 грн. за 1 упаковку.
Державні закупівлі
Відповідно до п. 11 постанови КМУ № 333, з 1 січня 2018 р. заклади й установи охорони здоров’я, що повністю або частково фінансуються з державного та місцевих бюджетів, повинні закуповувати тільки ті лікарські засоби, які включені до Національного переліку. Після задоволення на 100% потреби в препаратах з Національного переліку заклади охорони здоров’я зможуть закуповувати інші лікарські засоби, зареєстровані в Україні.
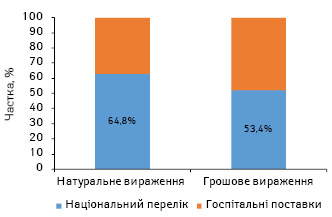
За підсумками 2016 р., обсяги госпітальних поставок препаратів, включених до Національного переліку, становлять 59,4 млн упаковок та 4,2 млрд грн. Прийнятий Національний перелік покриває госпітальні поставки на 63% у натуральному та на 52% — у грошовому вираженні (рис. 4). При цьому деякі групи АТС-класифікації покриваються Національним переліком менш ніж на 50% (рис. 5).
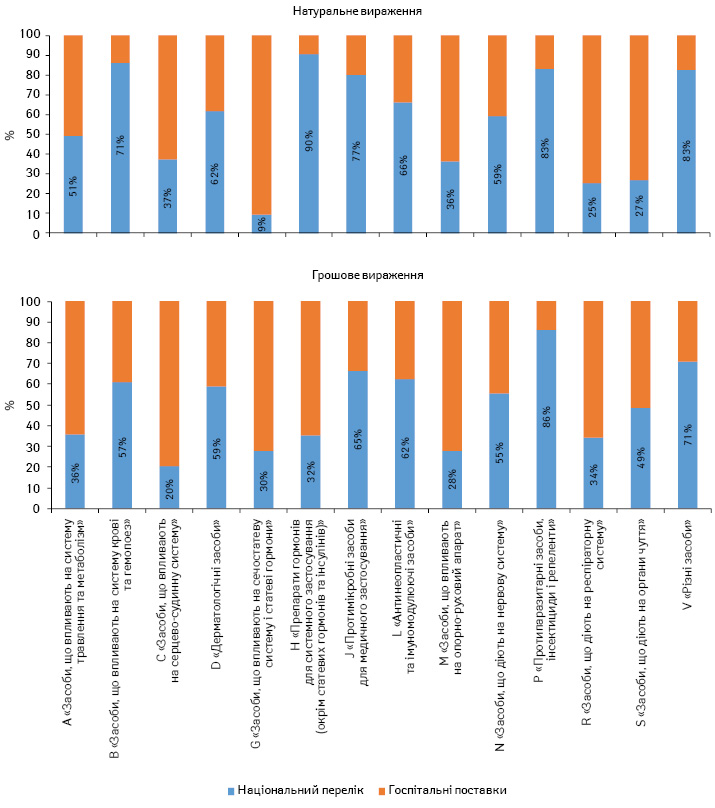
Окрім того, заклади й установи охорони здоров’я, що повністю або частково фінансуються з державного та місцевих бюджетів, можуть закуповувати лише ті препарати, на які задекларовано оптово-відпускну ціну, відповідно до постанови КМУ від 2 липня 2014 р. № 240 «Питання декларування зміни оптово-відпускних цін на лікарські засоби та вироби медичного призначення».
Станом на 1 січня 2018 р. в Україні зареєстровано 6357 торгових назв препаратів з урахуванням форми випуску, дозування та кількості в упаковці, які включені до Національного переліку. При цьому оптово-відпускна ціна відповідно до постанови КМУ № 240 задекларована на 2471 препарат.
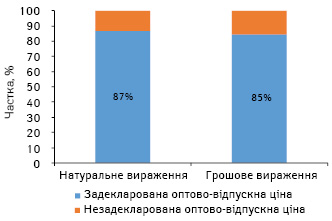
За нашими розрахунками, обсяги споживання препаратів, включених до Національного переліку, за підсумками 2016 р., у госпітальному сегменті становили 4,2 млрд грн. Частка препаратів, які включені до Національного переліку та на які задекларовано оптово-відпускну ціну, становить 87% у натуральному та 85% — у грошовому вираженні (рис. 6). Таким чином, заклади охорони здоров’я зможуть закуповувати переважну більшість лікарських засобів, включених до Національного переліку.
Як уже повідомлялося, заклади й установи охорони здоров’я, що повністю або частково фінансуються з державного та місцевих бюджетів, мають забезпечити 100% потребу в лікарських засобах, включених до Національного переліку. І ключовим є саме питання визначення цієї потреби.
На сьогодні Порядок визначення обсягів потреби в закупівлі лікарських засобів закладами й установами охорони здоров’я, що повністю або частково фінансуються з державного та місцевих бюджетів, затверджено наказом МОЗ України від 11.07.2017 р. № 782 «Про затвердження Порядку визначення обсягів потреби в закупівлі лікарських засобів закладами й установами охорони здоров’я, що повністю або частково фінансуються з державного та місцевих бюджетів». Цей порядок передбачає два методи кількісної оцінки потреби в ліках, зокрема метод, що базується на показниках захворюваності, та метод, що бере за основу показники споживання. Потреба в лікарських засобах може визначатися за допомогою одного або комбінації двох методів кількісної оцінки.
Наразі методи визначення потреби не використовувалися на практиці, і незрозуміло, чи зможуть заклади охорони здоров’я чітко визначити потребу в лікарських засобах, включених до Національного переліку.
Зміни до програми «Доступні ліки»
Постановою КМУ № 1080 розширено перелік МНН, вартість яких підлягає відшкодуванню (далі — Перелік МНН), затверджений постановою КМУ від 09.11.2016 р. № 863 «Про запровадження відшкодування вартості лікарських засобів». Так, перелік МНН для лікування серцево-судинних захворювань та цукрового діабету II типу доповнено таблетованими формами препаратів лозартану (Losartan) та глібенкламіду (Glibenclamide) відповідно.
Нагадаємо, що під відшкодування вартості можуть підпадати лише препарати, включені до Національного переліку. Наразі до нього входять препарати лозартану у формі таблеток з дозуванням 25, 50 та 100 мг, а також глібенкламіду у формі таблеток з дозуванням 5 мг.
Загальні обсяги роздрібної реалізації зазначених препаратів за підсумками 2017 р.*, становлять 872,4 тис. упаковок та, відповідно, 92,8 млн грн.
Також наказом МОЗ України від 02.01.2018 р. № 2 затверджено оновлений Реєстр граничних оптово-відпускних цін на лікарські засоби. Для здійснення суб’єктами фармацевтичного ринку реалізації залишків лікарських засобів, вартість яких відшкодовується повністю або частково, та інформування щодо термінів введення в дію оновленої редакції Реєстру лікарських засобів, вартість яких підлягає відшкодуванню (далі — Реєстр), МОЗ України опубліковано заплановану хронологію здійснення заходів, згідно з якою наказ про внесення змін до оновленої редакції Реєстру буде затверджено орієнтовно 5 лютого 2018 р.
Постановою КМУ № 1080 вносяться зміни до постанови КМУ від 17 березня 2017 р. № 152 «Про забезпечення доступності лікарських засобів». Зокрема, запроваджено норму, яка посилить конкуренцію в сегменті безкоштовних ліків. Так, заявники, вартість добової дози лікарського засобу яких у Реєстрі не більше ніж на 5% перевищує таку вартість добової дози препарату (з однаковою МНН та формою випуску), що відшкодовується повністю (без доплати), можуть повторно подати до МОЗ України документи зі зміненою оптово-відпускною ціною за упаковку лікарського засобу, яка в перерахунку на добову дозу дорівнює вартості добової дози препарату, що відшкодовується повністю.
Також аптекам надано перехідний період (30 днів) для реалізації залишків ліків, закуплених до затвердження оновленого Реєстру.
При цьому прийнятою постановою не усунено подвійну регуляцію націнок на препарати, включені до Національного переліку. Нагадаємо, що на лікарські засоби, включені до Національного переліку, гранична роздрібна націнка становить 25%, при цьому на перелік МНН у рамках програми «Доступні ліки» ця націнка становить 15%.
Окрім прийнятих змін, МОЗ України на своєму офіційному сайті оприлюднило для громадського обговорення проект постанови КМУ щодо розширення програми «Доступні ліки», яким пропонується включити до неї препарати, які застосовуються при трансплантації органів та тканин: азатіоприн (Azathioprine), мікофенолова кислота та її солі (Mycophenolic acid), такролімус (Tacrolimus) та циклоспорин (Ciclosporin).
Раніше наше видання аналізувало структуру захворюваності та смертності в Україні, а також рекомендувало пріоритетні напрямки розширення програми реімбурсації. Зокрема, ми зазначали, що перед включенням до програми нових нозологій необхідно забезпечити в повному обсязі потреби пацієнтів за вже наявними в програмі нозологіями, розширивши програму «Доступні ліки» препаратами, які входять до затверджених в Україні протоколів лікування. Для цього необхідно внести зміни щодо скасування вимоги щодо включення в систему реімбурсації лише препаратів з Національного переліку. Нагадаємо, що 13 грудня Уряд ухвалив зміни до постанови КМУ № 1303, які дозволяють аптечним закладам безоплатно і на пільгових умовах відпускати лікарські засоби, які зареєстровані в Україні та включені до галузевих стандартів без прив’язки до Національного переліку.
Висновки
Національний перелік розширено 54 новими МНН, а також за деякими МНН доповнено новими формами випуску та дозуваннями. При цьому процедура включення лікарських засобів до Національного переліку недостатньо чітко визначена регулятором. Єдиним чітким визначенням є включення препаратів у разі оновлення Базового переліку ВООЗ. Однак, як свідчить аналіз більше 50 МНН, включених до Базового переліку ВООЗ не увійшли до Національного переліку. Проте, у нього включено близько 40 МНН, які не містяться в Базовому переліку ВООЗ.
Залишається відкритим питання щодо визначення потреби в лікарських засобах, включених до Національного переліку. Наразі методика визначення потреби не довела свою застосовність. Також незрозуміло, хто контролюватиме правильність визначення потреби, адже від цього залежить фінансування. До того ж структура Національного переліку, яка складається з переліку МНН, форм випуску та дозувань, ускладнює процес визначення потреби та обліку статистичних даних.
МОЗ необхідно створити Національний перелік за торговими назвами з прив’язкою до кодів АТС-класифікації та із зазначенням задекларованих цін, публікувати його в зручному форматі (наприклад у вигляді Excel-файлів) та регулярно оновлювати.
Програму «Доступні ліки» розширено 2 діючими речовинами, також МОЗ вкотре пропонується включення до програми нових нозологій. Більш детально з ходом реалізації програми «Доступні ліки» за підсумками 2017 р., а також аналізом запропонованих МОЗ змін ми ознайомимо читачів найближчим часом.
що включені до Національного переліку, в електронному вигляді
з унікальними кодами/кодами Моріон,
можна звертатися за тел.: (044) 585-97-12 або e-mail:

Коментарі