Израильский институт биологических исследований (Israel Institute for Biological Research — IIBR), большая часть деятельности которого находится под военной цензурой в связи с участием в разработке средств защиты от биологического и химического оружия, в настоящее время разрабатывает вакцину нового типа Brilife против COVID-19. Работающий под эгидой канцелярии премьер-министра и тесно сотрудничающий с министерством обороны, IIBR совместно с компаниями Brilife Georgia, Iqvia Pty Ltd и Cromos, 9 августа объявили о начале исследования IIb фазы вакцины BRILIFE001 (NCT04990466).
Спонсором исследования, которое проходит под надзором Центра исследований общественного здравоохранения Ричарда Лугара (Richard Lugar Center for Public Health Research), Тбилиси, является международная компания NRx Pharmaceuticals, штат Флорида, США, испытывающая в настоящее время в Грузии свой инновационный препарат для пациентов с COVID-19 в критическом состоянии.
Brilife — это самораспространяющаяся (self-propagating) живая вирусная вакцина, несущая весь спайковый белок дикого (уханьского) типа SARS-CoV-2 на векторной платформе рекомбинантного вируса везикулярного стоматита (Vesicular Stomatitis Virus — VSV) (рис. 1). Комплекс белков-шипов, присущий другим вариантам вируса, может быть включен в вакцину BriLife по мере их выявления (рис. 2). Вакцина, носящая также названия IIBR-100 и rVSV-SARS-CoV-2-S, показала обнадеживающие результаты in vivo (Yahalom-Ronen Y. et al., 2020) и прошла исследования I фазы в Израиле (NCT04608305).
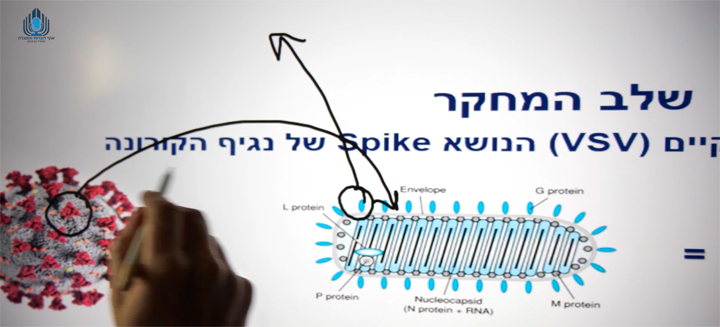

Программа фазы IIb, помимо исследования разных доз при одно- и двухкратном введении, в том числе лицам пожилого возраста, также будет включать потенциальную возможность внутрикожной, вместо внутримышечной, вакцинации. Цель исследования — подтвердить способность вакцины вызывать иммунный ответ против «дельта»-варианта COVID-19 до начала исследований III фазы в нескольких странах.
Самораспространяющиеся вакцины — что это?
Еще совсем недавно о самораспространяющихся (self-propagating) живых вирусных вакцинах можно было прочесть преимущественно в контексте вакцинации животных, в основном для предотвращения зоонозов. К борьбе с пандемиями это имело лишь опосредованное отношение: как средство устранения зоонозных патогенов высокого риска из их животных резервуаров (бешенство, вирус Ласса), в том числе до того, как произойдет их распространение среди людей (Nuismer S.L., Bull J.J., 2020).
Самораспространяющиеся вакцины уходят корнями в усилия австралийцев по созданию стерилизующих вакцин для контроля размножения мелких млекопитающих, отмечают авторы статьи в «Nature». Также исследованы вакцины против миксоматоза и геморрагической лихорадки кроликов. Их очевидное преимущество, конечно же, состоит в том, что на каждое непосредственно вакцинированное животное приходится масса особей, иммунизирующихся опосредованно: либо путем заражения (трансмиссии), либо простого (контактного) распространения вакцины (рис. 3). Так, в первом случае привитая летучая мышь становится для своих сородичей источником заражения вакциной. Во втором вакцину наносят на шерстку одного из животных, которое «пачкает» следующее и т.д. Вакцину, способную выделяться с грудным молоком или калом, также можно добавлять в корма (делать приманки для диких животных).
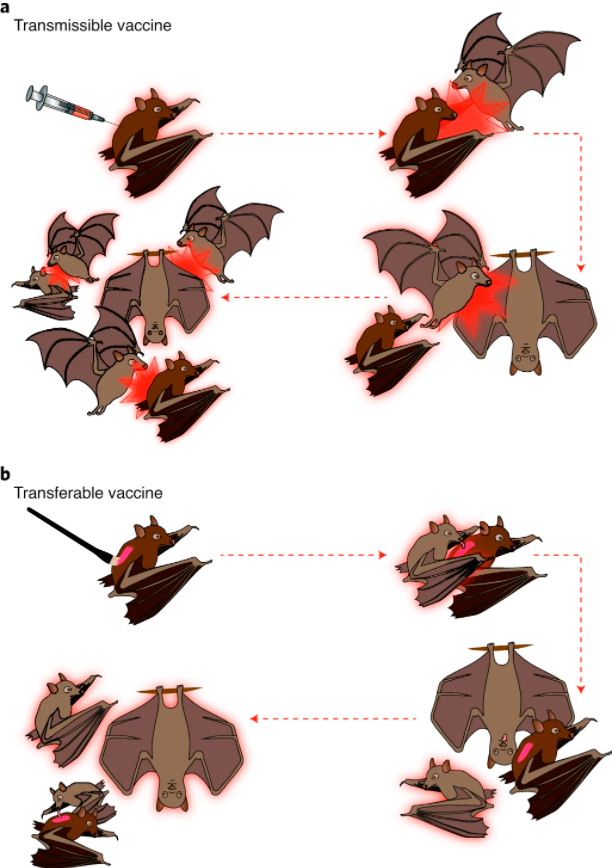
Организация применения неконтагиозных вакцин отличается от индивидуальной вакцинации только меньшим количеством прививок. С трансмиссивными вакцинами все не так: чем в большей степени инфекционное число (R0) вакцины превышает таковое у патогена, тем меньше доз потребуется и тем быстрее произойдет вытеснение патогена. Эрадикация патогена, тем не менее, возможна и при использовании вакцины с R0 <1, распространение инфекции которой естественным образом затухает после прекращения прививок. Из-за опасений относительно возникновения мутаций самораспространяющихся вакцин, ведущих к повышению их патогенности, именно такие «самозатухающие» вакцины являются предпочтительными.
Как отмечено в вышеназванной статье, естественный отбор, скорее всего, будет способствовать усилению передачи (трансмиссивности) вектора и мутациям, приводящим к потере или подавлению иммуногенной вставки. Поэтому наиболее вероятным результатом эволюции будет возвращение к безобидному вирусному вектору с потерей антигенной вставки. Авторы признают, что «мы еще многого не знаем об эффективности самораспространяющихся вакцин в реальных условиях. Первым логическим шагом является начало разработки, тестирования и внедрения одноэтапных (one-step) переносимых вакцин». Выбор категории лиц для непосредственного введения доз будет самым важным при планировании первоначального внедрения вакцины, а также может повлиять на скорость и степень распространения вакцины среди населения.
Единственная одобренная вакцина
Первой в мире вакциной против вируса Эболы была вакцина на VSV-платформе — Ervebo от «Merck & Co., Inc.», получившая одобрение Управления по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) в декабре 2019 г., а позднее — в Европе и других странах. Данная вакцина является трансмиссивной, и РНК вакцинного вируса выявляли в крови, слюне и моче вакцинированных до 14-го дня после вакцинации, отмечено в инструкции по медицинскому применению. Длительность вирусовыделения неизвестна, однако образцы, собранные спустя 28 дней после вакцинации, дали негативный результат полимеразной цепной реакции.
Ближайшая цель — 15 млн доз Brilife
IIBR готовится произвести от 10 до 15 млн доз вакцины, сообщает Channel 12 со ссылкой на «доверенный источник» (рис. 4).

По информации, распространяемой израильской прессой и , исследования II и III фаз планируют, помимо Грузии и Израиля, проводить также в Украине.
Список использованной литературы
Nuismer S.L., Bull J.J. (2020) Self-disseminating vaccines to suppress zoonoses. Nat Ecol Evol, 4, 1168–1173. https://doi.org/10.1038/s41559-020-1254-y.
Yahalom-Ronen, Y., Tamir, H., Melamed, S. et al. A single dose of recombinant VSV-∆G-spike vaccine provides protection against SARS-CoV-2 challenge. Nat Commun 11, 6402 (2020). https://doi.org/10.1038/s41467-020-20228-7
По материалам www.jpost.com; www.israel21c.org; www.fda.gov; www.sciencemag.org; www.nrxpharma.com; clinicaltrials.gov; www.pharmaceutical-technology.com; iibr.gov.il

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим