|
 Доповідь, присвячену стану та перспективам розвитку фармації України, увазі присутніх запропонував заступник голови Державної служби лікарських засобів та виробів медичного призначення (далі — Держслужба) Костянтин Косяченко. Він поінформував учасників, що в Україні станом на 01.01.2008 р. зареєстровано та знаходиться в обігу 12 620 найменувань лікарських засобів (ЛЗ), серед яких 29,9% вітчизняного та 70,1% іноземного виробництва. Виходячи з цих даних, відмічається тенденція до зменшення питомої ваги ЛЗ вітчизняного виробництва — в 2007 р. їх частка становила 31,9%, в 2006 р. — 32,8%.
Доповідь, присвячену стану та перспективам розвитку фармації України, увазі присутніх запропонував заступник голови Державної служби лікарських засобів та виробів медичного призначення (далі — Держслужба) Костянтин Косяченко. Він поінформував учасників, що в Україні станом на 01.01.2008 р. зареєстровано та знаходиться в обігу 12 620 найменувань лікарських засобів (ЛЗ), серед яких 29,9% вітчизняного та 70,1% іноземного виробництва. Виходячи з цих даних, відмічається тенденція до зменшення питомої ваги ЛЗ вітчизняного виробництва — в 2007 р. їх частка становила 31,9%, в 2006 р. — 32,8%.
Станом на 01.01.2008 р. виробництво ЛЗ в Україні здійснюють 143 підприємства, серед яких 27 фармацевтичних фабрик та 13 виробників субстанцій. Номенклатура ЛЗ, які вони виробляють, становить близько 4000 найменувань практично всіх фармакотерапевтичних груп. За останні 5 років щорічно у виробництво впроваджується більше 100 найменувань ЛЗ, з яких 5% — принципово нові. На відповідність вимогам належної виробничої практики (GMP) на сьогодні сертифіковано 23 виробничі дільниці 12 вітчизняних підприємств.
К. Косяченко відзначив, що за останні роки спостерігається тенденція до збільшення обсягів внутрішнього ринку ЛЗ, який в 2007 р. становив 12,3 млрд грн., або майже 2,5 млрд дол.США, що на 32,1% більше порівняно з 2006 р. Протягом 2007 р. українськими виробниками реалізовано фармацевтичної продукції на 3,2 млрд грн., що на 15,3% більше, ніж в 2006 р. Але доповідач звернув увагу присутніх, що останнім часом це зростання відбувається також і за рахунок підвищення цін на ЛЗ.
За даними державного комітету статистики, у 2007 р. загальний обсяг експорту фармацевтичної продукції збільшився порівняно з попереднім роком на 40% та становив 129,45 млн дол., проте експортний потенціал вітчизняних підприємств залишився на тому ж рівні, збільшення обсягу також відбулося, в тому числі, і за рахунок зростання цін. Загальний обсяг імпорту ЛЗ у 2007 р. порівняно з попереднім збільшився на 39,5% та становив 1,9 млрд дол.
Оптово-роздрібну реалізацію ЛЗ в Україні здійснюють 5610 суб’єктів господарювання, яким підпорядковано 23 317 аптечних закладів: аптек, аптечних пунктів, кіосків, складів, оптових баз, з яких 84% знаходяться в містах та селищах міського типу. К. Косяченко підтвердив, що на сьогодні населення України забезпечено широким асортиментом ЛЗ вітчизняного та іноземного виробництва та розгалуженою мережею аптечних закладів, але проблема сільських аптечних закладів досі не вирішена, крім того, існує тенденція до зменшення їх кількості. Комунальні аптечні мережі закривають свої підрозділи у селах, оскільки навіть за наявності приміщення, що відповідає ліцензійним умовам, відсутні спеціалісти, які би мали бажання там працювати. Доповідач підкреслив, що третина населення країни проживає в сільській місцевості, тому основним завданням для державних та місцевих органів самоврядування, МОЗ України, навчальних закладів є врегулювання даної проблеми.
Основні напрямки розвитку фармації в Україні окреслені Програмою діяльності, яка затверджена постановою КМУ від 16.01.2008 р. № 14 «Про затвердження Програми діяльності Кабінету Міністрів України «Український прорив: для людей, а не для політиків». У цій програмі основними завданнями щодо розвитку фармації є запровадження дієвого механізму здійснення державного контролю за виробництвом, імпортом, реалізацією та рекламою фармацевтичної продукції, а також за якістю ЛЗ і виробів медичного призначення у процесі їх виробництва та ввезення на територію України, підвищення конкурентоспроможності вітчизняної фармацевтичної продукції, розроблення та затвердження Програми боротьби з розповсюдженням фальсифікованих ЛЗ на 2009–2012 рр., проведення раціональної фармацевтичної політики.
Доповідач наголосив, що у рамках реалізації визначених Програмою діяльності КМУ основних завдань, МОЗ України веде постійну роботу з удосконалення нормативно-правової бази у сфері обігу ЛЗ та виробів медичного призначення за такими пріоритетними напрямками:
створення системи управління якістю всього циклу обігу ЛЗ шляхом впровадження вимог GLP, GCP, GMP, GDP, GPP;
удосконалення системи державної реєстрації ЛЗ, зокрема через її адаптацію до міжнародних норм, у першу чергу європейських держав;
запровадження багатоканального фінансування фармацевтичної науки за рахунок бюджетних та позабюджетних коштів, забезпечення їх раціонального використання для першочергового фінансування конкурентоспроможних наукових розробок фундаментального та прикладного характеру.
Така програма дій МОЗ повністю відповідає основним положенням Концепції розвитку фармацевтичного сектору, яка приведена в наказі МОЗ від 18.12.2007 р. № 838 «Про затвердження Концепції розвитку фармацевтичного сектору галузі охорони здоров’я України».
Здійснення комплексу заходів щодо обґрунтування та забезпечення інформаційних ресурсів для фармацевтичного сектору галузі також є пріоритетним напрямком роботи МОЗ, відзначив доповідач. На сайті Держслужби повністю висвітлюються та виносяться на обговорення проекти нормативних документів, результати засідань ліцензійних комісій, інформація стосовно зареєстрованих ЛЗ та виробів медичного призначення, проте це лише початок тривалого шляху впровадження інформаційних технологій. Проводиться робота і щодо створення єдиного інформаційного поля у сфері обігу ЛЗ та впровадження зворотного зв’язку з суб’єктами господарювання.
Також серед важливих напрямків роботи згідно з цією концепцією К. Косяченко відзначив створення системи оцінки, моніторингу та контролю за якістю фармацевтичної освіти, яка полягає в послідовному здобутті академічних ступенів «бакалавр» і «магістр» з подальшим отриманням наукових ступенів. Питання якісної освіти, на думку доповідача, складне — багато майбутніх спеціалістів навчаються не на провізорів або фармацевтів, а на реалізаторів ЛЗ, орієнтуючись не на соціально спрямовану діяльність в майбутньому, а на бізнес, що є негативною тенденцією.
Незважаючи на те що практично в кожному обласному центрі країни при багатьох медичних училищах та непрофільних ВНЗ відкрилися фармацевтичні відділення та факультети, освітній рівень необхідно піднімати на якісно новий щабель, оскільки в Україні існує великий дефіцит висококваліфікованих кадрів. Держава вже робить певні кроки на шляху до підвищення якості викладання та знань, — це, зокрема, впровадження основних засад Болонського процесу, орієнтованих на відповідальну самостійну роботу студентів з метою покращання якості їх знань та засвоєння нових навичок.
На завершення доповіді К. Косяченко зауважив, що реалізація вищезазначених програм, спрямованих на забезпечення населення якісними та доступними ЛЗ, приведе до більш ефективної роботи фармацевтичних підприємств та в кінцевому результаті підвищить працездатність, тривалість та якість життя населення.
У процесі жвавої дискусії, яка розгорнулася після доповіді, заступник голови Полтавської облдержадміністрації Надія Мякушко поділилася з учасниками конференції досвідом Полтавщини у вирішенні проблеми виховання висококваліфікованих спеціалістів, де вже другий рік практикують укладання тристоронніх угод на підготовку кадрів, у яких беруть участь навчальний заклад, студент-абітурієнт або його батьки та роботодавець, який замовляє спеціаліста, частково або повністю сплачує кошти за навчання та забезпечує проходження виробничої практики. В угоді визначено не лише обов’язкове отримання диплому як кінцевого результату навчання, але і якісні професійні характеристики випускника, які перевіряє работодавець шляхом атестації.
 Наступний доповідач, директор з досліджень та розробок корпорації «Артеріум», эксперт ВООЗ Сергій Сур, розповів присутнім про міжнародні стандарти GDP і вітчизняну дистриб’юцію ЛЗ. На його думку, GDP — терра інкогніта для багатьох вітчизняних оптових фармацевтичних компаній, тому підготовка та впровадження цієї системи потребує проведення спеціалізованих семінарів та тренінгів з подальшою розробкою тактики дій.
Наступний доповідач, директор з досліджень та розробок корпорації «Артеріум», эксперт ВООЗ Сергій Сур, розповів присутнім про міжнародні стандарти GDP і вітчизняну дистриб’юцію ЛЗ. На його думку, GDP — терра інкогніта для багатьох вітчизняних оптових фармацевтичних компаній, тому підготовка та впровадження цієї системи потребує проведення спеціалізованих семінарів та тренінгів з подальшою розробкою тактики дій.
За визначеннями ВООЗ, яке відображено в серії технічних звітів (WHO TRS 937, 40th report, 2006), належна дистриб’юторська практика (GDP) — частина забезпечення якості, яка гарантує, що якість ЛЗ підтримується шляхом адекватного контролю ряду численних дій при здійсненні процесу дистриб’юції — розподілу та пересуванню ЛЗ з приміщень їх виробника або інших центральних пунктів до кінцевого користувача або до проміжних пунктів різними транспортними методами, через різні склади та (або) організації охорони здоров’я.
У більшості країн виробник — це центральна ланка в системі постачання ЛЗ, від якої значною мірою залежить якість препаратів. Відповідальність виробника ЛЗ поширюється як на одержання вихідних матеріалів від затверджених постачальників та виробництво в умовах GMP, так і на постачання ЛЗ кінцевому споживачеві або пацієнту. На сьогодні у зв’язку з глобалізацією торгівлі, підвищенням ризику фальсифікації, змінами кліматичних умов для виробника стає дуже важливою відповідальність за забезпечення якості ЛЗ на етапі реалізації, тому вимоги до неї повинні поширюватися і на дистриб’юторську мережу.
Як приклад доповідач навів цитату з Ciaran Brady, Lyndsey Wright (Pharmaceutical Technology Europe, 01 September 2007; www.ptemag.com): «GDP залишається суттєвим аспектом забезпечення якості всіх фармацевтичних продуктів та сировини, які транспортують та постачають на локальному і глобальному рівнях. Глобальні постачальні ланцюги стають більш складними. У контексті зростаючої конкуренції, змін клімату та глобального зростання фальсифікації ЛЗ впровадження GDP сьогодні стає більш важливим порівняно з попередніми роками».
Визначення GDP, як підкреслив С. Сур, логічно охоплює джерела постачання, приймання, зберігання та транспортування — весь ланцюг постачання, необхідного для виробництва та продажу ЛЗ, тому викликом для всіх фармацевтичних компаній та їх партнерів є необхідність організувати контроль за всіма елементами ланцюга поставок.
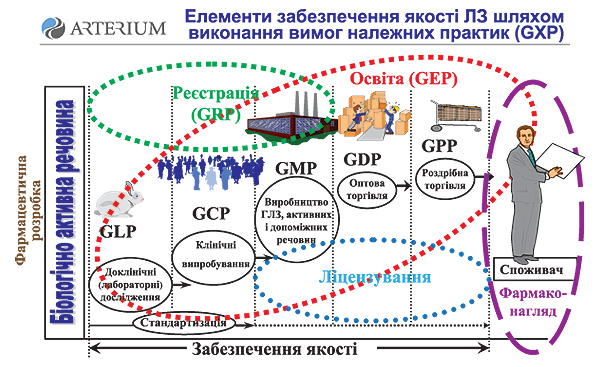
Важливість GDP також підкреслена в Рекомендаціях ЄС з дистриб’юторської практики, в яких встановлені принципи необхідних операцій. Фармацевтична промисловість ЄС забезпечує якість ЛЗ на високому рівні, який також повинен підтримуватися у дистриб’юторській мережі для доставки зареєстрованих препаратів до роздрібної мережі без будь-яких втрат їх властивостей. Щоб підтримати цю якість, Директива 92/25/EEC зобов’язує дистриб’юторів виконувати принципи та рекомендації GDP, які опубліковані Комісією ЄС.
Доповідач висвітлив основні документи ВООЗ, у яких визначено ключові моменти впровадження та дотримання GDP: належна дистриб’юторська практика для фармацевтичної продукції — Good distribution practices for pharmaceutical products (WHO TRS 937, 2006 Annex 5) та Директива 2004/27/ЕС (Directive 2004/27/EС Of The European Parliament And Of The Council of 31 March 2004) як доповнення Директиви 2001/83/ЕС. В Україні основними документами, в яких закладено перші принципові положення GDP, є Інструкція про порядок контролю якості лікарських засобів під час оптової та роздрібної торгівлі, затверджена наказом МОЗ від 30.10.2001 р. № 436, та Настанова 42-01-2002 «Лікарські засоби. Належна практика дистриб’юції», затверджена наказом МОЗ від 19.03.2002 р. № 103.
С. Сур також навів зміст GDP ЄC 1994 р. (94/C 63/03), аналогічний діючим нині українським положенням, до якого ввійшли пункти стосовно вимог до персоналу, документації, приміщень і обладнання, поставок замовникам, повернення ЛЗ, самоінспектування, інформації, що надається країнам ЄС стосовно діяльності в галузі оптової торгівлі.
На завершення доповіді С. Сур нагадав, що згідно з постановою КМУ від 28.10.2004 р. № 1419 «Деякі заходи щодо забезпечення якості лікарських засобів», починаючи з 1.01.2009 р. МОЗ необхідно забезпечити обіг ЛЗ відповідно до вимог належної виробничої, клінічної, лабораторної та дистриб’юторської практики, гармонізованої з відповідними директивами ЄС і ВООЗ. Проте, незважаючи на швидкий та менш затратний порівняно з переходом виробництва ЛЗ відповідно до вимог GMP процес провадження GDP, на сьогодні жодна з компаній не подала заявку на отримання такого сертифікату.
 Заступник генерального директора з фармації аптечної мережі «Мед-Сервіс» Костянтин Андрійчук виступив з доповіддю «Необхідність приведення діючих наказів МОЗ та постанов КМУ у відповідність з новими ліцензійними умовами», в якій розповів про труднощі в організації роботи аптечної мережі та висунув пропозиції щодо їх вирішення.
Заступник генерального директора з фармації аптечної мережі «Мед-Сервіс» Костянтин Андрійчук виступив з доповіддю «Необхідність приведення діючих наказів МОЗ та постанов КМУ у відповідність з новими ліцензійними умовами», в якій розповів про труднощі в організації роботи аптечної мережі та висунув пропозиції щодо їх вирішення.
К. Андрійчук зупинився на деяких проблемних моментах, які виникають через недосконалість діючих нормативних актів, та, на його думку, йдуть врозріз з положеннями Проекту змін до ліцензійних умов. Так, наприклад, постановою КМУ від 17.11.2004 р. № 1570 «Про затвердження Правил торгівлі лікарськими засобами в аптечних закладах» чітко встановлено поняття та визначення паспорта аптечного закладу — це складений суб’єктом господарювання при створенні або реконструкції аптечного закладу і погоджений з територіальними органами державної санітарно-епідеміологічної служби, державного контролю якості лікарських засобів і місцевими органами виконавчої влади документ, який засвідчує відповідність наявних приміщень та устаткування аптечного закладу (його структурного підрозділу) встановленим вимогам і можливість використання для оптової та роздрібної торгівлі лікарськими засобами. Разом з тим паспорт аптечного підрозділу містить й іншу інформацію — дані завідувача аптеки як керівника структурного підрозділу, які можуть змінюватися через певні обставини, наприклад одруження та зміна прізвища.
Перевірки Держслужбою на місцях розцінюють їх як невідповідність фактичних даних аптечного паспорту та даних паспорта громадянина України та вбачають в цьому порушення ліцензійних умов. Такі випадки мали місце в аптечних підрозділах мережі «Мед-Сервіс», проте чи законні вимоги контролюючих органів переоформлення паспорту при зміні прізвища завідуючим, керівництво мережі так і не визначило. У доповненні до ліцензійних умов передбачено наявність актуалізованого паспорта аптечного закладу встановленої законодавством форми, який потрібно своєчасно його переоформити в наступних випадках: при зміні найменування юридичної особи або прізвища, імені, по батькові фізичної особи — суб’єкта підприємницької діяльності, при зміні місцезнаходження юридичної особи або місця проживання фізичної особи — суб’єкта підприємницької діяльності, при зміні площ та складу приміщень аптеки (структурного підрозділу).
Доповідач запропонував окремим законодавчим актом визначити форму паспорту аптечного закладу та порядок його узгодження територіальними підрозділами Державної інспекції з контролю якості лікарських засобів (далі — Державна інспекція).
Також керівництво мережі «Мед-Сервіс» непокоїть питання стосовно вимог до стажу роботи за фахом для спеціалістів, які можуть претендувати на посаду завідуючого аптекою. Доповідач відзначив, що зараз вже за 3 роки формується достатня кількість фахівців, які мають необхідний обсяг знань та активно працюють над підвищенням професійного рівня, та могли б ефективно керувати аптекою. Існуюча норма, яка передбачає 5 років стажу для завідуючого, не лише обмежує можливості молодих спеціалістів, але провокує їх на звільнення та пошук нової роботи в сфері оптової торгівлі ЛЗ та представництвах фармацевтичних компаній. К. Андрійчук запропонував внести в кваліфікаційні вимоги зміни щодо обов’язкового стажу роботи за спеціальністю для претендентів на посаду завідуючого з 5 до 3 років.
Було піднято питання взаємовідносин суб’єктів роздрібного ринку з територіальними державними інспекціями при проведенні планових перевірок, під час яких відзначається тенденція перекладання затрат з оплати досліджень на суб’єкта господарювання. З початку 2008 р. в аптечних установах мережі «Мед-Сервіс» проведено 81 перевірку та взято 117 позицій ЛЗ для досліджень, з яких 22 позиції (приблизно 19%) визнано неякісними, у тому числі й через недоліки маркування, яке відрізняється від наведеного в аналітично-нормативній документації (АНД) графічного зображення, невідповідність упаковки макету та орфографічні помилки. У появі таких ЛЗ з порушенням маркування та упаковки згідно з АНД на полицях аптеки винні виробники, тому доповідач вніс пропозицію перекласти оплату проведення аналізів на них, а не на суб’єктів господарювання.
Також пролунало звернення до Державної інспекції з проханням розробити єдиний порядок оплати консультаційних, організаційно-методичних послуг, проведених аналізів та створення єдиного прейскуранту на надання послуг, який вже існує в СЕС. Фармацевтичні мережі готові платити за якісні консультаційні послуги на місцях.
К. Андрійчук зауважив, що на сьогодні підвищення прибутковості підприємства є нормою торговельної діяльності. Один із таких шляхів — використання на площах торговельного залу додаткових видів послуг — банкоматів, терміналів з прийому платежів від населення, не вважаючи це порушенням ліцензійних умов.
Також доповідач запропонував звернути увагу на такі шляхи підвищення прибутковості в рамках ліцензійних умов: створення єдиної доступної для всіх суб’єктів бази з реєстрації ЛЗ, розширення переліку товарів, які можуть закупатися та продаватися в аптеці шляхом внесення змін до наказу МОЗ від 26.11.2004 р. № 577 «Про затвердження переліку товарів, які мають право придбати та продавати аптечні заклади та їх структурні підрозділи», визначення окремим наказом МОЗ переліку медичних послуг, дозволених в умовах аптеки.
Завершуючи доповідь, К. Андрійчук наголосив, що представники фармацевтичного бізнесу та учасники ринку готові йти до того, щоб ефективно працювати, дотримуючись ліцензійних умов, для забезпечення покупців якісними, ефективними та безпечними ЛЗ та сподіваються на плідну співпрацю з державними органами влади та спільну побудову цивілізованого фармацевтичного ринку.
У дискусії, яка відбулася по закінченні доповіді, активну участь взяли представники Державної інспекції. Начальник Державної інспекції в Донецькій області Віктор Хоменко зауважив, що доповідач виступив як представник аптечної комерційної структури. Бажаючи розширити перелік послуг, які зможе надавати аптека з метою підвищення прибутковості, він не згадав при цьому про впровадження виготовлення ЛЗ в умовах аптеки як важливий напрямок роботи закладу.
Стосовно проведених перевірок та виявлених неякісних ЛЗ учасники конференції погодилися, що це провина постачальника, а не аптеки, але ці перевірки як ефективний метод виявлення та боротьби з фальсифікацією ЛЗ повинні відбуватися значно частіше.
Начальник Державної інспекції в Чернігівській області Людмила Федорова відзначила, що можливим варіантом рішення проблеми неякісних ЛЗ може бути внесення в угоди постачання окремих умов, які передбачають стягнення з постачальника суми штрафу у випадку поставки неякісного товару. Стосовно введення переліку медичних послуг, які може надавати аптека, Л. Федорова нагадала, що медична практика потребує ліцензування, та навіть за цієї умови лікарі не мають права використовувати площу, яка визначена в паспорті аптечного закладу як виробнича, тому представники Державної інспекції категорично проти її використання, у тому числі і під банківські термінали.
Таким чином, наявність низки нагальних питань стосовно регулювання фармацевтичної галузі, про які засвідчила тривала дискусія після виступу доповідачів, ще раз довела, що вирішення проблемних питань та пошук компромісів повинні відбуватися в процесі спілкування усіх зацікавлених сторін.
У наступних номерах «Щотижневика АПТЕКА» ми продовжимо знайомити читачів з цікавими доповідями та коментарями до них провідних спеціалістів. З матеріалами конференції ви можете ознайомитися на сайті www.apteka.ua. n

Ганна Барміна,
фото Любові Столяр

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим