 В период всплеска эпидемии чумы в некоторых исторических документах упоминалось о том, что у тех, кто перенес это заболевание, повторно оно не возникало. Тогда более правдоподобным объяснением такого явления была божья благодать: считалось, что перенесенное заболевание позволяло человеку искупить все грехи и стать святым. Возможно, именно тогда появилось слово «иммунитет» (от лат. immunitas — освобождение от чего-либо). Все же со временем чаще стали возникать гипотезы, что причиной такого освобождения является определенная внутренняя защита организма, позволяющая предотвратить повторное развитие заболевания. Однако механизм ее работы оставался неизвестным долгие столетия. С изобретением микроскопа ученые смогли сделать вывод, что причиной развития определенных заболеваний являются микроорганизмы. Однако, если окружающий мир так густо населен множеством возбудителей, то почему заболевания развивались лишь у некоторых людей? Что позволяло остальным оставаться здоровыми? Ответы на эти вопросы начали появляться относительно недавно — в начале XX века. Так, Илья Мечников отдал главную роль в защите организма специальным клеткам, которые возбудителей захватывали, проглатывали и при помощи ферментов переваривали. Эти клетки получили название фагоциты (что в переводе с греческого означает «клетки-пожиратели»), а теория иммунитета была названа фагоцитарной (клеточной). В противоположность И. Мечникову, Пауль Эрлих (Paul Ehlich) был основоположником гуморальной (неклеточной) теории иммунитета, согласно которой защита организма осуществляется благодаря специальным белковым веществам — антителам, вырабатываемым клетками в ответ на попадание в организм чужеродных агентов. Следует отметить, что такое противоречивое представление об иммунитете не помешало обоим ученым в 1908 г. получить Нобелевскую премию. Со временем стал очевидным тот факт, что данные теории не противоречат, а, наоборот, дополняют друг друга. Электронный микроскоп позволил взглянуть на иммунные механизмы защиты организма на молекулярном уровне.
В период всплеска эпидемии чумы в некоторых исторических документах упоминалось о том, что у тех, кто перенес это заболевание, повторно оно не возникало. Тогда более правдоподобным объяснением такого явления была божья благодать: считалось, что перенесенное заболевание позволяло человеку искупить все грехи и стать святым. Возможно, именно тогда появилось слово «иммунитет» (от лат. immunitas — освобождение от чего-либо). Все же со временем чаще стали возникать гипотезы, что причиной такого освобождения является определенная внутренняя защита организма, позволяющая предотвратить повторное развитие заболевания. Однако механизм ее работы оставался неизвестным долгие столетия. С изобретением микроскопа ученые смогли сделать вывод, что причиной развития определенных заболеваний являются микроорганизмы. Однако, если окружающий мир так густо населен множеством возбудителей, то почему заболевания развивались лишь у некоторых людей? Что позволяло остальным оставаться здоровыми? Ответы на эти вопросы начали появляться относительно недавно — в начале XX века. Так, Илья Мечников отдал главную роль в защите организма специальным клеткам, которые возбудителей захватывали, проглатывали и при помощи ферментов переваривали. Эти клетки получили название фагоциты (что в переводе с греческого означает «клетки-пожиратели»), а теория иммунитета была названа фагоцитарной (клеточной). В противоположность И. Мечникову, Пауль Эрлих (Paul Ehlich) был основоположником гуморальной (неклеточной) теории иммунитета, согласно которой защита организма осуществляется благодаря специальным белковым веществам — антителам, вырабатываемым клетками в ответ на попадание в организм чужеродных агентов. Следует отметить, что такое противоречивое представление об иммунитете не помешало обоим ученым в 1908 г. получить Нобелевскую премию. Со временем стал очевидным тот факт, что данные теории не противоречат, а, наоборот, дополняют друг друга. Электронный микроскоп позволил взглянуть на иммунные механизмы защиты организма на молекулярном уровне.
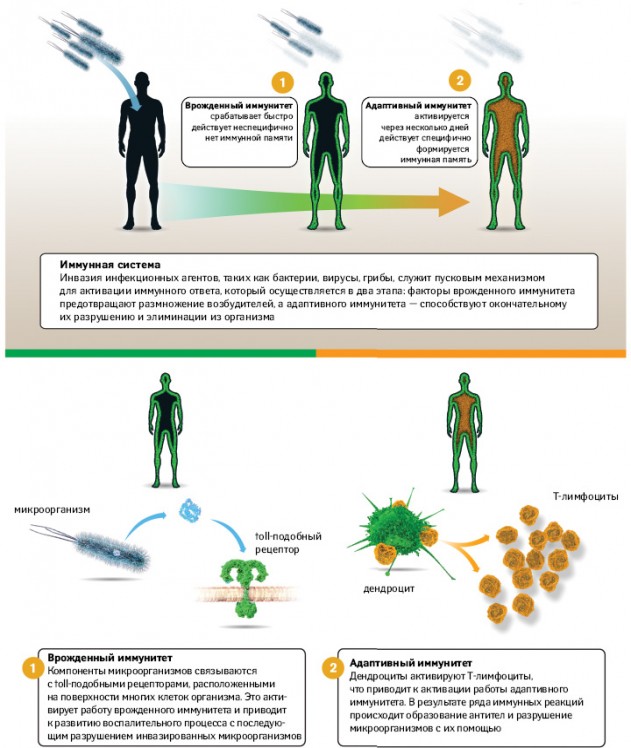
Сейчас уже широко известен тот факт, что иммунная система — мощный щит и меч нашего организма. Она позволяет противодействовать многим механическим, химическим, биологическим факторам окружающей среды. Установлено, что иммунитет бывает врожденный и приобретенный.
 1-й линией защиты является присущий всем живым существам врожденный, естественный, неспецифический иммунитет. Столько синонимов он имеет не просто так. Его функционирование начинается с самого рождения человека и призвано предотвратить проникновение чужеродных агентов в ткани организма. Это осуществляется за счет таких барьеров:
1-й линией защиты является присущий всем живым существам врожденный, естественный, неспецифический иммунитет. Столько синонимов он имеет не просто так. Его функционирование начинается с самого рождения человека и призвано предотвратить проникновение чужеродных агентов в ткани организма. Это осуществляется за счет таких барьеров:
- анатомический, который включает механический (кожа, слизистые оболочки защищают от механического проникновения, а реснички эпителия дыхательного тракта в результате движения выводят возбудителей из организма); химический (лизоцим и фосфолипаза, содержащиеся в слюне, слезах, назальном секрете, кислый желудочный сок ингибируют рост возбудителей и повреждают их клеточную оболочку); биологический (нормальная микрофлора кожи и пищеварительного тракта ингибирует рост патогенной флоры);
- гуморальный (система комплемента, лактоферрины, интерфероны и т.д.);
- клеточный (нейтрофилы переваривают возбудителей после фагоцитоза, макрофаги способны повреждать бактерии и без предварительного фагоцитоза, а также выполнять антигенпрезентирующую функцию — то есть знакомить с возбудителем другие клетки иммунной системы, которые самостоятельно не могут распознать чужака, однако после такой презентации оказывают более мощное действие на агентов, которые смогли выжить, несмотря на активизацию всех функций врожденного иммунитета; натуральные киллеры способны неспецифически убивать вирусы и опухолевые клетки; эозинофилы в своем составе имеют гранулы с ферментами, которые способны оказывать пагубное воздействие на некоторых возбудителей паразитарных инфекций).
Некоторые из упомянутых факторов действуют постоянно (анатомический), другие же (гуморальный и клеточный) активируются сразу после проникновения возбудителей заболевания в организм. И что бы это ни было — бактерии, вирусы или грибковая инфекция, ответ будет одинаковым — защитная воспалительная реакция. При этом иммунная память не формируется, то есть при повторном попадании аналогичных агентов в организм реакция на них не будет более специфичной или эффективной.
Если все же микроорганизмы проходят 1-ю линию защиты, то в действие вступает приобретенный, адаптивный, специфический иммунитет, который представлен Т- и В-лимфоцитами. Он имеет более сложную и тонкую настройку, осуществляемую в ходе реакций, которые позволяют лимфоцитам узнать более подробную информацию от антигенпрезентирующих клеток (макрофаги, дендроциты) об антигенной структуре чужеродного агента. Это позволяет по принципу самонаводящейся бомбы специфично и целенаправленно, а значит гораздо эффективнее, атаковать конкретного возбудителя, на поверхности которого, как прицельные маячки, находятся эти антигены. Для созревания лимфоцитов необходимо 5–7 дней, в течение которых защита организма обеспечивается врожденным иммунитетом. После этого формируется иммунная память, которая при повторном проникновении возбудителя позволяет сократить время активации специфического иммунитета.
Важность исследований в области иммунологии тяжело переоценить, ведь они позволили лучше понять не только принципы защиты организма, но и способы ее улучшения. Именно поэтому ученые-иммунологи не единожды получали призы, медали, дипломы за свою работу.
Следует отметить, что не стала исключением и премия Альфреда Нобеля, вручаемая в Каролинском институте (Швеция) с 1901 г. Ее обладателями в области медицины и физиологии стали 19 иммунологов. И в этом году, на 110-м оглашении новых лауреатов список награжденных иммунологов пополнился еще тремя учеными: Брюс Бетлер (Bruce A. Beutler), Жюль Хоффман (Jules A. Hoffmann) и Ральф Штейнман (Ralph M. Steinman), которые сделали весомый вклад в понимание механизмов работы иммунной защиты.
О том, каким образом иммунная система обеспечивает выживание организма, защищая его от чужеродных агентов (бактерии, вирусы, грибы и т.д.), было известно достаточно давно. Однако было не понятно, что же служит пусковым механизмом для активации гуморальных и клеточных факторов врожденного иммунитета, что является «глазами» иммунной системы, которые опознают врага и запускают ряд дальнейших реакций, направленные на его уничтожение и выведение из организма? Чарльз Джановей (Charles Janeway) в 1989 г. впервые предположил, что такую функцию выполняют образраспознающие рецепторы (pattern-recognition receptors), расположенные на поверхности клеточных мембран человека. Окончательно ответить на этот вопрос удалось лишь спустя несколько лет.
Так, во время подготовки докторской работы Ж. Хоффман отметил, что при пересадке тканей и органов у кузнечиков не возникало инфекционных заболеваний, несмотря на отсутствие асептических условий. Это озадачило ученого: «Что же помогает насекомым распознавать инфекционных агентов и защищаться от них?». Для дальнейших исследований он заменил кузнечиков на мух Drosophila melanogaster, поскольку их клетки содержат небольшое количество хромосом — всего 4 пары (у человека 23 пары хромосом), что позволяет легко манипулировать структурой их генов и определять последствия этих мутаций. К исследованиям были подключены не только биохимики, биологи, но и генетики. Ученые выявили, что повреждение структуры гена, отвечающего за образование определенных рецепторов на поверхности клеток, приводило к смерти мух от различных инфекций. В 1996 г. Ж. Хоффман пришел к выводу, что данные рецепторы играют важную роль в активации иммунного ответа. Они получили название «toll», которое отражает не только их функции, поскольку в переводе с английского «toll» означает «колокольный звон, благовест», но и восторженную реакцию ученых в ответ на данное открытие: «toll» в немецком языке означает «сногсшибательный, восхитительный». Несколько позже к аналогичному выводу пришел и Б. Бетлер, когда в 1998 г. пытался выявить у мышей рецепторы, взаимодействующие с липолисахаридами (структурными компонентами клеточной стенки грамотрицательных бактерий, ЛПС) и активирующие иммунную защиту. Ими оказались аналогичные структуры клетки — toll-подобные рецепторы (toll-like receptors), которые при взаимодействии с ЛПС инициировали у мышей защитную воспалительную реакцию. Таким образом удалось прийти к выводу, что именно эти рецепторы — «глаза» иммунной системы. Благодаря их наличию активируется 1-я линия иммунной защиты организма. Данные открытия послужили толчком для дальнейшего изучения и выявления аналогичных рецепторов и у человека. Сегодня известно 11 типов toll-подобных рецепторов. Каждый из них распознает определенную иммуногенную (то есть способную вызвать иммунный ответ) частицу возбудителя, получившую название патогенассоциированной молекулярной структуры (pathogen-associated molecular patterns). У грамотрицательных бактерий это, в основном, ЛПС, у грамположительных — тейхоевые и липотейхоевые кислоты, у грибов — зимозан, у вирусов — РНК и т.д. Каждая такая структура характерна для большого количества возбудителей, поэтому процесс их распознавания носит неспецифический характер, что приводит к первоначальной активации механизмов врожденного иммунитета, описанных выше, с дальнейшим развитием воспалительного процесса.
Важно отметить, что повреждение структуры toll-подобных рецепторов приводит к нарушению процесса распознавания патогенассоциированных молекулярных структур и развитию тяжелых инфекционных заболеваний. В то же время повышенная чувствительность рецепторов и их гиперактивация может быть причиной развития хронической воспалительной, аутоиммунной, аллергической патологии.
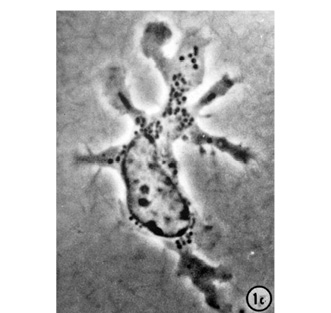
До определенного момента не удавалось ответить еще на один важный вопрос: каков механизм активации адаптивного иммунитета? Ясность удалось внести благодаря работам еще одного нобелевского лауреата — Р. Штейнмана. В 1973 г., изучая макрофаги, он выявил ранее никем не замеченные клетки иммунной системы, которые внешне напоминали дерево с многочисленными ветвями (рис. 1). Потому они получили название дентроциты («dendron» в переводе с греческого означает «дерево»). Проведя серию экспериментов, Р. Штейнман выявил, что они относятся к антигенпрезентирующим клеткам. Процесс презентации происходит таким образом: дендроциты захватывают антигенные структуры (целые клетки, лизаты, белки, РНК и т.д.), специфичные для каждого вида возбудителя, поглощают их путем фагоцитоза, эндоцитоза или пиноцитоза, после чего в результате определенных процессов чужеродные антигены перемещаются (экспрессируются) на поверхность дендроцита. После этого дендроцит, как на маскараде, одевает на себя костюм чужака и в таком виде предстает перед незрелыми лимфоцитами, которые сами по себе не способны в первоначальном виде распознать чужеродные антигены. Однако по принципу «осведомлен — значит вооружен» происходит активация и размножение натуральных киллеров, Т-хелперов, цитотоксических Т-лимфоцитов, В-лимфоцитов, которые могут целенаправленно оказать мощное воздействие на возбудителя, презентованного дендроцитом. Кроме того, активация Т-хелперов, которые отвечают за иммунную память, помогает сохранить информацию о чужеродном агенте и в следующий раз не тратить время на его презентацию и тренировку незрелых лимфоцитов. Благодаря этому при последующем столкновении с возбудителем иммунная система реагирует немедленно и более эффективно предотвращает заболевание (рис. 2).
Открытие дендроцитов послужило толчком для дальнейших исследований их антигенпрезентирующей функции для лечения онкологических заболеваний. Ведь если антигены не инфекционных возбудителей, а опухолевых клеток будут представлены лимфоцитам, возможно, это позволит организму не только распознавать их, но и разрушить, оставив при этом абсолютно нетронутыми здоровые клетки. Ведь это помогло бы избежать разрушающих последствий лучевой и химиотерапии, а также дало бы возможность оказывать влияние на опухоли, удаление которых невозможно из-за их локализации или поздней стадии онкологического процесса.
Антигенпрезентирующий принцип лежит в основе разработок противоопухолевых вакцин. Так, из костного мозга пациента берутся незрелые дендроциты. В лабораторных условиях эти клетки нагружают антигенами опухолевых клеток, после чего в зрелом состоянии возвращают в организм больного. Вероятным результатом этого будет обеспечение достаточной иммуногенности опухолевых антигенов, создание условий для их презентации Т- и В- лимфоцитам и их дальнейшего разрушения, а также элиминации из организма. Кроме того, ученые ведут поиски универсальной вакцины из дендроцитов против широкого спектра опухолей, что позволит иммунной системе быть натренированной в борьбе с различными опухолевыми клетками.
По воле случая Р. Штейнману пришлось самому прибегнуть к лечению, основанному на его же открытии. Он был болен раком поджелудочной железы на протяжении последних 4 лет и благодаря вакцинотерапии смог продлить себе жизнь. Следует отметить, что первая вакцина из дендритов была одобрена Управлением по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration) в апреле 2010 г. для лечения тяжелых форм рака простаты. Что касается рака поджелудочной железы, то для его терапии подобных лекарственных средств не было одобрено, поэтому остается загадкой, при помощи каких препаратов Р. Штейнман проводил лечение.
Традиционно после оглашения лауреатов, учредители связываются по телефону с учеными для короткого интервью. Они пытались связаться и с Р. Штейнманом, однако к нему не удалось дозвониться. А через несколько часов после оглашения результатов стало известно, что 3 днями ранее ученый ушел из жизни. Согласно правилам вручения премии, установленным в 1975 г., она может выдаваться только пожизненно или в качестве наследства потомкам лауреата, если тот умер в период между оглашением результатов и вручением самой премии, которое проводится в Стокгольме в день смерти Альфреда Нобеля — 10 декабря. Взяв за основу это правило, Нобелевским комитетом было решено окончательно присудить премию Р. Штейнману и прибавить ее к наследству молодого поколения Штейнманов.
К счастью, другие лауреаты смогли дать интервью. Интересным является, факт, что получение такой премии всегда является большой неожиданностью. Так, при телефонном разговоре с Адамом Смитом, редакционным директором «Nobel Media», Б. Бетлер сообщил, что узнал о своем награждении среди ночи, прочитав электронное письмо от Горана Хэнссона (Goran Hansson), секретаря Нобелевского комитета по физиологии и медицине. Поверить в написанное ученый смог только после того, как в он-лайн новостях увидел свое имя среди победителей.
Неожиданностью это стало и для Ж. Хоффмана, который в тот момент находился в Китае. О премии он узнал от журналистов, ожидавших его в отеле. Следует отметить, что всего неделей ранее он, Б. Бетлер и российский иммунобиолог Руслан Меджитов за вклад в объяснение механизмов работы иммунной системы получили премию Шо (Shaw prize), которую называют азиатской Нобелевской премией.
Нобелевские лауреаты получат памятные медали с изображением ученого, дипломы и денежную премию, которая в этом году составила 10 млн шведских крон (1,4 млн дол. США).
В заключение хочется отметить, что в мире всегда останется место для новых открытий. И то, что уже известно сегодня, станет основой для будущих открытий. Возможно, в скором времени знания в сфере работы иммунной системы помогут избежать развития онкологических, аутоиммунных, аллергических и других заболеваний.
Факты о Нобелевской премии
- слово «лауреат» (англ. laureate) является сокращением от laurel wreath — лавровый венок. Такой венок украшал голову не только мифического бога Аполлона, но и победителей атлетических и поэтических соревнований в Древней Греции. Сейчас «лауреатами» называют лишь самых достойных;
- впервые выдана в 1901 г., и 2011 г. является юбилейным, ведь исполняется 110 лет с момента оглашения ее первых обладателей;
- выдается в таких номинациях: физика, химия, медицина и физиология, литература, экономика и премия мира;
- вручены 549 премий, которые были присуждены 830 лауреатам и 23 организациям. При этом 102 премии вручены в области медицины и физиологии и разделены между 199 лауреатами;
- выдавалась не каждый год — в области медицины и физиологии не было лауреатов в период I и II мировой войны;
- одна премия может быть разделена максимум между 3 участниками;
- самым молодым лауреатом в области медицины и физиологии стал Фредерик Бантинг (Frederick G.Banting), получивший премию в данной категории в возрасте 32 лет за открытие инсулина. Среди всех победителей самым младшим является Лоуренс Брэгг (Lawrence Bragg), который в 25-летнем возрасте получил премию в области физики;
- самым старшим лауреатом в области медицины и физиологии стал Пэйтон Роус (Peyton Rous), которому была присуждена Нобелевская премия в возрасте 87 лет за открытие онкогенных вирусов. Он всего на 3 года младше Леонида Хурвица (Leonid Hurwicz), получившего премию в области экономики;
- среди 199 лауреатов в области медицины и физиологии всего 10 женщин. При этом неразделенную премию получила лишь Барбара Макклинток (Barbara McClintock). Общее количество женщин-лауреатов — 43.
- самым старшим ныне живущим лауреатом премии является Рита Леви-Монтальчини (Rita Levi-Montalcini), которой 22 апреля 2011 г. исполнилось 102 года. Премию она получила за открытие факторов роста;
- в области медицины и физиологии никто не получал премию более 1 раза;
- согласно правилам, прописанным в 1974 г., премия не может присуждаться посмертно. За всю историю существования премии посмертно она выдавалась всего дважды — в 1931 и 1961 г. Исключение составляют лауреаты, которые умерли в период между оглашением победителей и вручением премии. Такое случилось в 1966 г. с Уиллиамом Викри (William Vickrey) и в текущем — с Р. Штейнманом;
- имена номинантов на премию хранятся в секрете в течение следующих 50 лет;
- Джейн Аддамс (Jane Addams) была номинированна на премию 91 раз в период 1916–1931 гг., и в 1931 г. она все-таки получила премию мира. Что касается лауреатов в области медицины и физиологии, то Фредерик Бантинг (Frederick G.Banting) и Джон Маклеод (John Macleod) в 1923 г. получили премию с первого раза за открытие инсулина, в то время как Роберт Кох (Robert Koсh) был номинирован 55 раз до того, как в 1905 г. стал лауреатом в области медицины и физиологии;
- 3 нобелевских лауреата находились под арестом в момент оглашения их имен;
- были случаи, когда лауреатами становились родственники: супружеские пары, родители и дети, а также родные братья.
по материалам www.nobelprize.com, www.nature.com, www.reuters.com, www.scripps.edu, www.uthouston.edu, www.med.sc.edu

Коментарі