ГЛАВА 4. КАК СДЕЛАТЬ РЕГУЛИРОВАНИЕ ЛЕКАРСТВ ЭФФЕКТИВНЫМ?
Цель и методы регулирования лекарств (РЛ), а также приоритеты, нормы и стандарты, силовые стратегии, доступные ресурсы и применяющиеся санкции в разных странах различны. Однако основные цели РЛ, как правило, совпадают: укрепление и охрана здоровья населения путем обеспечения безопасности, эффективности и качества лекарственных средств (ЛС), а также объективности и точности информации о препаратах. РЛ включает несколько процессов (рис. 1).
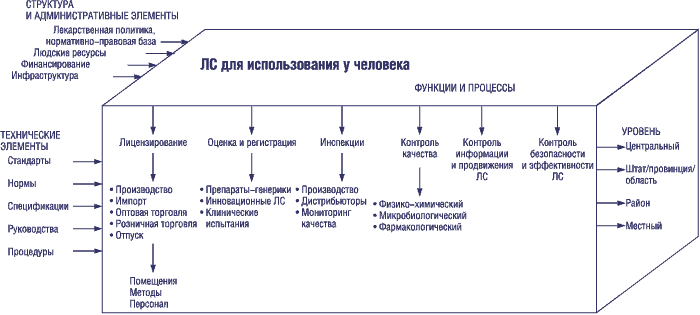 |
Рис. 1. Система измерений регулирования лекарств
Единого стандарта РЛ не существует, но деятельность органа по РЛ будет эффективной, если обеспечен поэтапный подход к выполнению поставленных задач и достижению намеченных целей. Это, в свою очередь, требует, чтобы миссия и задачи, стоящие перед органом по РЛ, были четко сформулированы и задокументированы1.
Орган по РЛ должен:
•?основывать свою решения на научных доказательствах и фактах;
•?выполнять свою работу эффективно и своевременно;
•?обеспечивать разработку действенных и динамичных стратегий, позволяющих принимать и исполнять регуляторные решения;
•?применять обоснованные управленческие принципы;
•?использовать экономически эффективные подходы для достижения целей;
•?быть подотчетным;
•?принять меры против коррупции и конфликта интересов.
Процесс РЛ должен быть прозрачным.
Чтобы сделать эффективными свои системы РЛ, страны должны, как минимум, принять ряд мер, описанных ниже.
4.1. ОЦЕНКА ДЕЯТЕЛЬНОСТИ ПО РЕГУЛИРОВАНИЮ ЛЕКАРСТВ
В настоящее время многие страны, в особенности развивающиеся, стремятся к либерализации своих экономических систем. Часто это проявляется в реорганизации сектора здравоохранения (приватизационные процессы в сфере фармацевтического производства, импорта и дистрибьюции ЛС, децентрализация управления) и ослаблении регуляторной роли государства. В фармацевтическом секторе такие изменения создают предпосылки для расширения производства и торговли ЛС и в то же время ослабляют РЛ.
Опыт подсказывает, что недостаточное РЛ может привести к засилью субстандартных и поддельных ЛС как на национальных, так и на международном рынке. Таким образом может быть нанесен серьезный ущерб состоянию здоровья как отдельных потребителей, так и целых групп населения. Поэтому при увеличении объемов внутреннего производства, импорта, расширения дистрибьюторской сети следует усиливать ключевые направления РЛ и повышать ответственность за обеспечение безопасности, качества и эффективности ЛС, за предоставление объективной и достоверной информации о них.
В условиях перемен странам особенно необходимо оценить выполнение задач по РЛ с помощью индикаторов, которые характеризуют структуру и затраты, процесс и результаты РЛ (рис. 2). Также следует оценить преимущества и недостатки национального РЛ, выяснить, чем они обусловлены, рассмотреть возможность использования альтернативных регуляторных подходов и выбрать из них наиболее приемлемые и действенные. Для решения этих проблем рекомендуется создать такую структуру, которая позволяла бы организовывать дискуссии в отношении элементов РЛ, обеспечивать проведение экспертизы этих элементов, учитывать максимально широкий спектр мнений о том, какой должна быть политика государства в отношении ЛС. Приведенная ниже примерная схема является одним из результатов исследования ВОЗ, в ходе которого анализировали РЛ во многих странах.
Рис. 2. Модель оценки регулирования лекарств
ПРИМЕРНАЯ СХЕМА ДЛЯ ОЦЕНКИ РЕГУЛИРОВАНИЯ ЛЕКАРСТВ
Во многих странах РЛ неэффективно, лишь немногим из них удалось добиться дееспособности национальных регуляторных систем, и этот факт требует объяснения. В связи с этим ВОЗ предприняла исследование с участием ряда стран, в ходе которого будет проанализирован их опыт в сфере РЛ, в частности, определены преимущества и недостатки национальных систем регулирования. По окончании исследования ВОЗ представит на рассмотрение политикам и ответственным за РЛ лицам ряд эффективных регуляторных стратегий2.
В ходе исследования ВОЗ для сбора информации о различных аспектах национальных систем РЛ были использованы блоки вопросов. Собранные воедино, эти вопросы представляют собой примерную схему для оценки структуры, процесса и результатов РЛ в отдельно взятой стране.
БЛОК 1. ОЦЕНКА ВНЕШНИХ УСЛОВИЙ ДЛЯ РЕГУЛИРОВАНИЯ ЛЕКАРСТВ
Цель: проанализировав политическую и социально-экономическую ситуацию в стране, установить, является ли она благоприятной для осуществления РЛ.
•?Является ли для государственной политики экономическая выгода от ЛС приоритетной по сравнению с их социальным значением?
•?Принят ли в стране закон о свободе информации?
•?Действует ли в стране свобода объединений?
•?Признает ли правительство необходимость в подотчетности?
•?Поощряет ли правительство прозрачность?
•?Внедряет ли правительство механизмы рассмотрения жалоб и осуществляется ли надзор со стороны общественности в сфере РЛ?
БЛОК 2. ОЦЕНКА РЕГУЛЯТОРНЫХ И СИЛОВЫХ СТРАТЕГИЙ
Регуляторные стратегии
• Осуществляют ли органы по РЛ свои функции согласно документально оформленным стратегиям?
•?Делегируют ли органы по РЛ свои регуляторные функции другим общественным организациям, профессиональным ассоциациям или промышленности?
•?Участвуют ли группы потребителей, общественные организации и т.д. в регуляторной деятельности? Работают ли они на законном основании? Есть ли у них устав?
Силовые стратегии
•?Какие из нижеперечисленных методов используются при РЛ:
1. Убеждение?
2. Взыскание?
3. Юридические санкции?
4. Денежные штрафы?
5. Административные меры, например письменные предупреждения о правовых последствиях?
•?Применяются ли меры социального воздействия? Например со стороны:
1. Групп лиц равного социального статуса.
2. Потребителей.
3. Организаций по защите общественных интересов.
•?Используются ли для достижения целей РЛ следующие стратегии:
1. «Примерные наказания» за нарушение требований, например: в виде публикации «негативных данных» (в которых указывают название компании, аптеки или отдельных лиц, которые нарушили требования) или частных проверок;
2. Стимулирование соблюдения требований, например сокращение размера сборов или выдача свидетельств о соблюдении требований.
3. Обеспечение добровольного соблюдения требований или саморегулирования.
БЛОК 3. СТРУКТУРА РЕГУЛИРОВАНИЯ ЛЕКАРСТВ
Анализ действующего законодательства о ЛС и определение его недостатков
• Какова миссия РЛ? Задокументирована ли эта миссия?
•?Является ли действующее законодательство о ЛС исчерпывающим?
•?Определены ли в законодательстве области, подлежащие регулированию?
•?Определены ли в законодательстве функции, обязанности и полномочия заинтересованных сторон?
•?Адекватны ли нормативные документы о ЛС, нормы, стандарты и процедуры?
•?Оговорены ли в законодательстве случаи, требующие применения уголовных и/или административных наказаний?
•?Обязаны ли органы по РЛ согласно законодательству предоставлять информацию населению?
Анализ организационной структуры и определение ее недостатков
• Является ли правительственный орган по РЛ федеральным, региональным/областным (штата/провинции) или местным?
•?Полностью ли орган по РЛ подотчетен правительству?
•?Позволяет ли структура органа по РЛ принимать решения независимо?
•?Обеспечивает ли структура органа по РЛ его самостоятельность в решении как финансовых, так и в кадровых вопросов?
•?Распределены ли ответственность, обязанности и полномочия в соответствии с письменными инструкциями и действующим законодательством о ЛС?
•?Четко ли определены структурные и функциональные взаимосвязи различных организаций, участвующих в РЛ?
•?Разработаны ли должностные обязанности персонала?
•?Вовлечен ли частный сектор в регуляторную деятельность? Если да, то отражено ли это участие в действующем законодательстве? Подотчетны ли соответствующие стороны и должны ли подавать отчеты?
•?Действуют ли механизмы планирования, мониторинга, оценки и отчетности?
•?Каковы основные недостатки организации и структуры РЛ? Каковы причины этого?
Оценка наличия и качества людских ресурсов; определение препятствий для внедрения регулирования лекарств
•?Достаточен ли штат сотрудников?
•?Имеет ли персонал достаточную квалификацию (знания и навыки) для полноценного выполнения своих служебных обязанностей?
•?Верят ли сотрудники в достижимость целей РЛ?
•?Мотивирован ли персонал для выполнения своей работы?
•?Существует ли система кадрового роста?
•?Сопоставима ли зарплата сотрудников с той, которую получают специалисты аналогичной квалификации в частном секторе?
•?Каковы основные препятствия в отношении наличия кадровых ресурсов? Каковы их причины?
Оценка механизмов финансирования и определение основных препятствий при внедрении регулирования лекарств
•?Как финансируется РЛ?
•?Выделяются ли ассигнования на РЛ отдельной строкой в государственном бюджете?
•?Имеются ли проблемы с обеспечением непрерывного финансирования?
•?Прописаны ли в действующем законодательстве условия для сбора оплаты за услуги?
•?Взимают ли плату за услуги?
•?Разрешено ли органам по РЛ использовать эти финансовые средства?
•?Каковы основные трудности с финансированием?
Наличие других ресурсов
•?Постоянно ли доступны ресурсы, необходимые для осуществления РЛ (транспортные средства, лабораторное оборудование и расходные материалы и др.)? В каком они состоянии? Действует ли система технического обслуживания?
•?Достаточно ли помещений?
Доступность, ясность и прозрачность процедур и руководящих положений
•?Все ли процедуры, руководящие положения и инструкции, используемые в РЛ, документируются?
•?Публикуются ли они, доводятся ли до всех заинтересованных сторон?
•?Публикуются и доводятся ли до ведома всех заинтересованных сторон решения, принимаемые органом по РЛ? Доводятся ли эти решения до заинтересованных сторон только по их запросу?
БЛОК 4. ПРОЦЕСС РЕГУЛИРОВАНИЯ ЛЕКАРСТВ
Система лицензирования: критическая оценка деятельности и ведения документации
• Внедрена ли система лицензирования? Действует ли она под контролем органа по РЛ?
•?Охватывает ли система лицензирования как общественный, так и частный фармацевтический сектор?
•?Какие виды лицензий выдаются?
•?Какой орган уполномочен выдавать лицензии?
•?Какие условия должны быть выполнены для получения лицензии?
•?Какой уровень квалификации должны иметь фармацевты, а также специалисты, работающие в организациях, занимающихся производством, импортом, оптовой и розничной реализацией ЛС?
•?Как лицензирующий орган взаимосвязан с другими органами, участвующими в РЛ?
•?Взимается ли плата за выдачу и возобновление (продление) лицензий?
•?Сколько существует видов лицензируемых фармацевтических организаций и сколько организаций каждого вида?
•?Доступен ли перечень лицензированных фармацевтических организаций и персонала?
Инспекции и надзор: критическая оценка деятельности и ведения документации
•?Внедрена ли система инспекций (инспекторат) в отношении ЛС?
•?Осуществляет ли инспекторат проверки соответствия производства требованиям надлежащей производственной практики (good manufacturing practice — GMP), инспектируются ли каналы дистрибьюции?
•?Сколько инспекторов в стране проводят инспекции по GMP? Какое количество инспекторов осуществляют проверку дистрибьюторской сети в стране?
•?Какова взаимосвязь инспекторов и других органов, участвующих в РЛ?
•?Проводятся ли инспекции по GMP централизованно?
•?Проводятся ли инспекции дистрибьюторских каналов децентрализованно? Действуют ли механизмы отчетности между разными уровнями?
•?Имеются ли в распоряжении инспекторов по GMP руководства и практические пособия? Имеются ли в распоряжении инспекторов дистрибьюторских каналов руководства и практические пособия?
•?Являются ли инспектора квалифицированными специалистами? Проходят ли они специальные курсы обучения по проведению инспекций?
•?Проводится ли внешний и/или внутренний аудит и осуществляется ли контроль за выполнением инспекторами и/или инспекторатом своих обязанностей?
•?Осуществляет ли инспекторат какие-либо из перечисленных видов инспекций:
1. Всесторонние/текущие.
2. Повторные.
3. В связи с поступившими жалобами.
•?Как часто проводятся текущие инспекции?
•?Действует ли система оплаты за проведение инспекций?
•?Отбирают ли инспектора образцы ЛС в ходе инспекций по GMP, инспекций дистрибьюторских каналов или при осуществлении постмаркетингового контроля качества?
•?Какое количество (%) образцов ЛС ежегодно было признано неудовлетворительным за последние пять лет? Каков средний процент несоответствующих образцов?
•?Какие санкции применялись в связи с выявлением ЛС, не соответствующих стандартам?
•?Разработаны ли процедуры, применяемые по итогам рассмотрения апелляций, поданных в связи с применением инспекторами штрафных санкций?
•?Производится ли ротация инспекторов в целях предотвращения коррупции? Проводят ли инспекторы групповые проверки?
•?Доступны ли результаты инспекционных проверок для заинтересованных сторон и для общественности?
Оценка и регистрация препаратов: критическая оценка деятельности и ведения документации
•?Внедрена ли система текущей оценки и регистрации ЛС?
•?Существует ли стандартная форма заявки на регистрацию?
•?Осуществляется ли регистрация ЛС местного производства? Осуществляется ли регистрация ЛС, импортируемых государственным сектором?
•?Какая информация и доказательства должны быть предоставлены при подаче заявки на регистрацию:
1. Препарата, содержащего новые активные фармацевтические ингредиенты.
2. Препарата-генерика.
3. Препарата, подлежащего ускоренной процедуре регистрации3.
•?Используется ли форма «Сертификата фармацевтического препарата», аналогичная рекомендованной ВОЗ?
•?Руководствуется ли персонал регистрирующих органов стандартными рабочими методиками?
•?Задокументированы ли критерии (основания для разрешения или отказа) оценки и регистрации ЛС?
•?Оценка заявок проводится:
1. Только штатными сотрудниками?
2. Комиссиями, состоящими из внешних экспертов?
•?Делегируются ли (или передаются согласно договору) какие-либо функции по оценке ЛС:
1. Другим государственным организациям?
2. Отдельным специалистам?
3. Частным организациям?
•?Кто принимает окончательное решение в отношении регистрации ЛС?
•?На протяжении какого времени действительна регистрация препарата?
•?Сколько времени в среднем длится процесс регистрации:
1. Препарата, содержащего новый активный фармацевтический ингредиент?
2. Препарата-генерика?
3. Препарата, подлежащего ускоренной процедуре регистрации?
•?Существуют ли временные ограничения для прохождения заявки через регистрирующий орган?
•?Существует ли апелляционный орган?
•?Сколько апелляций в год было подано в течение последних пяти лет? Сколько решений было пересмотрено в связи с апелляциями?
•?Компьютеризирован ли процесс регистрации ЛС?
•?Регулярно ли регистрирующий орган публикует и обновляет списки зарегистрированных ЛС?
•?Участвуют ли в процессе оценки и регистрации представители:
1. Фармацевтической промышленности.
2. Организаций потребителей и пациентов.
•?Взимается ли плата за проведение оценки и регистрации ЛС?
•?Сколько заявок подавалось и рассматривалось ежегодно в течение последних пяти лет:
1. На новую регистрацию?
2. На внесение изменений?
3. На возобновление регистрации?
4. Другие?
•?Сколько заявок и каких видов отклонялось ежегодно в течение последних пяти лет?
•?Выдаются ли сертификаты, рекомендуемые ВОЗ для экспортируемых препаратов? Сколько таких сертификатов выдавалось ежегодно в течение последних пяти лет?
•?Каковы основные недостатки оценки и регистрации ЛС? Каковы их причины?
БЛОК 5. МОНИТОРИНГ ПОБОЧНЫХ РЕАКЦИЙ
•?Внедрена ли система мониторинга побочных реакций (ПР) на ЛС?
•?Если «да», то является она обязательной или добровольной?
•?Сколько сообщений о ПР на ЛС фиксировалось ежегодно на протяжении последних пяти лет?
•?Каким образом поступают с сообщениями о ПР на ЛС? Каким образом и кому они передаются внутри страны и за ее пределами?
•?Принимаются ли на основании сообщений о ПР на ЛС какие-либо решения?
•?Сколько решений было принято на основании сообщений о ПР на ЛС? Каков характер этих решений?
•?Должны ли производители/импортеры ЛС осуществлять мониторинг ПР, вызванных применением выпускаемых/поставляемых ими препаратов?
БЛОК 6. КЛИНИЧЕСКИЕ ИСПЫТАНИЯ
•?Предусмотрено ли в законодательстве о ЛС осуществление контроля за клиническими испытаниями (КИ), которые проводятся в стране?
•?Если «да», то какой орган уполномочен осуществлять контроль за КИ?
•?Сколько заявлений о проведении КИ поступало ежегодно на протяжении последних пяти лет?
•?Имеются ли руководства по проведению КИ?
•?Если «да», то согласуются ли они с:
1. Хельсинкской декларацией?
2. Руководством ВОЗ по надлежащей клинической практике (good clinical practice — GCP)?
•?Проводятся ли КИ под наблюдением этического комитета?
•?Существует ли специальная процедура, разрешающая импорт ЛС, предназначенных для проведения КИ?
БЛОК 7. КОНТРОЛЬ ПРОДВИЖЕНИЯ И РЕКЛАМЫ
•?Если разработана нормативно-правовая база для контроля за продвижением ЛС, то согласуется ли она с этическими критериями продвижения лекарств ВОЗ?
•?Осуществляется ли контроль за продвижением и рекламой лекарств?
•?Существуют ли правовые нормы для контроля за продвижением и рекламой ЛС?
•?Предусмотрены ли в законодательстве о ЛС какие-либо ограничения в отношении контроля за продвижением и/или рекламой ЛС?
•?Какой орган осуществляет контроль за продвижением/рекламой?
•?Требуется ли получать предварительное разрешение на промоционные и рекламные материалы?
•?Если «да», то взимается ли за разрешение плата?
•?Как осуществляется мониторинг продвижения/рекламы?
•?Утверждается ли во время процедуры регистрации ЛС текст информационного листка-вкладыша и инструкция для медицинского применения препарата?
•?Утверждаются ли в ходе регистрации листок-вкладыш для пациента и маркировка?
•?Применяются ли санкции в случае нарушения законов об информации о препаратах и их продвижении? А именно:
1. Сколько нарушений законов и норм, касающихся продвижения ЛС, фиксировалось ежегодно на протяжении последних пяти лет?
2. В связи с этим сколько случаев применения санкций фиксировалось ежегодно на протяжении последних пяти лет?
3. Сколько случаев привлечения к административной ответственности фиксировалось ежегодно на протяжении последних пяти лет?
•?Существуют ли ассоциации фармацевтических производственных и других компаний, занимающиеся саморегулированием?
•?Предоставляют ли органы по РЛ независимую информацию о ЛС врачам, аптечным работникам и конечным потребителям?
•?Каким образом конечные потребители и врачи получают информацию о вновь зарегистрированных препаратах?
•?Существуют ли механизмы, позволяющие предотвращать попадание ложных утверждений медицинского характера в рекламные материалы о ЛС?
•?Участвуют ли частные организации и группы потребителей в осуществлении контроля за продвижением/рекламой ЛС?
•?Если «да», то имеют ли они устав?
•?Обладают ли они правом применять санкции?
•?Каковы основные препятствия для осуществления контроля за продвижением и рекламой ЛС? Каковы причины их возникновения?
БЛОК 8. ИНДИКАТОРЫ РЕЗУЛЬТАТОВ
Лицензирование (количество лицензий по годам на протяжении последних пяти лет):
•?Сколько производителей (из общего количества фармацевтических производителей в стране) получили лицензии?
•?Сколько компаний, импортирующих ЛС (из общего количества фармацевтических импортирующих организаций в стране), получили лицензии?
•?Сколько компаний по оптовой торговле ЛС (из общего количества дистрибьюторов фармацевтической продукции в стране) получили лицензии?
•?Сколько аптечных торговых точек (из общего количества аптечных торговых точек в стране) получили лицензии на розничную торговлю ЛС?
Инспекции по GMP (количество инспекций по годам на протяжении последних пяти лет):
•?Сколько текущих или плановых инспекций по GMP (из общего количества текущих или плановых инспекций по стране) было проведено?
•?Сколько фармацевтических производственных предприятий (из общего количества лицензированных фармацевтических производственных предприятий в стране) было проинспектировано?
•?Каково количество фармацевтических заводов (из общего количества лицензированных фармацевтических заводов в стране, прошедших инспекцию), на которых были зафиксированы нарушения?
•?Сколько фармацевтических производственных предприятий (из общего количества лицензированных фармацевтических заводов в стране) получили сертификаты GMP?
Инспекции дистрибьюторских компаний (ежегодно на протяжении последних пяти лет):
•?Сколько фармацевтических дистрибьюторских компаний (из общего количества лицензированных фармацевтических дистрибьюторских компаний в стране) было проинспектировано?
•?Сколько плановых инспекций фармацевтических дистрибьюторских компаний (из общего количества инспекций по стране) было проведено?
•?Каково количество фармацевтических дистрибьюторских компаний (из общего количества лицензированных фармацевтических дистрибьюторских компаний в стране, прошедших инспекцию), в которых были зафиксированы нарушения?
•?Сколько образцов ЛС (из общего запланированного для отбора количества образцов) было отобрано?
•?Каково число фармацевтических дистрибьюторских компаний (из общего количества лицензированных фармацевтических дистрибьюторов в стране), нарушавших регуляторные требования?
•?Сколько выявлено препаратов (из общего количества отобранных образцов) с истекшим сроком годности?
Оценка и регистрация препаратов
•?Сколько препаратов (из общего числа ЛС, подлежащих регистрации в стране) зарегистрировано?
•?Сколько препаратов из числа зарегистрированных (из общего числа ЛС, имеющих действующую регистрацию в стране, за исключением витаминов) содержат более трех активных ингредиентов?
•?Сколько заявок о регистрации в настоящее время ожидают прохождения процедуры оценки и регистрации?
Контроль за продвижением и рекламой лекарств (по годам на протяжении последних пяти лет):
•?Сколько случаев рекламы и продвижения ЛС, не соответствующих действующим требованиям (из общего количества рекламных и промоционных мероприятий, отслеженных в ходе мониторинга), было зафиксировано?
•?Сколько раз сведения, указанные на упаковках и в информационных листках-вкладышах, не соответствовали информации, которая была одобрена в ходе регистрации (из общего количества упаковок и информационных листков-вкладышей, отслеженных в ходе мониторинга)?
Контроль качества (по годам на протяжении последних пяти лет):
•?Сколько образцов ЛС (из общего количества отобранных образцов) было проанализировано?
•?Сколько образцов ЛС (из общего количества проанализированных образцов) были признаны неудовлетворительными в ходе проведения тестовых испытаний качества?
Продолжение в следующих номерах «Еженедельника АПТЕКА»
* Продолжение. Начало см. «Еженедельник АПТЕКА», № 14 (385) от 14 апреля, № 16–17 (387–388) от 29 апреля 2003 г.
1 См. также «Еженедельник АПТЕКА», № 49 (370) от 16 декабря 2002 г. Как разработать и внедрить национальную лекарственную политику: рекомендации ВОЗ. Перевод издательства «Морион» под общей редакцией С.В. Сура (How to develop and implement a national drug policy. — 2nd ed. Geneva, World Health Organization, 2001). Глава 8. Регулирование лекарственных средств. http://www.apteka.ua/archives/370/18497.html. — Прим. ред.
2 В настоящее время исследование ВОЗ с участием ряда стран завершено, его результаты опубликованы: Ratanawijitrasin S., Wondemagegnehu E. Effective drug regulation. A multicountry study. Geneva, World Health Organization 2002. Документ также доступен на официальном веб-сайте ВОЗ: . — Прим. ред.
3 Например, в случае заболевания, представляющего серьезную проблему для общественного здравоохранения, уполномоченный орган по РЛ может смягчить требования, предъявляемые к препарату, чтобы как можно быстрее сделать его доступным для потребителя.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим