Следует сразу отметить, что определение бактериального, вирусного или грибкового патогена в качестве причинного фактора на практике затруднено и требует тщательного анализа, поэтому к принятию решений в условиях стационара рекомендуют привлекать многопрофильную команду (аntimicrobial stewardship (AMS) team), состоящую из клиницистов, микробиологов и фармацевтов) (Townsend L. et al., 2020).
Относительно бактериальных коинфекций при COVID-19 приходим к двум основным выводам. Поводом для оптимизма является то, что SARS-CoV-2 сравнительно нечасто, возможно, реже, чем грипп, сопровождается вторичной бактериальной инфекцией. Поэтому у амбулаторных больных без повышенного риска развития бактериальных осложнений от назначения антибиотиков следует воздерживаться. В противном случае в качестве первого выбора следует отдать предпочтение таким препаратам, как доксициклин и амоксициллин, а не «защищенным» пенициллинам, цефалоспоринам III поколения или, к примеру, фторхинолонам. Напротив, серьезную обеспокоенность вызывает повышенная частота госпитализаций в связи с пневмонией. При этом даже в период пандемии COVID-19 на не связанные с этим возбудителем случаи приходится значительная часть от их общего числа. Предотвращение нозокомиальных инфекций становится одной из ведущих задач в связи с увеличением потребности в медицинской помощи.
По обобщенным данным, 62 из 806 (8%) пациентов с COVID-19 столкнулись с сочетанной бактериальной/грибковой инфекцией во время госпитализации; при этом выявили распространенное (1450 из 2010 (72%)) использование антибактериальных средств широкого спектра действия, несмотря на недостаточность доказательств бактериальной коинфекции (Rawson T.M., 2020). В другом исследовании антибактериальную терапию получали 72% пациентов с COVID-19, тогда как респираторные патогены выявили только у 6% (Townsend L. et al., 2020). В то же время именно на вторичную бактериальную пневмонию приходится подавляющее большинство смертей у COVID-19-положительных пациентов с пневмонией (Sharov K.S., 2020).
Существуют данные о значительной распространенности бактериальных коинфекций при прочих респираторных вирусных заболеваниях. Так, во время пандемии 2009 г. в каждом четвертом из тяжелых или смертельных случаев гриппа A (H1N1) pdm09 была идентифицирована бактериальная инфекция, которая явно ассоциировалась с тяжелым течением и смертностью (Joseph C et al., 2013; MacIntyre C.R. et al., 2018). Сообщалось, что чаще всего при этом выявляют бактерии, которые обычно колонизируют носоглотку, например, Streptococcus pneumoniae, Staphylococcus aureus, Streptococcus pyogenes и Haemophilus influenzae, в то же время вторичная инфекция обычно возникает в первые 6 дней заболевания. Legionella pneumophila, менее распространенная бактерия, также фигурирует среди представителей присоединившейся бактериальной флоры. Например, в Италии ее выявляли почти у каждого 5-го из 21% госпитализированных с подтвержденной инфекцией гриппа A (H1N1) в сочетании с бактериальной инфекцией (Rizzo C. et al., 2010).
Поэтому, к примеру, британское руководство по лечению негоспитальных пневмоний у пациентов с COVID-19 рекомендует рассмотреть назначение антибактериальных препаратов у больных с вероятной бактериальной инфекцией, если симптомы вызывают беспокойство, или существует высокий риск осложнений (NICE, 2020). При этом предостерегают от рутинного назначения двух антибиотиков, и в качестве первого выбора называют доксициклин (200 мг в первые сутки, затем по 100 мг 1 раз в сутки в течение 4 дней (всего 5 дней), поскольку он имеет более широкий спектр действия, чем амоксициллин, особенно в отношении Mycoplasma pneumoniae и Staphylococcus aureus, которые с большей вероятностью являются вторичными бактериальными причинами пневмонии во время пандемии COVID-19. Альтернатива: амоксициллин по 500 мг 3 раза в сутки в течение 5 дней.
Систематический обзор: коинфекция у 7%
Систематический обзор по данной теме опубликован онлайн в мае и потому может считаться небольшим «срезом» ситуации (преимущественно в Китае) первой волны (Lansbury L. et al., 2020). Британские авторы включили в анализ пациентов всех возрастов, у которых диагностировали COVID-19 в любых условиях. Основным результатом была доля пациентов с сочетанной бактериальной, грибковой или вирусной инфекцией.
В обзор включили 30 исследований с участием 3834 пациентов. В целом сопутствующую бактериальную инфекцию отмечали у 7% госпитализированных с COVID-19 (95% доверительный интервал (ДИ) 3–12%, n = 2183). Среди лечившихся в отделениях интенсивной терапии таковых было больше (14%, 95% ДИ 5–26, против 4%, 95% ДИ 1–9). Самыми распространенными бактериями были Mycoplasma pneumonia, Pseudomonas aeruginosa и Haemophilus influenzae. Суммарная доля больных с сопутствующей вирусной инфекцией составила 3% (95% ДИ 1-6, n = 1014), при этом преобладали респираторно-синцитиальный вирус и грипп А. В трех исследованиях сообщалось о сопутствующих грибковых инфекциях.
В ходе восьми исследований не дифференцировали патогены, участвовавшие в сочетанной с COVID-19 инфекции, и, взятые в отдельности, они свидетельствовали о большей (по сравнению с указанной выше) доле (12%) коинфекций среди госпитализированных пациентов. Однако, когда из анализа исключили исследование, в котором о наличии бактериальных патогенов судили только по биомаркерам воспаления, данный показатель сравнялся с таковым в исследованиях с идентифицированными возбудителями (7%).
Конкретные сопутствующие бактериальные патогены были выявлены в 17 исследованиях, причем наиболее частым была Mycoplasma pneumoniae (42% из 27), за ней следовали Pseudomonas aeruginosa (12%, включая одного пациента с бактериемией) и Haemophilus influenzae (12%). Klebsiella pneumoniae была изолирована от четырех пациентов, включая изолят, устойчивый к карбапенему, от одного пациента с внутрибольничной пневмонией (ВБП) и бактериемией, и положительный на бета-лактамазу расширенного спектра изолят от другого пациента с ВБП (рис. 1). В трех исследованиях были идентифицированы, в том числе в мочевыводящих путях, четыре грибковых патогена (родов Candida и Aspergillus).
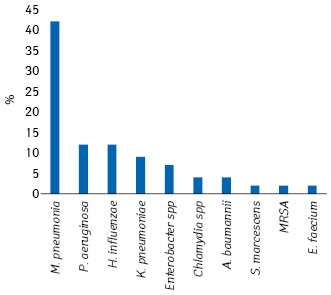
Вирусные сопутствующие респираторные патогены были идентифицированы в 14 исследованиях. При этом респираторно-синцитиальный вирус был наиболее распространенным респираторным вирусом (16,9% выявлений), за ним следовал грипп типа A (15,5%) (рис. 2).
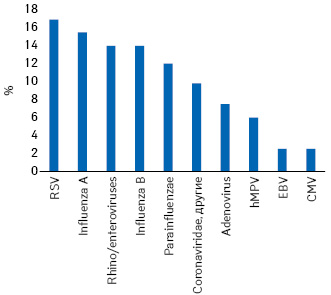
Выявив меньшую распространенность сочетанных бактериальных инфекций при COVID-19, чем при предыдущей пандемии гриппа, авторы заключили, что необходимо отказаться от эмпирической антибактериальной терапии при инфекции SARS-CoV-2.
Сравнение пациентов с COVID-19 и гриппом
Другие авторы, также из Великобритании, проанализировали данные 836 пациентов с пневмонией, вызванной SARS-CoV-2, из двух больниц своей страны. Для сравнения они взяли когорту из 216 пациентов с гриппозной пневмонией, лечившихся там же в прошлом сезоне гриппа (Hughes S. et al., 2020). Среди пациентов с COVID-19 бактериальные изоляты при посевах крови были выделены у 3,2% (27/836) в течение 0–5 дней после поступления, тогда как в течение всего времени пребывания — у 6,1% (51/836). В том числе истинная бактериемия была выявлена у 21 (3,2%) из 643 пациентов с COVID-19, кровь которых исследовали бактериологически, а контаминация — у 39 (6,1%). При этом, только у двоих бактериемия была вызвана респираторной инфекцией (Klebsiella pneumoniae и Enterobacter cloacae). В группе сравнения с гриппозной инфекцией истинная бактериемия была выявлена у двоих (1,5%), а контаминация — у 6 (4,5%). При этом между группами пациентов не было статистически значимой разницы ни в частоте истинных бактериемий (p=0,285), ни контаминантов (p=0,547). Выявив высокую частоту контаминации лабораторных образцов, авторы обращают внимание на ненадлежащее использование средств персональной защиты медицинским персоналом при выполнении анализов крови.
Тестирование (антигены в моче) на сопутствующие инфекции гриппа, Streptococcus pneumoniae, респираторно-синцитиальный вирус и легионеллез входит в стандартные британские алгоритмы ведения больных с негоспитальной пневмонией. Но ни среди пациентов с подтвержденным SARS-CoV-2, ни с гриппом (в течение зимнего сезона 2019–2020 гг.) указанные инфекции (кроме гриппа во втором случае) выявлены не были. Значимость бактериологического анализа мокроты при пневмонии оценивается авторами как невысокая, требующая критической оценки. Так, далеко не каждому больному выполнили данное исследование, при этом наличие микрофлоры выявили у каждого третьего, но по большей части не руководствовались этим при выборе терапии. В целом авторы пришли к выводу о низкой частоте микробиологически подтвержденной бактериальной коинфекции у пациентов с подтвержденным SARS-CoV-2, поступивших для оказания вторичной помощи в городских условиях Великобритании (Hughes S. et al., 2020).
Причинный фактор или свидетель?
Без бронхоскопии (с последующей лабораторной диагностикой), выполнение которой при COVID-19 часто нежелательно по эпидемиологическим соображениям, очень трудно выносить заключение о причинной связи в отношении выявляемых в верхних дыхательных путях микроорганизмов. Затрудняет задачу выяснение причины и невыполнение бактериологических исследований.
Так, с 8 по 15 февраля в одном из городов провинции Хубэй (Китай) по данным рентгенологического и томографического исследований, а также анализам крови пневмония была диагностирована у 2216 пациентов. Среди них методом полимеразной цепной реакции (ПЦР) выявлено 292 COVID-19-положительных и 1924 COVID-19-отрицательных больных пневмонией. В этом исследовании 194 случая (47,78%) были выбраны случайным образом из 292 положительных случаев и 212 случаев (52,22%) — из 1924 отрицательных случайным образом. В общей сложности у 50% пациентов, инфицированных COVID-19, по данным ПЦР в режиме реального времени, отмечали коинфекцию или они были носителями 1 бактериального патогена, а 8,25% — 2 или 3 видов бактериальных патогенов. Частота коинфекции или наличия 2 видов бактериальных патогенов у пациентов с отрицательным результатом на COVID-19 была значительно выше, чем у COVID-19-положительных больных. В частности, выявлены Chlamydia pneumonia, Streptococcus pneumonia, Bordetella pertussis, Streptococcus pyogenes, Staphylococcus aureus, Corynebacterium diphtheria, L. pneumophila, M. pneumonia, Mycobacterium tuberculosis, Neisseria meningitides, Haemophilus influenza, Streptococcus agalactiae, Pseudomonas aeruginosa, и Moraxella catarrhalis (рис. 3).
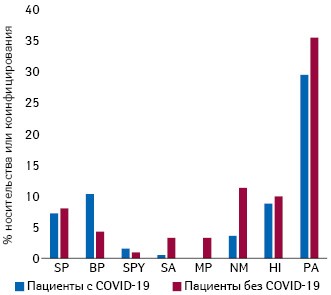
Выявление антител (IgM) респираторных патогенов не может считаться достаточно достоверным признаком причинности, хотя из 250 госпитализированных пациентов с COVID-19, у 39 (15,6%) отмечали положительный результат как минимум на один респираторный патоген в дополнение к SARS-CoV-2 (Ma L. et al., 2020).
Слабопатогенный SARS-CoV-2 «открывает ворота» бактериям?
На основании данных из Российской Федерации, полученных с марта по май 2020 г., в амбулаторных и госпитальных условиях, исследователи выражают особую обеспокоенность в связи с госпитальными инфекциями (Sharov K.S., 2020). Действительно, стационарное лечение, которому во время пандемии подвергают гораздо большее, чем обычно, количество пациентов, накладывает особый отпечаток на эпидемиологическую ситуацию.
Трехкратному взятию назофарингеальных мазков, образцов бронхоальвеолярного лаважа (БАЛ), крови и мочи подвергнуты все 3382 амбулаторных и госпитальных пациента с пневмонией различной этиологии. Кроме того, у 1204 стационарных больных с пневмонией и подтвержденным COVID-19 трижды за время пребывания в больнице взяты назофарингеальные мазки (каждый — двукратно с 12-часовым интервалом, то есть всего по 6 мазков) и образцы мокроты/БАЛ. Бактериологические исследования по выявлению патогенов, являющихся причиной заболевания, подтверждали анализами на биохимию и/или антигены в крови и моче.
Выявлено, что в 1-й группе пациентов позитивными на SARS-CoV-2 были только 147 из 3382 случаев пневмонии (4,35%). У большинства больных пневмонией, 1790 из 3382 человек (52,92%) отмечали типичную бактериальную и атипичную пневмонию. У немного меньшего количества больных, 1379 из 3382 (40,77%), выявляли положительный результат на различные возбудители ОРВИ, при этом максимальный вклад в общую картину пневмонии составил 314 образцов (9,28%) гриппа А. Это количество более чем в 2 раза больше по сравнению с количеством пневмоний, связанных с SARS-CoV-2. Четыре распространенных коронавируса в сезонной циркуляции (HCoV-HKU1, HCoV-OC43, HCoV-229E и HCoV-NL63) составили 298 случаев пневмонии, что также значительно превышает количество пневмоний, связанных с SARS-CoV-2, в Set 1. Преобладали пациенты со Streptococcus pneumonia, Haemophilus influenza и Staphylococcus aureus в качестве единственного возбудителя.
Из 1204 пациентов с COVID-19 у 433 (35,96%) отмечали положительный результат на различные бактериальные этиологические агенты. Вполне вероятно, что ситуацию у этих 433 пациентов следует понимать как случаи вторичной бактериальной пневмонии, осложнение заболевания COVID-19, а не только как сопутствующие бактериальные инфекции. Пневмонии были как внебольничными, так и внутрибольничными (239 из 433 вторичных пневмоний (55,20%).
Даже в условиях продолжающейся вспышки COVID-19 распространенные респираторные вирусы по-прежнему составляют значительную часть госпитализаций, сообщают исследователи из Гонг-Конга (Wee L.E., 2020). Коинфекции с SARS-CoV-2 были редкими (1,4%), без повышения заболеваемости или смертности. Отмечают также, что пациенты с сочетанной инфекцией COVID-19 и гриппа, по-видимому, не испытывали более тяжелого течения, потому что, основываясь на лабораторных данных, исследованиях изображений и прогнозах пациентов, они продемонстрировали клинические характеристики, аналогичные таковым у больных с инфекцией COVID-19 (Ding Q. et al., 2020).
Так каким должен быть клинический подход?
Итальянские авторы представили свой алгоритм ведения пациентов (см. также предложение немецких авторов) с подозреваемым COVID-19 (Bertolino L. et al., 2020). Так, в лабораторных данных при COVID-19 наиболее часто регистрируются гипоальбуминемия, повышенный уровень С-реактивного белка и лактатдегидрогеназы в сыворотке крови, лимфопения и высокая скорость оседания эритроцитов. Реже наблюдают повышение уровня аланинаминотрансферазы, аспартатаминотрансферазы, креатинкиназы и d-димеров фибриногена. Так, d-димеры (>1 мкг/мл) могут быть единственным маркером крови, который независимо коррелирует с худшим исходом, вместе с возрастом (Zhou F. et al., 2020). Что касается интерлейкина-6, то более высокие уровни этого цитокина в крови тоже коррелируют с худшим исходом, как и прокальцитонина (Ruan Q. et al., 2020; Lippi G., Plebani M. et al., 2020). Так, во французском исследовании измеряли уровни прокальцитонина — признанного маркера бактериальной инфекции у госпитализированных пациентов с гриппозной пневмонией H1N1 — и пришли к выводу, что уровни 0,8 мкг/л и более помогают различить изолированные вирусные и смешанные вирусно-бактериальные пневмонии (Cuquemelle E. et al., 2011). Однако есть свидетельства того, что воспалительные серологические маркеры, которые обычно связаны с бактериальной инфекцией, такие как повышенный уровень прокальцитонина и С-реактивного белка, могут появляться у пациентов с COVID-19 без возникновения соответствующей бактериальной коинфекции (Wan S. et al., 2020; Zhou F. et al., 2020). На более ранних этапах в определении прогноза могут помочь уровни провоспалительных медиаторов, повышенное отношение нейтрофилов к лимфоцитам и степень тяжести отклонений по данным компьютерной томографии (Feng Z. et al., 2020).
Назначение и отмена
Таким образом, вторичная бактериальная инфекция при заражении SARS-CoV-2 развивается редко. К назначению антибактериальных средств в амбулаторной практике следует подходить в высшей степени дифференцированно, а также избегать гипердиагностики состояний, являющихся показанием к госпитализации. На стационары в этой ситуации ложится особая нагрузка в отношении предупреждения нозокомиальных инфекций, в том числе COVID-19, поскольку, несмотря на вспышку данной инфекции, пневмонии часто имеют другую природу, а присоединение SARS-CoV-2 может усугубить ситуацию. При наличии показаний антибактериальная терапия должна быть назначена в соответствии с местными руководящими принципами с оценкой ответа через 48–72 ч. (Hughes S. et al., 2020). При получении отрицательных результатов микробиологического исследования антибактериальную терапию следует прекращать (Townsend L. et al., 2020). Для мониторинга состояния микробной картины в дыхательных путях рекомендуют выполнять анализ мокроты/БАЛ с 48-часовыми интервалами, а в случае невозможности — особый протокол выявления вторичной бактериальной пневмонии при стационарном лечении пациентов с пневмонией, связанной с COVID-19 (Sharov K.S., 2020). Поскольку среди вторичных пневмоний при COVID-19 примерно половина приходилась на госпитальные, количество тяжелых исходов может быть значительно уменьшено путем бескомпромиссной борьбы с внутрибольничной инфекцией. Так, внебольничные пневмонии трудно контролировать и лечить, а нозокомиальные — гораздо эффективнее, если разработан и строго соблюдается надлежащий клинический алгоритм.
Список использованной литературы
- Bertolino L., Vitrone M., Durante-Mangoni E. (2020) Does this patient have COVID-19? A practical guide for the internist. Intern Emerg Med, 15(5): 791–800.
- Cuquemelle E., Soulis F., Villers D. et al. (2011) Can procalcitonin help identify associated bacterial infection in patients with severe influenza pneumonia? A multicentre study. Intensive Care Med, 37: 796–800
- Ding Q., Lu P., Fan Y. et al. (2020) The clinical characteristics of pneumonia patients coinfected with 2019 novel coronavirus and influenza virus in Wuhan, China [published online ahead of print, 2020 Mar 20]. J Med Virol. doi: 10.1002/jmv.25781.
- Feng Z., Yu Q., Yao S. et al. (2020) Early prediction of disease progression in COVID-19 pneumonia patients with chest CT and clinical characteristics. Nat Commun., 11(1): 4968. doi:10.1038/s41467-020-18786-x.
- Hughes S., Troise O., Donaldson H. et al. (2020) Bacterial and fungal coinfection among hospitalized patients with COVID-19: a retrospective cohort study in a UK secondary-care setting. Clin Microbiol Infect., 26(10): 1395–1399.
- Joseph C., Togawa Y., Shindo N. (2013) Bacterial and viral infections associated with influenza. Influenza Other Respir Viruses. 2(2): 105-13.
- Lansbury L., Lim B., Baskaran V. et al. (2020) Co-infections in people with COVID-19: a systematic review and meta-analysis. J Infect., 81(2): 266-275.
- Lippi G., Plebani M. (2020) Procalcitonin in patients with severe coronavirus disease 2019 (COVID-19): a meta-analysis. Clin Chim Acta., 505: 190–191
- Ma L., Wang W., Le Grange J.M. et al. (2020) Coinfection of SARS-CoV-2 and Other Respiratory Pathogens. Infect Drug Resist., 13: 3045-3053.
- MacIntyre C.R., Chughtai A.A., Barnes M. et al. (2018) The role of pneumonia and secondary bacterial infection in fatal and serious outcomes of pandemic influenza a(H1N1)pdm09. BMC Infect Dis. 18(1): 637.
- National Institute for Health and Care Excellence (NICE) (2020). COVID-19 rapid guideline: managing suspected or confirmed pneumonia in adults in the community. Available at: http://www.nice.org.uk/guidance/ng165/chapter/ 4-Managing-suspected-or-confirmed-pneumonia
- Rawson T.M., Moore L.S.P., Zhu N. et al. (2020) Bacterial and fungal co-infection in individuals with coronavirus: A rapid review to support COVID-19 antimicrobial prescribing [published online ahead of print, 2020 May 2]. Clin Infect Dis., ciaa530.
- Rizzo C. Caporali M.G., Rota M.C. (2010) Pandemic influenza and pneumonia due to Legionella pneumophila: a frequently underestimated coinfection. Clin Infect Dis., 51(1): 115.
- Ruan Q., Yang K., Wang W. et al. (2020) Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med., 46(5): 846–848.
- Sharov K.S. (2020) SARS-CoV-2-related pneumonia cases in pneumonia picture in Russia in March-May 2020: Secondary bacterial pneumonia and viral co-infections. J Glob Health., 10(2): 020504.
- Townsend L., Hughes G., Kerr C. et al. (2020) Bacterial pneumonia coinfection and antimicrobial therapy duration in SARS-CoV-2 (COVID-19) infection. JAC Antimicrob Resist., 2(3): dlaa071.
- Wan S., Xiang Y., Fang W. et al. (2020) Clinical Features and Treatment of COVID-19 Patients in Northeast Chongqing. J Med Virol., Mar 21.
- Wee L.E., Ko K.K.K., Ho W.Q. et al. (2020) Community-acquired viral respiratory infections amongst hospitalized inpatients during a COVID-19 outbreak in Singapore: co-infection and clinical outcomes. J Clin Virol., 128: 104436.
- Zhou F., Yu T., Du R. et al. (2020) Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet, 395: 1054–1062.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим