Оскільки пріоритетною метою при розподілі коштів на потреби охорони здоров’я є максимізація суспільної користі, а орфанні ліки ніколи не бувають рентабельними в такому широкому сенсі, при їх фінансуванні доводиться відходити від суто утилітарного підходу. Тобто суспільство має бути готовим частково відмовитися від поліпшення здоров’я населення в цілому заради допомоги невеликому колу осіб. Для кращого розуміння даного феномена британські автори пропонують звернути увагу на такі поняття, як горизонтальна (рівне ставлення до рівних) і вертикальна рівність (нерівне ставлення до нерівних) (Drummond M., Towse A., 2014). У той же час практичну реалізацію політики у сфері забезпечення орфанними препаратами все частіше оцінюють як незадовільну практично з усіх точок зору. Через високі ціни більшість орфанних препаратів не виправдовують фінансування за критерієм економічної ефективності, але, відмовляючи у виділенні коштів, платники часто стикаються з політичними проблемами. Пацієнти відчувають великий стрес у зв’язку з відсутністю доступу до лікування. Постачальники, отримуючи відмову у відшкодуванні вартості, втрачають інтерес до нововведень у даній сфері.
Проблеми, пов’язані з орфанними препаратами, також розділяє академічне співтовариство. Частина дослідників вказують на «надмірний» прибуток виробників і «розповзання орфанного статусу», коли препарат насправді отримує велика популяція пацієнтів (Berdud M. et al., 2020). Інші доводять необхідність альтернативних підходів до ОМТ стосовно відшкодування витрат на орфанні ліки (Drummond M. et al., 2007). Їх впровадили, зокрема, приблизно в половині країн Центральної та Східної Європи (включаючи узгодження цін і пом’якшені вимоги до економічної ефективності) (Malinowski K.P. et al., 2019). При цьому спеціальні процедури можуть або доповнювати, або заміняти звичайні (табл. 1):
| Країни | Місце OMT у процесі прийняття рішень про реімбурсацію |
| Англія | Окремий процес для вузькоспеціалізованих технологій, включаючи препарати-сироти; результат оцінки, проведеної відповідно до додаткових наборів критеріїв, включений в остаточне рішення про відшкодування |
| Австралія | Програма з рідкісних захворювань з окремим бюджетом на фінансування орфанних препаратів — Life Saving Drugs Program (LSDP), оцінюється Консультативним комітетом з фармацевтичних пільг (Pharmaceutical Benefits Advisory Committee) за окремою процедурою, з прискореним розглядом при мінімальних витратах для заявників |
| Болгарія | Рішення щодо орфанних препаратів приймають за особливим алгоритмом, реімбурсацію схвалюють, якщо заявка набирає мінімум 60 балів |
| Нова Зеландія | У рамках пілотної програми можна подати заявку, що передбачає участь у фонді з виділеним бюджетом; рішення про відшкодування приймають у відповідності з особливими критеріями |
| Румунія | Використовують спеціальний алгоритм. Лікарський засіб отримує умовну рекомендацію, якщо йому присвоєно не менше 60 балів, і безумовну — не менше 80 балів |
| США | Особливий підхід до фармакоекономічної оцінки орфанних препаратів реалізує Інститут клініко-економічного оцінювання (Institute for Clinical and Economic Review) |
- Шотландія: спершу подають стандартну заяву про реімбурсацію, а після негативного рішення Агентства з оцінки медичних технологій (Scottish Medicines Consortium), або в разі перевищення порогу рентабельності згідно з економічним аналізом подають заявку на оцінку за додатковими критеріями; крім того, можна узгодити більш високий поріг вартості року життя певної якості (QALY) в разі рідкісних (тим більше ультрарідкісних захворювань, для яких є окрема процедура);
- Болгарія, Румунія, Італія (Ломбардія, експериментальна схема), Англія, Нова Зеландія (завершена пілотна програма), Австралія: оцінка обґрунтованості відшкодування вартості ліків щодо додаткових критеріїв, специфічних для препаратів, які застосовуються при рідкісних захворюваннях, без подачі традиційної заявки на відшкодування вартості.
У країнах, що стимулюють інноваційну діяльність, одне з найважливіших завдань регулятора полягає в тому, щоб виробники орфанних ліків не отримували прибуток більш високий, ніж звичайних. Тобто норма прибутку від інвестицій у розробку орфанних ліків не повинна перевищувати середній показник по фармацевтичній галузі з урахуванням поправок на ризик і будь-які інші відповідні обставини. Тим часом кількість учасників досліджень є одним із основних чинників, що визначають фактичні витрати на розробку лікарського засобу (рисунок), і створення орфанного препарату в середньому обходиться дешевше, ніж звичайного.
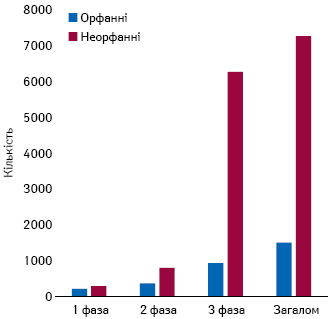
Обчисливши орієнтовну середню вартість розробки (R&D) орфанних і неорфанних препаратів на прикладі схвалених у 2015 р., автори запропонували свій метод розрахунку цін (табл. 2).
| Орфанні | Інші | Орфанні/інші, % | |
| Всі показання | 501,2 | 2140,8 | 23,4 |
| Для застосування в онкології | 511,6 | 2341,5 | 21,8 |
На початок 2020 р. дозвіл на маркетинг в Європейському Союзі мають 105 препаратів для лікування рідкісних захворювань зі статусом орфанних* (див. табл. 3) і 236 — без такого статусу (ORPHANET, 2020). При цьому зазначений статус, що надається за запитом відповідальної особи, дає право на маркетингову ексклюзивність терміном на 10 років. Державну реєстрацію в Україні, за нашими підрахунками, мають 29 препаратів з орфанним статусом, у Росії — 40. У Республіці Польща реімбурсують 21 орфанний і 102 неорфанних препарати для лікування рідкісних захворювань. Тобто загалом для лікування рідкісних захворювань у Польщі зареєстрований 341 препарат, з яких відшкодовують 123, а всього по країнах Європейського Союзу — в середньому 251.
План Польщі на 2021–2023 рр.
Міністерством охорони здоров’я (Ministerstwo Zdrowia) Польщі підготовлений і представлений на громадське обговорення План з рідкісних захворювань (Plan dla Chorób Rzadkich), що включає близько 40 завдань для реалізації у 2021–2023 рр. Основні положення Плану, покликаного замінити попередню, прийняту у 2017 р. версію, спрямовані на поліпшення діагностики і лікування рідкісних захворювань відповідно до стандартів, прийнятих в Європейському Союзі, забезпечення доступу до високоякісних інноваційних медичних послуг і розширення знань про рідкісні захворювання. Останні становлять серйозну проблему для охорони здоров’я і соціального захисту, бо їх діагностують у 6–8% населення, тобто більше 2 млн осіб у такій країні, як Польща.
«План з рідкісних захворювань — це конкретний графік заходів з джерелами фінансування, — підкреслив заступник міністра Славомир Гадомський (Sławomir Gadomski). — Я переконаний, що він отримає схвалення Ради міністрів, і нарешті у нас в Польщі буде комплексна програма для пацієнтів із рідкісними захворюваннями».
Витрати на реалізацію Плану оцінюють більш ніж у 90 млн злотих (668 млн грн), на додаток до яких на ліки планують виділяти 750 млн злотих (5,6 млрд грн) на рік з державного цільового Медичного фонду (Funduszu Medycznego, заснованого згідно з однойменним законом від 7 жовтня 2020 р.). Метою останнього є надання додаткових джерел фінансування на потреби охорони здоров’я за допомогою організації конкурсів та інвестиційних програм.
Джерелами доходів фонду є встановлені законом збори, а також державний бюджет. Додаткові кошти в обсязі 30–50 млн злотих (223–372 млн грн) також будуть надані Національним фондом охорони здоров’я (Narodowy Fundusz Zdrowia), який почне фінансування нових методів генетичної діагностики.
План з рідкісних захворювань передбачає нововведення в декількох сферах:
1. Експертні центри з рідкісних захворювань, що покликані виключити ситуацію, коли пацієнтам доводиться відвідувати різні центри в пошуках спеціаліста з досвідом у тій чи іншій сфері. «Ми хочемо чітко вказати, які центри в Польщі будуть виконувати експертні функції щодо конкретних захворювань», — пояснив міністр охорони здоров’я Адам Недзельський (Adam Niedzielski).
2. Розвиток інфраструктури та методології діагностики (забезпечення окремого фінансування з державних коштів, організація масштабних геномних досліджень, обмеження генетичної діагностики польських пацієнтів у зарубіжних центрах, забезпечення повного дотримання сучасних стандартів і настанов з діагностичних процедур).
3. Доступ до ліків і продуктів харчування для певних дієтичних цілей.
Доступність інноваційних технологій забезпечуватимуть, серед іншого, за рахунок діяльності Агентства з оцінки технологій охорони здоров’я і тарифікації (Agencja Oceny Technologii Medycznych i Taryfikacji — AOTMiT), у тому числі, з використанням економічного моделювання, і фінансувати з Медичного фонду.
Багатокритеріальний аналіз рішень (МАР) — один з найбільш придатних для цього підходів, для розробки якого необхідне створення моделі переваг з описом критеріїв, можливих ступенів їх досягнення і відповідної питомої ваги. Мета — розробити критерії оцінки, які застосовують у разі перевищення прийнятого порогу рентабельності (триразова величина ВВП на душу населення).
Не виділені окремим пунктом, але все ж дуже важливі інформаційно-організаційні компоненти: реєстри та паспорти пацієнтів з рідкісними захворюваннями, доступні для обробки цифровими засобами. Реєстр рідкісних захворювань важливий для пацієнтів, лікарів, вчених і організаторів охорони здоров’я, підприємців, органів влади як на місцевому, так і на центральному рівні. Європейська комісія представила Європейську платформу реєстрації рідкісних захворювань (Європейська платформа реєстрації рідкісних захворювань) [eu-rdplatform.jrc.ec.europa.eu/en] для збору інформації про сотні існуючих баз даних та реєстрів рідкісних захворювань, поширених в окремих країнах-членах.
З метою поліпшення доступності ліків планують ширше застосовувати спільні з іншими країнами закупівлі. Пропонують, щоб при зверненні пацієнтів або їх груп з питання організації імпорту для індивідуальних потреб ліків або продуктів харчування для спеціальних цілей міністр охорони здоров’я не був обмежений рішенням AOTMiT, як зараз. Звертають також увагу на те, щоб при фактичній наявності в розпорядженні міністра правових інструментів для організації відшкодування лікарських засобів поза схваленими показаннями, на ділі організувати безбар’єрний безкоштовний доступ пацієнтів до необхідних ліків.
Чи буде поліпшуватися положення хворих з рідкісними захворюваннями в Польщі та інших країнах регіону? Відповідь на це питання в найближчому майбутньому залежить, у тому числі, від ефективності нових стратегій у даній сфері.
Cписок використаної літератури
- Berdud M., Drummond M., Towse A. (2020) Establishing a reasonable price for an orphan drug. Cost Eff Resour Alloc.; 18: 31. Published 2020 Sep 4. doi:10.1186/s12962-020-00223-x.
- Drummond M., Towse A. (2014) Orphan drugs policies: a suitable case for treatment. Eur. J. Health Econ., 15: 335–340. doi.org/10.1007/s10198-014-0560-1.
- Drummond M., Wilson D., Kanavos P. et al. (2007) Assessing the economic challenges posed by orphan drugs. International Journal of Technology Assessment in Health Care, 23(1): 36–42.
- Lists of medicinal products for rare diseases in Europe November 2020, ORPHANET http://www.orpha.net/orphacom/cahiers/docs/ GB/list_of_orphan_drugs_in_europe.pdf.
- Malinowski K.P., Kawalec P., Trąbka W. et al. (2019) Reimbursement Legislations and Decision Making for Orphan Drugs in Central and Eastern European Countries. Front. Pharmacol., 10: 487. doi: 10.3389/fphar.2019.00487.
- . Załącznik do uchwały RM w spr. dokumentu Plan dla Chorób Rzadkich (2021) Ministerstwo Zdrowia, http://www.gov.pl/web/zdrowie/projekt-uchwaly-rady-ministrow-w-sprawie-przyjecia-dokumentu-plan-dla-chorob-rzadkich-pre-konsultacje.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим