 Державна служба України з лікарських засобів та контролю за наркотиками у Луганській обл. оприлюднила роз’яснення про вимоги законодавства щодо маркування медичних виробів. Роз’яснення оприлюднено через численні питання під час проведення перевірок ринкового нагляду медичних виробів.
Державна служба України з лікарських засобів та контролю за наркотиками у Луганській обл. оприлюднила роз’яснення про вимоги законодавства щодо маркування медичних виробів. Роз’яснення оприлюднено через численні питання під час проведення перевірок ринкового нагляду медичних виробів.ЗАКОНОДАВСТВО ТА ЗАГАЛЬНІ ВИМОГИ
У відомстві зазначають, що маркування медичних виробів регламентується насамперед технічними регламентами щодо медичних виробів, у тому числі для діагностики in vitro та тих, що імплантують, затверджених постановами КМУ від 02.10.2013 р. №№ 753, 754, 755.
Також маркування медичних виробів повинно відповідати вимогам законів України «Про захист прав споживачів», «Про загальну безпечність нехарчової продукції», «Про забезпечення функціонування української мови як державної» та національним стандартам України:
- ДСТУ EN 980:2007 «Символи графічні для маркування медичних виробів»;
- ДСТУ 3798-98 (IEC 60601-1:1988) Вироби медичні електричні. Частина 1. Загальні вимоги безпеки (для активних виробів).
Окрім цього, згідно з п. 6 ст. 33 Закону України «Про забезпечення функціонування української мови як державної» маркування медичних виробів виконується державною мовою.
Загальні вимоги до маркування медичних виробів визначені пп. 42–47 Розділу ІІ додатку І постанови № 753. Відповідно до положень цих пунктів кожен медичний виріб має супроводжуватися інформацією, необхідною для його безпечного та правильного використання з урахуванням рівня підготовки та кваліфікації споживачів і користувачів, а також для ідентифікації виробника. Зазначена інформація включає інформацію на етикетці та інструкцію для використання.
Наскільки це можливо і доцільно, інформація, необхідна для безпечного використання медичного виробу, розміщується безпосередньо на медичному виробі та/або на упаковці кожної одиниці медичного виробу чи в разі потреби — на упаковці для продажу. Якщо індивідуальне пакування кожної одиниці неможливе, то ця інформація розміщується на вкладці, яка додається до одного або більше медичних виробів.
Інструкція для використання вкладається в упаковку кожного медичного виробу. Водночас вони не є необхідними для медичних виробів, що належать до I або IIа класу безпеки, якщо ці медичні вироби можуть безпечно використовуватися без такої інструкції.
У разі можливості інформація, що має супроводжувати медичні вироби, має наводитися у формі символів. При цьому всі використані символи та ідентифікаційні кольори повинні відповідати гармонізованим стандартам. У разі відсутності таких стандартів використані символи та кольори мають бути описані в документації, що постачається разом з медичними виробами.
Найпоширенішими символами, які можуть наноситися на медичні вироби згідно з ДСТУ EN 980:2007 «Символи графічні для маркування медичних виробів», є:
| Символ | Найменування символу | Номер символу в ДСТУ EN 980:2007 |
 |
ОЗНАЙОМЛЕННЯ З ІНСТРУКЦІЯМИ ДЛЯ ЗАСТОСОВУВАННЯ | 5.8 |
 |
БІОЛОГІЧНІ РИЗИКИ | 5.9 |
 |
Повторно використовувати ЗАБОРОНЕНО | 4.2 |
 |
ЗАСТОРОГА! ОЗНАЙОМИТИСЯ ІЗ СУПРОВІДНИМИ ДОКУМЕНТАМИ
Синонімом символу «Засторога! Ознайомитися із супровідними документами» є «Увага, дивись інструкцію для використання» |
4.10 |
 |
НИЖНЯ МЕЖА ТЕМПЕРАТУРИ | 5.7.2 |
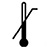 |
ВЕРХНЯ МЕЖА ТЕМПЕРАТУРИ | 5.7.1 |
 |
ТЕМПЕРАТУРНЕ ОБМЕЖЕННЯ | 5.7.3 |
 |
ВИКОРИСТАТИ ДО | 4.3 |
 |
ДАТА ВИГОТОВЛЕННЯ
Цей символ повинен супроводжуватися датою, наведеною, як зазначено в EN 28601, вона складається з чотирьох цифр року, двох цифр місяця і, за необхідності, двох цифр дня. Дата повинна бути написана поруч із символом |
4.6 |
 |
ВИРОБНИК
Цей символ повинен супроводжуватися назвою та адресою виробника, який несе відповідальність за продукцію. Адреса не є необхідною біля символу безпосередньо на контейнері, як визначено в EN 375 и EN 378, крім тих випадків, якщо контейнер безпосередньо також є зовнішнім контейнером |
5.2 |
 |
КОД ПАРТІЇ
Цей символ повинен супроводжуватися кодом партії виробника. Цей код буде суміжний із символом |
4.4 |
 |
НОМЕР ЗА КАТАЛОГОМ
Номер виробника за каталогом має бути розташовано після або нижче символу, суміжного з ним |
4.9 |
 |
РЕЄСТРАЦІЙНИЙ НОМЕР
Цей символ повинен супроводжуватися реєстраційним номером виробника. Реєстраційний номер виробника має бути розташований після або нижче символу |
4.5 |
 |
СТЕРИЛЬНІСТЬ
Цей символ — лише для медичних виробів, які повністю стерилізовані |
4.7 |
 |
Символ для стерильних медичних виробів, які оброблено із застосовуванням стерильної техніки | 4.11 |
 |
Символ методу стерилізації, під час якого використовують оксид етилену | 4.8.1 |
 |
Символ методу стерилізації, під час якого використовують випромінювання | 4.8.2 |
 |
Символ методу стерилізації, під час якого використовують пар чи сухий жар | 4.8.3 |
 |
МЕДИЧНИЙ ВИРІБ ДЛЯ ДІАГНОСТИКИ IN VITRO | 5.6 |
 |
МІСТИТЬ ДОСТАТНЬО ДЛЯ (n-) ВИПРОБОВУВАНЬ | 5.4 |
ЕТИКЕТКА МЕДИЧНОГО ВИРОБУ
Етикетка медичного виробу повинна містити такі елементи:
1) найменування або торгову марку і місцезнаходження виробника. Для медичних виробів, що імпортуються з метою введення в обіг, на етикетці, або зовнішньому пакуванні, або в інструкції для використання додатково зазначаються найменування та місцезнаходження уповноваженого представника, якщо виробник не є резидентом України;
2) дані, що обов’язково необхідні для ідентифікації медичного виробу, а також вміст пакування;
3) для медичних виробів, виготовлених на замовлення, — слова «медичний виріб виготовлено на замовлення»;
4) для медичних виробів, призначених для клінічних досліджень, — слова «виключно для клінічних досліджень»;
5) інформацію про будь-які спеціальні умови зберігання медичного виробу та/або використання;
6) інформацію про будь-які спеціальні інструкції з експлуатації;
7) інформацію про будь-які запобіжні заходи та/або застереження;
8) в разі потреби:
- слово «Стерильно»;
- код партії (після слова «Партія») чи серійний номер;
- строк, до якого гарантовано безпечне використання медичного виробу, із зазначенням року та місяця;
- позначку про призначення для одноразового використання. Позначка виробника про одноразове використання медичного виробу має відповідати гармонізованим стандартам;
- інформацію про метод стерилізації;
9) рік виготовлення — для активних медичних виробів, на які не поширюється дія п. 8 щодо маркування строком, до якого гарантовано безпечне використання медичного виробу. Така інформація може бути включена в номер партії або серійний номер;
10) якщо медичний виріб містить як невід’ємну частину похідні крові людини — відповідне позначення, що медичний виріб містить похідні крові людини.
Також якщо цільове призначення медичного виробу не є очевидним для користувача, виробник повинен чітко зазначити його на маркуванні та в інструкції для використання.
У разі доцільності і можливості медичні вироби та їх компоненти, що знімаються, мають бути ідентифіковані (у разі потреби — за номерами партій) для забезпечення виявлення будь-якого потенційного ризику, пов’язаного з такими медичними виробами та їх компонентами, що знімаються.
При потребі в інструкції для використання можуть зазначатися:
- всі вищезазначені відомості з етикетки, окрім коду партії чи серійного номера та строку, до якого гарантовано безпечне використання медичного виробу, із зазначенням року та місяця;
- експлуатаційні властивості, передбачені виробником, та будь-які небажані побічні дії;
- якщо медичний виріб для використання за призначенням має бути встановлений або з’єднаний з іншими медичними виробами та/або обладнанням, — вказується детальний опис характеристик цього медичного виробу, достатній для правильного підбору таких медичних виробів та/або обладнання для безпечного поєднаного використання;
- повний обсяг інформації, необхідної для перевірки правильності встановлення медичного виробу і можливості його правильного і безпечного використання, разом з відомостями про характер та періодичність технічного обслуговування і калібрування для забезпечення його точної і безпечної роботи протягом всього строку експлуатації;
- інформація, необхідна для уникнення певних ризиків, пов’язаних з імплантацією медичного виробу (при потребі);
- інформація щодо ризиків виникнення взаємних перешкод, пов’язаних з наявністю медичного виробу під час проведення спеціальних досліджень або лікування;
- необхідні інструкції на випадок пошкодження стерильного пакування та в разі потреби — інформація щодо методів рестерилізації;
- докладна інформація щодо будь-якої додаткової обробки, яку необхідно здійснити, перш ніж медичний виріб можна буде використовувати (наприклад стерилізація, остаточне складання);
- для медичних виробів, що випромінюють радіацію в медичних цілях, — докладна інформація про характер, тип, інтенсивність і поширення цього випромінювання.
Якщо медичний виріб може бути використаний повторно, в інструкції зазначається інформація щодо відповідних процесів підготовки до повторного використання, зокрема щодо очищення, дезінфекції, пакування, способу стерилізації для медичного виробу, що підлягає рестерилізації, та будь-яких обмежень кількості повторних застосувань.
Якщо медичні вироби потребують стерилізації перед використанням, їх інструкції щодо очищення та стерилізації мають бути такими, щоб за умови правильного виконання зазначені вироби продовжували відповідати експлуатаційним характеристикам, вимогам безпеки і транспортування та іншим вимогам, зазначеним в розділі І додатку 1 Технічного регламенту щодо медичних виробів.
Якщо медичний виріб призначено для одноразового використання, зазначається інформація про відомі характеристики та технічні фактори, які відомі виробникові і які можуть становити ризик за умови повторного використання медичного виробу. Якщо ж мова йде про медичні вироби, що належать до класу I або IIa, які можуть безпечно використовуватися без інструкції, то інформація про ці вироби надається на запит користувача.
Інструкції для використання медичних виробів повинні теж містити відомості, що дають можливість медичному персоналу попереджати споживача про будь-які протипоказання та запобіжні заходи, зокрема інформацію про:
- запобіжні заходи, що мають вживатися в разі зміни робочих характеристик медичного виробу;
- запобіжні заходи, що мають вживатися у зв’язку із впливом магнітних полів, зовнішніх електричних впливів, електростатичних розрядів, тиском або змінами тиску, прискоренням, джерелами теплового займання тощо;
- лікарський засіб чи засоби, для введення яких призначено відповідний медичний виріб, включаючи будь-які обмеження щодо вибору речовин для введення;
- запобіжні заходи, що мають вживатися для усунення будь-яких спеціальних, незвичайних ризиків, пов’язаних з утилізацією медичних виробів;
- лікарські засоби або похідні крові людини, які медичний виріб містить як невід’ємну частину;
- ступінь точності, встановлену для медичних виробів з функцією вимірювання;
- дату випуску або останнього перегляду інструкції для використання.
МЕДИЧНІ ВИРОБИ ДЛЯ ДІАГНОСТИКИ IN VITRO
Такі медичні вироби повинні маркуватися з дотриманням вимог пп. 37–43 розділу ІІ додатку І постанови № 754 «Про затвердження Технічного регламенту щодо медичних виробів для діагностики in vitro». Так, кожен такий виріб повинен супроводжуватися інформацією, необхідною для його безпечного і правильного використання з урахуванням підготовки та кваліфікації потенційних користувачів або споживачів, а також для ідентифікації його виробника.
Інформація, необхідна для безпечного і правильного використання виробу, розміщується безпосередньо на виробі та/або на упаковці для продажу. Якщо розміщення повної інформації на етикетці кожної одиниці виробу є практично неможливим, інформація розміщується на упаковці та/або в інструкції для споживача/користувача, яка додається до одного або більше виробів.
Інструкція для використання повинна супроводжувати виріб або міститися в упаковці для одного або більше виробів. Водночас допускається відсутність інструкції, якщо виріб можна правильно та безпечно застосовувати без неї.
Якщо вироби містять препарат, що може вважатися небезпечним з огляду на природу та кількість його складових, а також його форму, повинен бути нанесений символ, що позначає небезпеку, та здійснене маркування в установленому законодавством порядку. У разі відсутності достатнього місця для розміщення інформації на самому виробі або його етикетці відповідні символи небезпеки повинні розміщуватися на етикетці, а вся інша необхідна інформація — в інструкції для використання.
Окрім загальних вимог до етикеток медичних виробів, що зазначені вище, етикетка медичних виробів для діагностики in vitro також повинна містити інформацію:
- необхідну користувачеві або споживачеві для точної ідентифікації виробу та вмісту упаковки;
- про особливий мікробіологічний стан або рівень чистоти (слово «Стерильно» або відповідний символ);
- про код партії виробів, зазначений після слова «Партія», або серійний номер;
- про дату, до настання якої сам виріб чи його частина можуть безпечно використовуватися без погіршення експлуатаційних характеристик, у такому порядку: рік, місяць та в разі потреби — день;
- щодо виробів для оцінки характеристик слова «тільки для оцінки характеристик»;
- про призначення виробу для використання in vitro;
- будь-які особливі умови зберігання та/або використання;
- особливі інструкції для використання;
- відповідні попередження та/або заходи безпеки, яких слід вживати;
- якщо виріб призначений для самоконтролю, цей факт повинен бути чітко зазначений.
Також окрім загальних вимог до інструкції, вказаних вище, інструкція щодо медичних виробів для діагностики in vitro в разі доцільності може містити:
1) якісний і кількісний склад реагентних виробів або дані про концентрацію активних інгредієнтів реагентів чи наборів реагентів, а також інформацію стосовно того, що виріб містить інші інгредієнти, які можуть вплинути на вимірювання;
2) умови зберігання та строк придатності після першого відкриття первинного пакування, а також умови зберігання та стабільність робочих реагентів;
3) дані про необхідне спеціальне обладнання, в тому числі інформацію, необхідну для ідентифікації такого спеціального обладнання для належного використання;
4) тип зразків, які повинні використовуватися для дослідження, будь-які спеціальні умови збирання, попередньої обробки та зберігання зразків, а також інструкції щодо підготовки пацієнта;
5) процедуру вимірювання, необхідну для використання виробу, яка містить:
- принцип методу вимірювання;
- специфічні аналітичні характеристики виробу (в тому числі чутливість, специфічність, точність, повторюваність, відтворюваність, межі визначення та діапазон вимірювань, включаючи інформацію, необхідну для контролю відомих релевантних похибок), обмеження методу та інформацію про використання наявних референтних вимірювальних процедур та референтних матеріалів (стандартних зразків) користувачами;
- подробиці будь-яких подальших процедур або робіт, які необхідно проводити перед використанням виробів (наприклад реконституції, інкубації, розведення, перевірки із використанням відповідних приладів тощо);
- інформацію про необхідність спеціальної підготовки користувача;
6) підхід, який застосовується для розрахунку аналітичних результатів, інформацію про заходи, яких слід вжити у разі зміни аналітичних характеристик медичного виробу;
7) інформацію для користувача про внутрішній контроль якості, включаючи спеціальні процедури валідації та простежуваність калібрування виробу;
8) референтні інтервали для показників, що визначаються;
9) інформацію, необхідну для перевірки правильного встановлення виробу, правильного та безпечного його функціонування, а також додаткову інформацію про характер і періодичність технічного обслуговування та калібрування, необхідних для забезпечення правильної та безпечної роботи виробу; інформацію про безпечну утилізацію відходів;
10) інформацію про додаткові заходи або дії, які необхідно вчинити перед використанням виробу (стерилізація, остаточне складання тощо);
11) інформацію про заходи безпеки, яких необхідно вживати в обґрунтовано передбачуваних умовах навколишнього середовища щодо впливу магнітних полів, зовнішніх електричних впливів, електростатичних розрядів, тиску або зміни тиску, прискорення, теплових джерел займання тощо;
12) інформацію про заходи безпеки, яких необхідно вжити для запобігання будь-яким специфічним, незвичайним ризикам, пов’язаним з використанням чи утилізацією виробів, включаючи спеціальні захисні заходи (якщо виріб містить речовини людського або тваринного походження, слід звертати увагу на їх потенційну інфекційну природу (інфектогенність));
13) дату випуску або дату останнього перегляду інструкції для використання;
14) специфікації для виробів для самоконтролю.
Якщо виріб повинен використовуватися в поєднанні з іншими медичними виробами або встановлюватися за допомогою медичних виробів чи під’єднуватися до них для функціонування за призначенням, інструкція для використання повинна містити також інформацію про характеристики таких виробів, достатню для ідентифікації відповідних медичних виробів або обладнання, які потрібні для отримання безпечного і правильного поєднання.
Результати роботи виробу повинні бути виражені та представлені так, щоб їх могли легко зрозуміти користувачі та/або споживачі без необхідної кваліфікації; інформація повинна містити поради користувачеві/споживачеві про те, що слід робити (у разі позитивного, негативного чи невизначеного результату), та вказівку на можливість хибнопозитивного або хибнонегативного результату.
Специфічні особливості можуть не зазначатися, якщо надана користувачеві/споживачеві інформація є достатньою для правильного використання виробу для самоконтролю та розуміння ним отриманих результатів.
Зазначена інформація повинна включати чітку вказівку споживачу не приймати будь-які рішення медичного характеру без попередньої консультації з лікарем.
Інформація повинна також містити вказівку на те, що якщо виріб для самоконтролю використовується для моніторингу існуючого захворювання, пацієнт може застосувати лікування тільки після належної підготовки для здійснення такого лікування.
АКТИВНІ МЕДИЧНІ ВИРОБИ, ЯКІ ІМПЛАНТУЮТЬ
Такі медичні вироби повинні маркуватися з дотриманням вимог пп. 12–16 додатку І постанови № 755 «Про затвердження Технічного регламенту щодо активних медичних виробів, які імплантують». Так, вироби та їх комплектувальні частини повинні бути ідентифіковані для вжиття необхідних заходів після виявлення потенційного ризику у зв’язку з використанням виробів та їх комплектувальних частин.
Вироби повинні мати код, за яким вони та їх виробник можуть бути однозначно ідентифіковані (особливо щодо типу виробу та року виробництва). При цьому необхідно забезпечити можливість прочитати цей код без хірургічного втручання.
Якщо виріб або його комплектувальні частини містять вказівки, необхідні для забезпечення функціонування виробу, або визначають за допомогою візуальної системи параметри функціонування чи налаштування, така інформація повинна бути зрозумілою для споживача та користувача.
Кожен виріб повинен містити такі відомості (в разі можливості — у вигляді символів), нанесені чітко і розбірливо:
1) на стерильній упаковці:
- метод стерилізації;
- позначення, що дозволяє розпізнати упаковку;
- найменування та місцезнаходження виробника;
- опис виробу;
- напис: «виключно для клінічних досліджень», якщо виріб призначений для клінічних досліджень;
- напис: «виріб, виготовлений на замовлення», якщо виріб виготовлений на замовлення;
- повідомлення, що виріб є стерильним;
- місяць і рік виробництва;
- зазначення строку придатності для безпечної імплантації виробу;
2) на зовнішній упаковці:
- найменування та місцезнаходження виробника і найменування та місцезнаходження уповноваженого представника, якщо виробник не є резидентом України;
- опис виробу;
- призначення виробу;
- характеристики для використання;
- напис: «виключно для клінічних досліджень», якщо виріб призначений для клінічних досліджень;
- напис: «виріб, виготовлений на замовлення», якщо виріб виготовлений на замовлення;
- повідомлення, що виріб є стерильним;
- місяць і рік виробництва;
- зазначення строку придатності для безпечної імплантації виробу;
- умови транспортування і зберігання виробу;
- для виробу, зазначеного у п. 5 Технічного регламенту, зазначається, що виріб містить речовину, отриману з крові або плазми крові людини.
Під час введення в обіг кожен виріб має супроводжуватися інструкцією для використання, в якій зазначаються:
- рік надання дозволу на маркування знаком відповідності технічним регламентам;
- інформація, зазначена на упаковці, крім інформації щодо місяця і року виробництва та строку придатності для безпечної імплантації виробу;
- параметри, передбачені виробником, та будь-які побічні ефекти від використання виробу;
- інформація, що дозволяє медичному працівнику обрати відповідний виріб, належне програмне забезпечення та комплектувальні частини;
- інформація, що дозволяє медичному працівнику або споживачу застосовувати виріб, його комплектувальні частини та програмне забезпечення належним чином, а також інформація про характер, сферу використання та час проведення контрольних перевірок і випробувань та/або про заходи з підтримання працездатності виробу;
- інформація, що дає змогу уникнути окремих ризиків, пов’язаних з імплантацією виробу;
- інформація про ризик взаємного впливу. Під ризиком взаємного впливу слід розуміти негативний вплив на виріб, спричинений приладами чи інструментами під час досліджень або лікування, і навпаки;
- вказівки, необхідні у випадку пошкодження стерильної упаковки, та у разі можливості відомості про методи повторної стерилізації;
- інформація про те, що виріб може бути використаний повторно (якщо це можливо) тільки у випадку, якщо він відновлений під відповідальність виробника до рівня відповідності встановленим вимогам.
Інструкція для використання повинна також включати відомості, що дозволять медичному працівнику інформувати споживача про протипоказання та застережні заходи, яких слід вживати під час використання виробу. Ці відомості повинні містити:
- інформацію, що дає змогу встановити строк експлуатації джерела енергії;
- застережні заходи, яких необхідно вжити у разі, коли спостерігатимуться зміни у функціонуванні виробу;
- застережні заходи, яких необхідно вжити у випадку впливу дії магнітних полів, зовнішньої електростатичної індукції, електростатичних розрядів, підвищення або коливання тиску та прискорення в обґрунтовано передбачуваних умовах навколишнього середовища;
- відповідну інформацію про лікарські засоби, для введення яких цей виріб розроблено;
- дату видання або останньої редакції інструкції для використання.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим