|
Во время работы секции были рассмотрены принципы и правила планирования и проведения КИ, особенности предрегистрационных испытаний, структура основных документов, распределение обязанностей, система обеспечения качества и роль регуляторных органов. Лекции были представлены сотрудниками департамента клинических испытаний лекарственных средств ГФЦ МЗ Украины и были направлены в первую очередь на предоставление необходимой информации фармацевтическим производителям, которые планируют регистрировать ЛС в Украине.
 Профессор Владимир Мальцев, руководитель отдела координации и контроля клинических испытаний лекарственных средств ГФЦ МЗ Украины, представил общую информацию о становлении КИ ЛС в Украине, привел исторические факты, ознакомил слушателей с законодательной базой и статистическими данными по основным направлениям. Он подчеркнул, что КИ ЛС в Украине стали важным этапом инновационной политики при разработке препаратов. В. Мальцев указал, что все КИ ЛС в Украине, как международные, так и локальные, должны проводиться и проводятся в соответствии с принципами надлежащей клинической практики (Good Clinical Practice — GCP), отраженными в Руководстве 42-7.0:2005, утвержденном приказом МЗ Украины от 22.07.2005 г. № 373, и с «Порядком проведения клинических испытаний лекарственных средств и экспертизы материалов клинических исследований», утвержденным приказом МЗ Украины от 13.02.2006 г. № 66. Вкратце описав основные положения и процедуры, В. Мальцев рассказал также об инспекциях КИ, о роли этических комиссий, о мониторинге побочных реакций ЛС при проведении КИ.
Профессор Владимир Мальцев, руководитель отдела координации и контроля клинических испытаний лекарственных средств ГФЦ МЗ Украины, представил общую информацию о становлении КИ ЛС в Украине, привел исторические факты, ознакомил слушателей с законодательной базой и статистическими данными по основным направлениям. Он подчеркнул, что КИ ЛС в Украине стали важным этапом инновационной политики при разработке препаратов. В. Мальцев указал, что все КИ ЛС в Украине, как международные, так и локальные, должны проводиться и проводятся в соответствии с принципами надлежащей клинической практики (Good Clinical Practice — GCP), отраженными в Руководстве 42-7.0:2005, утвержденном приказом МЗ Украины от 22.07.2005 г. № 373, и с «Порядком проведения клинических испытаний лекарственных средств и экспертизы материалов клинических исследований», утвержденным приказом МЗ Украины от 13.02.2006 г. № 66. Вкратце описав основные положения и процедуры, В. Мальцев рассказал также об инспекциях КИ, о роли этических комиссий, о мониторинге побочных реакций ЛС при проведении КИ.
Большой интерес слушателей вызвало объяснение требований приказа МЗ Украины от 17.04.2007 г. № 190. Так, дополнительные КИ эффективности и безопасности ЛС при проведении экспертизы регистрационных материалов необходимы в случае, если клинические данные представлены не в полном объеме или недостаточно обосновывают отдельные показания или противопоказания, схемы лечения; существуют негативные данные относительно эффективности или безопасности ЛС, требующие дополнительного изучения; проведенные КИ неадекватны для подтверждения эффективности и безопасности ЛС, или вызывает сомнение достоверность результатов проведенных КИ. Дополнительные испытания биодоступности и биоэквивалентности генерических ЛС при проведении экспертизы регистрационных материалов необходимы в случае, если представленные данные недостаточны или неадекватны для подтверджения биоэквивалентности; существует риск того, что возможные различия в биодоступности могут привести к терапевтической неэквивалентности. В зависимости от класса ЛС могут проводиться КИ биоэквивалентности (то есть исследования с участием человека в качестве испытуемого) или исследования in vitro.
Профессор В. Мальцев остановился на основных требованиях к клиническим базам, на которых можно проводить КИ, утвержденных приказом МЗ Украины от 17.05.2007 г. № 245, — существование действующей локальной комиссии по вопросам этики, наличие аккредитационного сертификата МЗ Украины, возможность привлекать необходимое количество профильных пациентов, возможность их наблюдения, современное инструментально-диагностическое и лабораторное оборудование, ведение первичной документации в соответствии с действующим законодательством, регулярный метрологический контроль оборудования, а также необходимый уровень квалификации исследователей.
Отдельное внимание В. Мальцев уделил месту Украины на глобальном рынке КИ. Он подчеркнул, что за прошедшие 10 лет в нашей стране создана четкая система взаимодействия всех структур, связанных с КИ. Благодаря этому количество международных исследований, регистрируемых в Украине, с каждым годом увеличивается. Однако наша страна сравнительно недавно проявляет активность в этой сфере; для сравнения: в США проводится в 10 раз, а в Европе в 3 раза больше КИ в перерасчете на 1 млн населения (в США — 38, в ЕС — 10, в Украине — 3,5 КИ на 1 млн населения). Количество пациентов, которых в Украине планировалось включить в КИ в качестве испытуемых в 2006 г., составляет 1,4% общемирового показателя. Интересно, что по сравнению с 2006 г. общее количество зарегистрированных в 2007 г. (до 31.10.2007 г.) КИ в Украине несколько уменьшилось (322 в 2006 г., 226 за 10 мес 2007 г.) — это произошло за счет существенного уменьшения количества «отечественных» КИ (со 164 в 2006 г. до 80 за 10 мес 2007 г.), что в свою очередь непосредственно связано с изменением нормативно-правовой базы регистрации ЛС в Украине.
Тем не менее, в структуре «отечественных» КИ все еще преобладают сравнительные испытания, а доля исследований биоэквивалентности остается небольшой (6,7% в 2006 г. и 2,5% в 2007 г.). В. Мальцев привел список основных публикаций, посвященных вопросам КИ, среди которых указал и «Клинические испытания лекарств» (МОРИОН, 2006), «Руководство по клиническим исследованиям лекарственных средств» (Авиценна, 2001), «Надлежащие клинические исследования биоэквивалентности» (методические рекомендации, ГФЦ, 2003), «Принципы применения методов математической статистики для определения биоэквивалентности» (методические рекомендации, ГФЦ, 2004), «Исследования биодоступности и биоэквивалентности — Руководство 42-7.1:2005 (приказ МЗ Украины от 25.04.2005 г. № 191), а также методические рекомендации по проведению КИ ЛС различных групп. В заключение профессор подчеркнул, что стратегия интеграции Украины в ЕС требует дальнейшего проведения мероприятий по гармонизации системы регламентации в отношении ЛС в Украине со стандартами и директивами Евросоюза.
 Руководитель группы обеспечения экспертизы клинических исследований департамента клинических исследований лекарственных средств ГФЦ МЗ Украины Виктор Бодак рассказал о современных принципах формирования досье заявленного ЛС отечественного производства с целью его дальнейшей регистрации в Украине. Он представил основные нормативно-правовые документы, регламентирующие проведение экспертизы материалов заявленных ЛС, описал ключевые этапы процедур и подробно остановился на типичных ошибках, которые допускают заявители при оформлении документов. Отдельно В. Бодак остановился на основных положительных результатах нововведений в нормативно-правовых документах при проведении экспертизы материалов, среди которых назвал такие:
Руководитель группы обеспечения экспертизы клинических исследований департамента клинических исследований лекарственных средств ГФЦ МЗ Украины Виктор Бодак рассказал о современных принципах формирования досье заявленного ЛС отечественного производства с целью его дальнейшей регистрации в Украине. Он представил основные нормативно-правовые документы, регламентирующие проведение экспертизы материалов заявленных ЛС, описал ключевые этапы процедур и подробно остановился на типичных ошибках, которые допускают заявители при оформлении документов. Отдельно В. Бодак остановился на основных положительных результатах нововведений в нормативно-правовых документах при проведении экспертизы материалов, среди которых назвал такие:
- приближение процедуры экспертизы регистрационных материалов к европейским требованиям;
- повышение требований к качеству и эффективности ЛС;
- определение необходимости в проведении дополнительных доклинических и клинических и/или других исследований по изучению заявленного ЛС;
- достижение прозрачности процедуры экспертизы материалов;
- упрощение процедуры экспертизы материалов;
- упрощение процедуры проведения экспертизы материалов на ЛС, содержащие в своем составе хорошо известные и изученные ранее вещества;
- избежание необоснованной траты времени.
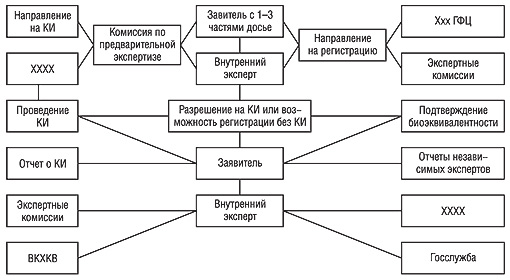
Детально был объяснен порядок прохождения материалов исследуемого препарата (рисунок). Эта информация, тем более в таком обобщенном виде, была чрезвычайно важной для участников семинара, поскольку дала возможность разобраться в существующих требованиях и поучиться на чужих ошибках.
|
 Лекция заместителя начальника отдела координации клинических испытаний ГФЦ МЗ Украины Татьяны Ефимцевой была посвящена обеспечению качества КИ, их организации и проведению. От качества КИ напрямую зависит как ценность и надежность полученных данных, так и соблюдение этических норм по отношению к испытуемым. Основные акценты были расставлены в расчете на отечественного производителя, который планирует и организует проведение «локальных» КИ, и, по сути, только учится применять принципы надлежащей клинической практики. Т. Ефимцева подчеркнула, что ответственность за каждый этап КИ в конечном счете ложится на спонсора КИ, и именно спонсор ответственен за внедрение адекватной системы обеспечения и контроля качества (разница между этими двумя терминами описана в Руководстве 42-7.0:2005, п. 3.3.46 и 3.3.47, что также было объяснено во время доклада). На основании раздела 5 Надлежащей клинической практики Т. Ефимцева предложила примерный список стандартных операционных процедур, которые должны быть разработаны производителем ЛС и выполняться при проведении КИ (Руководство 42-7.0:2005, п. 5.5):
Лекция заместителя начальника отдела координации клинических испытаний ГФЦ МЗ Украины Татьяны Ефимцевой была посвящена обеспечению качества КИ, их организации и проведению. От качества КИ напрямую зависит как ценность и надежность полученных данных, так и соблюдение этических норм по отношению к испытуемым. Основные акценты были расставлены в расчете на отечественного производителя, который планирует и организует проведение «локальных» КИ, и, по сути, только учится применять принципы надлежащей клинической практики. Т. Ефимцева подчеркнула, что ответственность за каждый этап КИ в конечном счете ложится на спонсора КИ, и именно спонсор ответственен за внедрение адекватной системы обеспечения и контроля качества (разница между этими двумя терминами описана в Руководстве 42-7.0:2005, п. 3.3.46 и 3.3.47, что также было объяснено во время доклада). На основании раздела 5 Надлежащей клинической практики Т. Ефимцева предложила примерный список стандартных операционных процедур, которые должны быть разработаны производителем ЛС и выполняться при проведении КИ (Руководство 42-7.0:2005, п. 5.5):
1. Обеспечение и контроль качества
2. Контрактная исследовательская организация
3. Медицинская компетентность
4. Дизайн испытания
5. Организация исследования, сбор данных и ведение документов
6. Выбор исследователя
7. Распределение обязанностей
8. Вознаграждение субъектам исследования
9. Финансирование
10. Уведомление регуляторного органа и представление ему заявки
11. Одобрение этическим комитетом
12. Информация об исследуемом ЛС
13. Производство, упаковка, маркировка исследуемого ЛС
14. Поставка исследуемого ЛС и обращение с ним
15. Доступ к документам
16. Информация о безопасности
17. Составление отчетов о ПР
18. Мониторинг
19. Аудит
20. Нарушения
21. Преждевременное прекращение или приостановка КИ
22. Отчеты о КИ
23. Многоцентровые КИ
Конечно, указанные пункты представляют только минимум требований, но они являются основой системы обеспечения качества в КИ, а на них могут наслаиваться и другие, более детальные документы. В заключение Т. Ефимцева подчеркнула, что правильно организованная и внедренная система обеспечения качества КИ позволяет избежать ошибок и повышает доверие к результатам исследований, является обязанностью спонсора и должна охватывать все этапы от планирования до архивирования материалов КИ.
 Качество КИ во многом зависит от правильности разработанного протокола, а доверие к полученным данным — от грамотности составленного отчета, то есть эти два основных документа любого исследования должны всегда оставаться в зоне повышенного внимания производителя. Именно этой теме и было посвящено сообщение эксперта отдела экспертиз ГФЦ МЗ Украины Валентины Николаевой. Она рассказала об основных ошибках, которые допускают отечественные производители при разработке протоколов и написании отчетов КИ, среди них как «административные» (например, неадекватное название протокола, несоответствие названий протокола и отчета и др.), организационные (не предусмотрен мониторинг КИ, в отчете не указана серия исследуемого ЛС и пр.) и научные (неправильно выбран референтный препарат, неадекватные критерии включения, некорректное определение критериев эффективности и др.) ошибки. Существование хотя бы одной из приведенных в докладе ошибок может поставить под сомнение валидность полученных данных, а, следовательно, и результат КИ. В. Николаева подчеркнула, что эффективность и безопасность ЛС могут быть доказаны только при правильном планировании и проведении КИ.
Качество КИ во многом зависит от правильности разработанного протокола, а доверие к полученным данным — от грамотности составленного отчета, то есть эти два основных документа любого исследования должны всегда оставаться в зоне повышенного внимания производителя. Именно этой теме и было посвящено сообщение эксперта отдела экспертиз ГФЦ МЗ Украины Валентины Николаевой. Она рассказала об основных ошибках, которые допускают отечественные производители при разработке протоколов и написании отчетов КИ, среди них как «административные» (например, неадекватное название протокола, несоответствие названий протокола и отчета и др.), организационные (не предусмотрен мониторинг КИ, в отчете не указана серия исследуемого ЛС и пр.) и научные (неправильно выбран референтный препарат, неадекватные критерии включения, некорректное определение критериев эффективности и др.) ошибки. Существование хотя бы одной из приведенных в докладе ошибок может поставить под сомнение валидность полученных данных, а, следовательно, и результат КИ. В. Николаева подчеркнула, что эффективность и безопасность ЛС могут быть доказаны только при правильном планировании и проведении КИ.
 Еще одной стороной обеспечения качества КИ является адекватная организация эффективного сбора информации и оценки безопасности ЛС в ходе исследования — эту тему осветила руководитель группы надзора за побочными реакциями ЛС во время КИ Наталья Богачева. Она привела определения терминов, рассказала об основных документах, в которых должна содержаться информация о безопасности до, во время и после КИ, о распределении обязанностей по регистрации и учету побочных явлений и побочых реакций между спонсором КИ, исследователем и регуляторными органами. Подробно Н. Богачева остановилась на типичных ошибках, которые встречаются в соответствующем разделе протокола КИ — неправильное толкование терминов, нечеткое указание алгоритма действий для исследователя в случае побочных явлений, отсутствие информации об условиях прекращения лечения исследуемым препаратом и условий его возобновления и др. Также слушателям напомнили о порядке отчетности о побочных явлениях, отдельно для спонсора, отдельно для исследователя, обсуждались основные ошибки и неточности в сообщениях о серьезных побочных реакциях, а также требования к периодическим отчетам о безопасности.
Еще одной стороной обеспечения качества КИ является адекватная организация эффективного сбора информации и оценки безопасности ЛС в ходе исследования — эту тему осветила руководитель группы надзора за побочными реакциями ЛС во время КИ Наталья Богачева. Она привела определения терминов, рассказала об основных документах, в которых должна содержаться информация о безопасности до, во время и после КИ, о распределении обязанностей по регистрации и учету побочных явлений и побочых реакций между спонсором КИ, исследователем и регуляторными органами. Подробно Н. Богачева остановилась на типичных ошибках, которые встречаются в соответствующем разделе протокола КИ — неправильное толкование терминов, нечеткое указание алгоритма действий для исследователя в случае побочных явлений, отсутствие информации об условиях прекращения лечения исследуемым препаратом и условий его возобновления и др. Также слушателям напомнили о порядке отчетности о побочных явлениях, отдельно для спонсора, отдельно для исследователя, обсуждались основные ошибки и неточности в сообщениях о серьезных побочных реакциях, а также требования к периодическим отчетам о безопасности.
 Заключительным докладом этой секции было сообщение руководителя отдела аттестации и инспекции клинических баз ГФЦ МЗ Украины Людмилы Ковтун об инспекциях КИ в нашей стране. Она рассказала о порядке и процедурах проведения инспекции, а также о наиболее частых «находках» при проведенных проверках клинических баз.
Заключительным докладом этой секции было сообщение руководителя отдела аттестации и инспекции клинических баз ГФЦ МЗ Украины Людмилы Ковтун об инспекциях КИ в нашей стране. Она рассказала о порядке и процедурах проведения инспекции, а также о наиболее частых «находках» при проведенных проверках клинических баз.
Участники семинара имели возможность задать вопросы всем докладчикам и воспользовались ею в полной мере. Вопросов было задано большое количество, интересно, что их уровень был совершенно разный — от просьбы объяснить значение терминов до дискуссионных моментов со ссылками на конкретные пункты GCP. Очевидно, что подобные семинары необходимы сотрудникам фармацевтических компаний, работающих в Украине, поскольку позволяют более четко понять требования украинского законодательсва, ознакомиться с необходимыми процедурами на примерах и услышать анализ своих и чужих ошибок. Качественные КИ ЛС и рациональное применение доказательной медицины — существенный шаг в направлении оптимизации системы здравоохранения в целом. n
Елена Руднева,
фото Любови Столяр

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим