Європейський Регламент № 536/2014 з клінічних випробувань застосовується з кінця січня 2022 р. З 31 січня 2023 р. всі дослідницькі проєкти, що стосуються лікарських засобів для використання людиною, повинні схвалюватися відповідно до нової правової бази через електронний портал та реєструватися у Інформаційній системі клінічних досліджень (Clinical Trials Information System – CTIS). Якщо цей портал, що приходить на заміну EudraCT, не функціонуватиме належним чином, уся система регулювання клінічних випробувань у ЄС опиниться під загрозою збою. Наразі портал CTIS має серйозні недоліки навіть після 10 міс, — зазначено у спільній заяві 7 дослідницьких організацій Німеччини. За останні місяці ці проблеми не були усунені, а почастішали. Це означає, що заявки на клінічні випробування та їх обробка комітетами з етики значно погіршуються. Очікувано це призведе до значного послаблення конкурентоспроможності Європи як місця для випробувань та зростання ризиків для пацієнтів. Існує відчутна небезпека того, що дисфункція порталу CTIS призведе до потенційно постійної міграції випробувань ліків в інші регіони світу. Це також матиме негативні наслідки для раннього доступу пацієнтів у ЄС до нових методів лікування, підкреслено у спільній заяві наступних організацій:
- Робоча група комітетів медичної етики у Федеративній Республіці Німеччина (Arbeitskreis Medizinischer Ethik-Kommissionen in der Bundesrepublik Deutschland);
- Німецький університет медицини (Deutsche Hochschulmedizin — DHM);
- Мережа координаційних центрів клінічних випробувань (Netzwerk der Koordinierungszentren für Klinische Studien — KKS-Netzwerk);
- Федеральна асоціація виробників ліків (Bundesverband der Arzneimittel-Hersteller — BAH);
- Федеральна асоціація фармацевтичної промисловості (Bundesverband der Pharmazeutischen Industrie — BPI);
- Асоціація дослідницьких фармацевтичних компаній (Verband der forschenden Pharma-Unternehmen — vfa);
- Федеральна асоціація медичних контрактних інститутів (Bundesverband Medizinischer Auftragsinstitute — BVMA).
Враховуючи вищезазначене, асоціації вважають, що терміново необхідно продовжити перехідний період, який закінчується 31 січня 2023 р. відповідно до статті 98 (2) Регламенту № 536/2014, доки CTIS не буде фактично дороблений та перевірений. Федеральному уряду Німеччини настійно пропонується своєчасно забезпечити таке відтермінування разом з іншими державами — членами ЄС.
ЕМА повідомляє про повільний розвиток CTIS
Загалом із моменту запуску системи 31 січня 2022 р. у CTIS подано 428 заявок на клінічні випробування, з яких 374 — первинні, 41 — на суттєві зміни та 13 — на додавання нової відповідальної держави-члена (рисунок). Про це йдеться у повідомленні* Європейського агентства з лікарських засобів (European Medicines Agency — EMA) від 21 листопада.
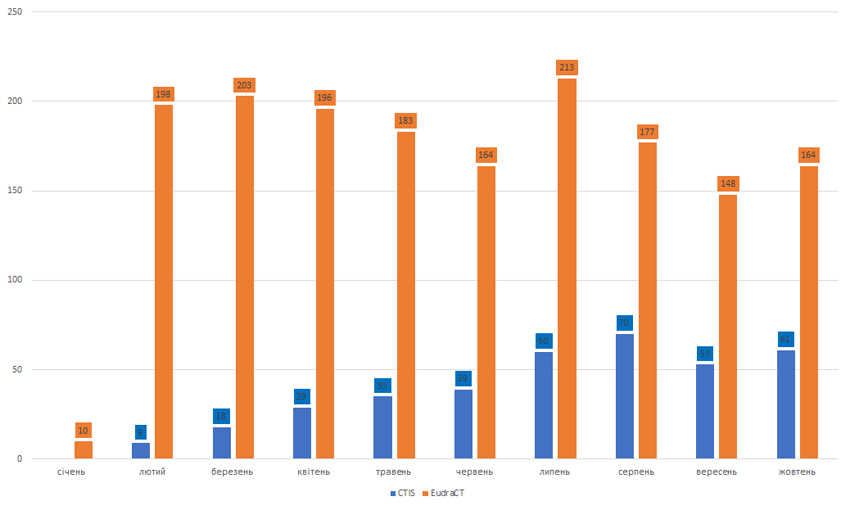
Влітку під час зустрічі організаторів CTIS, про яку повідомляло Товариство професіоналів з регуляторних питань (Regulatory Affairs Professionals Society — RAPS), йшлося, зокрема, про проблеми з оновленням деяких документів на порталі та реєстрацією платформних випробувань. Наприклад, кожну нову частину потрібно вводити як абсолютно нове випробування. Це означає, що в багатьох країнах компанії все ще повинні сплачувати повну плату за кожне подання замість того, щоб оплатити розгляд оновлень.
*Key performance indicators (KPIs) to monitor the European clinical trials environment. EMA/860547/2022.
За матеріалами www.bpi.de; www.ema.europa.eu; www.raps.org

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим