«Дике Поле» — так називали у Середні віки причорноморські і приазовські українські степи…
У XIV–XV ст. Дике Поле увійшло до складу Великого князівства Литовського. Але фактично тут панувало безвладдя. Це вабило різних утікачів, розбійників, авантюристів і впевнених у собі господарів-хуторян, мисливців, купців.

Слабкі регуляторні вимоги, відсутність належного державного контролю і безкарність порушників створили стимули для швидкого розвитку аптечного сегменту дієтичних добавок та косметичних продуктів. Крім відповідальних виробників, така ситуація приваблює на цей ринок шахраїв, авантюристів та злочинців. Це створює серйозну небезпеку для споживачів цих продуктів, неконкурентне середовище для бізнесу, а також зменшує довіру до системи охорони здоров’я взагалі і до аптек зокрема.
1. Визначення
Термін «дієтична добавка» (ДД) було введено в законодавство у 2014 р. . Він замінив поняття «біологічно активна добавка», який використовувався в нормативних документах до 2014 р. Згідно з поточною редакцією , ДД — це «харчовий продукт, що споживається у невеликих визначених кількостях додатково до звичайного харчового раціону, який є концентрованим джерелом поживних речовин, у тому числі білків, жирів, вуглеводів, вітамінів, мінеральних речовин (цей перелік не є виключним), і виготовлений у вигляді таблеток, капсул, драже, порошків, рідин або інших формах».
Термін «косметична продукція» (КП) наведено в Технічному регламенті на косметичну продукцію, затвердженому КП — це «будь-яка речовина або суміш, призначена для нанесення на різні зовнішні ділянки тіла людини (епідерміс, волосся, нігті, губи, зовнішні статеві органи), зуби, слизову оболонку ротової порожнини виключно або переважно з метою їх очищення, ароматизування, зміни зовнішнього вигляду, захисту, збереження у задовільному стані або коригування запаху тіла».
ДД та КП внесені до «Переліку товарів, які мають право придбавати та продавати аптечні заклади та їх структурні підрозділи», затвердженого .
ДД та КП продаються не лише в аптеках, але в цій статті ми розглянемо лише аптечний сегмент продажу цих продуктів.
2. Поточна ситуація в аптечному сегменті ринку ДД та КП
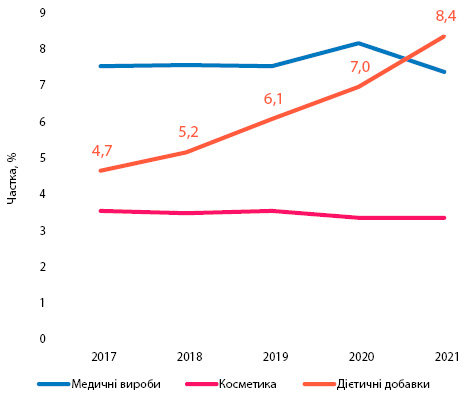
Обсяги продажу ДД в аптеках швидко зростають, за останні 5 років їх сегмент збільшився вдвічі — від 4,7 до 8,4% (рисунок). Фактично, ДД забирають частку ринку у групи лікарських засобів, питома вага яких в «аптечному кошику» за цей період зменшилася з 84,6 до 81,4%.
Частка аптечного продажу КП протягом 5 років залишається відносно стабільною і становить близько 4%.
Регуляторні вимоги до обігу ДД та КП в Україні на сьогодні слабкі і навіть вони часто не виконуються учасниками ринку і не контролюються регуляторами. Відсутність ефективної системи регулювання і державного контролю за виконанням вимог законодавства щодо якості та безпеки ДД та КП (див. в наступному розділі) призвела до формування в цих сегментах аптечного «Дикого поля», де панує безлад і не діє Закон.
У зв’язку з цим у цих сегментах ринку з’являються і одержують немалі прибутки різноманітні шахраї, авантюристи і просто злочинці, які в умовах хаосу і безкарності мають значні конкурентні переваги перед відповідальними та законослухняними виробниками і дистриб’юторами ДД та КП.
На сьогодні відсутні відповідні статистичні дані і системні дослідження, тому важко оцінити масштаб та загрозу проблем і порушень під час виробництва, імпорту та продажу ДД та КП в аптеках та поза ними. Але окремі оприлюднені випадки виявлених порушень свідчать про їх реальну небезпеку для здоров’я і життя споживачів.
Найбільш поширеними видами шахрайства, фальсифікації та введення в оману споживачів ДД та КП в аптеках і поза ними є наступні:
- найбільш небезпечний — продаж ДД та КП, що містять незадекларовані компоненти, наприклад, сильнодіючі синтетичні активні фармацевтичні інгредієнти (АФІ) (щоб посилити дію таких продуктів, переконати споживачів у їх ефективності і заохотити до наступних покупок);
- ДД та КП, що не містять задекларовані компоненти (щоб зменшити собівартість таких продуктів і отримати більший прибуток);
- ДД та КП — «клони»/копії лікарських засобів — з тими ж АФІ та в таких самих (чи вищих) дозах і лікарських формах. Фактично такі ДД та КП є незареєстрованими лікарськими засобами, які з’являються на ринку в обхід усіх регуляторних процедур для лікарських засобів і реалізуються тими ж каналами збуту, що і лікарські засоби;
- позиціонування ДД та КП як замінників ліків, продаж їх співробітниками аптек замість лікарських засобів, часто без попередження пацієнтів, що вони отримують замість лікарських засобів інші види продуктів;
- реклама ДД та КП з непрямим переконанням споживачів, що вони справляють лікувальний ефект.
Під час конференції «ДФУ — європейська якість вітчизняних лікарських засобів», що відбулася 25.11.2021 р., Наталя Останіна, завідувач Державної науково-дослідної лабораторії з контролю якості лікарських засобів Інституту громадського здоров’я ім. О.М. Марзєєва Національної академії медичних наук України, навела деякі результати контролю ДД, закуплених в аптеках Києва:
- у складі 2 із 7 перевірених зразків ДД для підвищення потенції у чоловіків (виробництва компанії ШеньЧжень Гонсен Байоледжі Індастрі Ко.Лтд., Китай) було виявлено наявність незадекларованого силденафілу — синтетичного АФІ, що входить до складу лікарських засобів, що застосовуються при еректильній дисфункції;
- у зразках капсул ДД Togkat Ali Jack, що декларуються як натуральний рослинний продукт, було виявлено близько 200 мг (!) невказаного у складі тадалафілу — також синтетичного АФІ, що входить до складу препаратів для лікування пацієнтів з еректильною дисфункцією в добових дозах 5-10-20 мг;
- у 36 зразках ДД для схуднення (з 51 перевірених) у різних кількостях було виявлено незадекларований сибутрамін — синтетичний АФІ, що входив до складу психотропних лікарських засобів, заборонених до застосування в Україні і включений до Списку № 2 «Психотропні речовини, обіг яких обмежено» Таблиці ІІ . Раніше про цю проблему повідомлялося ще у 2010 р., коли вперше в аптеках було виявлено 5 видів ДД із цим АФІ, що не був зазначений у складі;
- у перевіреному зразку ДД Кардіпал виробництва Chuna Mardi, Індія, навпаки, не було виявлено будь-яких задекларованих рослинних екстрактів, вітамінів та лимонної кислоти.
Як приклади «клонів» лікарських засобів можна згадати КП, в назвах яких вказані назви АФІ або ГЛЗ: Крем косметичний Диклофенак, 50 мл; Хлорофіліпт Active Plus, 15 мл; Гель для суставів ібупрофен з бадягой «Ібупрогель»; Фурацилін таблетки/порошок/саше тощо. У складі ДД Дікапсіл, капсули, виробництва ПП «Фарма плюс Україна» декларуються наявність п’яти рослинних екстрактів, як в оригінальному ЛЗ Уролесан, але у двічі більших дозах.
На фото нижче показана типова вітрина для споживачів українських аптек з продуктами для покращення чоловічої потенції, яка свідчить про просування в аптеках ДД та КП як рівноцінних замінників лікарських засобів (рис. 2).
Це демонструє звичні порушення аптеками відразу трьох вимог п. 163 Ліцензійних умов провадження господарської діяльності з виробництва лікарських засобів, оптової та роздрібної торгівлі лікарськими засобами, імпорту лікарських засобів (крім активних фармацевтичних інгредієнтів):
- розміщення у вітринах для споживачів рецептурних лікарських засобів;
- спільне розміщення у вітринах безрецептурних та рецептурних лікарських засобів;
- спільне розміщення у вітринах ліків та супутніх товарів — ДД та тестів на вагітність.
3. Причини привабливості продажу ДД та КП та порушень у цьому сегменті
3.1. Економічні чинники. Більша дохідність ДД та КП
Регуляторні вимоги до лікарських засобів передбачають проведення тривалих і дороговартісних досліджень для їх фармацевтичної розробки, клінічних випробувань, їх реєстрацію, виконання вимог Належної виробничої практики (Good Manufacturing Practice — GMP) під час виробництва та контролю якості лікарських засобів, створення та підтримання системи фармаконагляду тощо.
Для ДД та КП (до набуття чинності новим Технічним регламентом на КП) такі регуляторні вимоги відсутні, їх виробники не несуть вищевказаних витрат і, відповідно, такі продукти мають більш низьку собівартість у порівнянні з лікарськими засобами.
Крім того, чинною (зі змінами) встановлено граничні торгівельні (роздрібні) надбавки до закупівельних (оптових) цін на ліки, що входять до Національного переліку основних лікарських засобів, що закуповуються повністю або частково за рахунок коштів державного та місцевих бюджетів; та вартість яких підлягає реімбурсації. На ці групи лікарських засобів держава накладає обмеження щодо максимального відсотку надбавки, що, в кінцевому результаті, впливає на цінову політику.
Згідно з даними презентації компанії Proxima Research International на «Аптечному Саміті України», у грудні 2021 р. середньозважена аптечна націнка для ДД становила 23,8%, а для КП — 31,0% у порівнянні з такою для лікарських засобів у 16,5%. З урахуванням близької середньозваженої вартості однієї упаковки лікарських засобів, ДД та КП аптеки на продажу кожної упаковки ДД заробляють у середньому приблизно у 1,5 рази більше, а КП — приблизно у 2 рази більше, ніж під час реалізації лікарських засобів.
Тому аптекам значно вигідніше продавати ДД та КП, ніж лікарські засоби. І це сприяє швидкому збільшенню сегменту ДД в порівнянні з сегментом ліків.
3.2. Відсутність помітної візуальної різниці між ДД, КП та лікарськими засобами
На вторинних упаковках та в інструкціях для медичного застосування лікарських засобів звичайним розміром та товщиною шрифту вказується номер Реєстраційного посвідчення, присвоєний під час реєстрації його в Україні (наприклад № UA/10393/01/01).
На упаковках та в інструкціях для застосування ДД та КП в такий же спосіб вказуються номери технічних умов (наприклад ТУ У 10.8-00480862-011:2021) та позначення «Не є лікарським засобом».
Будь-які інші спеціальні позначення різних груп продуктів, що продаються в аптеках, сьогодні не передбачені чинним законодавством.
У зв’язку з цим, різні групи продуктів, що продаються в аптеках, важко візуально віднести до відповідної категорії навіть фахівцям. Це підвищує ризик помилок споживачів та можливості навмисних маніпуляцій з метою продажу ДД та КП замість лікарських засобів.
3.3. Слабкі регуляторні вимоги до ДД та КП
На відміну від законодавства розвинутих країн (наприклад Директива ЄС 2001/83), у ст. 2 Закону України «Про лікарські засоби», у визначенні термінів вказано, що до лікарських засобів відносяться в тому числі «…лікарські косметичні засоби та лікарські домішки до харчових продуктів».
Це створює ситуацію нечіткого розмежування ДД, КП та лікарських засобів і закладає підґрунтя для змішування цих понять.
У 2014–2020 рр. в Україні було відмінено або послаблено ряд нормативних вимог і процедур стосовно регулювання ДД та КП, а у 2017 р. ліквідовано або реорганізовано деякі регуляторні органи, які надали дозволи і контролювали обіг цих груп продуктів.
Закон України № 771/97-ВР «Про основні принципи та вимоги до безпечності та якості харчових продуктів» не визначає механізми забезпечення якості та безпеки ДД та відповідальність за порушення вимог. А у Законі України № 2042-VIII «Про державний контроль за дотриманням законодавства про харчові продукти, корми, побічні продукти тваринного походження, здоров’я та благополуччя тварин» не згадано такий вид продуктів, як ДД.
У 2014 р. до Державної Фармакопеї України (ДФУ) 2.0 (3 том) вперше увійшла загальна стаття «Дієтичні добавки», яку було оновлено в 2020 р. в ДФУ 2.4 на основі норм чинного законодавства України з урахуванням міжнародних вимог. На жаль, посилання на цю монографію або її вимоги не були враховані в жодному з нормативних документів МОЗ або Державної служби України з питань безпечності харчових продуктів та захисту споживачів (далі — Держпродспоживслужба) стосовно ДД.
У 2014 р. Уряд України запровадив та щорічно подовжував мораторій на перевірки бізнесу, а введення карантину у 2020–2021 рр. у зв’язку з епідемією COVID-19 ще більше послабило державний контроль за виробниками лікарських засобів, ДД та КП, їх дистриб’юторами та аптеками.
У результаті — значно нижчі регуляторні вимоги (таблиця) і менші ризики покарання за порушення законодавства під час виробництва та продажу ДД та КП у порівнянні з такими для лікарських засобів стимулюють дистриб’юторів та аптеки закуповувати ДД та КП сумнівної якості у сумнівних виробників та постачальників.
На відміну від лікарських засобів, діяльність з виробництва та торгівлі ДД та КП на сьогодні не підлягає ліцензуванню з боку регуляторних органів, а законодавством не регламентовані вимоги до їх розробки та досліджень, не передбачені процедури їх державної реєстрації, для їх виробництва немає регуляторних вимог щодо відповідності вимогам GMP.
Більш жорсткі вимоги до КП мають вступити в дію з 03.08.2022 р. відповідно до Технічного регламенту на КП, затвердженого Постановою КМУ від 20 січня 2021 р. № 65 (див. таблицю).
| Регуляторні інструменти | Лікарські засоби | ДД | КП | |
| Законодавство | Закон України «Про лікарські засоби» | Закон України «Про основні принципи та вимоги до безпечності та якості харчових продуктів» | Закон України «Про забезпечення санітарного та епідемічного благополуччя населення» (поточні) | Технічний регламент на КП, затверджений Постановою КМУ від 20 січня 2021 р. № 65 (з 03.08.2022 р.) |
| Резуляторний орган з необхідними компетенціями та ресурсами | +
(МОЗ, Державна служба України з лікарських засобів та контролю за наркотиками (далі — Держлікслужба) |
±
(Держпродспоживслужба) |
±
(Держсанепідслужба?) |
+
(Держлікслу-жба) |
| Реєстрація/держреєстр | + | –
(відмінена 2015 р.) |
– | + |
| Ліцензування виробництва, оптової та роздрібної торгівлі, імпорту | + | _ | _ | – |
| Регуляторні вимоги до виробництва | GMP | HACCP (необов’язковий) | – | GMP |
| Інспектування | + | – | – | + |
| Процедура вилучення з обігу | + | – | – | _ |
| Адміністративна/кримінальна відповідальність | + | – | – | ? |
Розуміння необхідності виправлення ситуації з ДД було відображено в «Про рішення Ради національної безпеки і оборони України від 30 липня 2021 року «Про стан національної системи охорони здоров’я та невідкладні заходи щодо забезпечення громадян України медичною допомогою».
Цим Указом КМУ доручено забезпечити до 1 грудня 2021 р. розроблення та затвердження Стратегічного плану розвитку системи охорони здоров’я населення на період до 2030 р., у тому числі «гармонізацію національного законодавства з вимогами Директиви 2002/46/ЄС, зокрема в частині унормування питань обігу та реалізації харчових і дієтичних добавок з метою захисту населення від несприятливих наслідків недобросовісного розповсюдження біологічно активних добавок».
На початок лютого 2022 р. такий «Стратегічний план» поки що не було затверджено, а в доступних текстах проєкту цього документа, розробленого МОЗ, не передбачено завдання унормування обігу ДД, вказане в Указі Президента № 369/2021.
Натомість, МОЗ запропонувало «нестандартний» підхід до вирішення проблеми ДД, розмістивши 12.11.2021 р. на своєму сайті для громадського обговорення проєкт наказу «Про внесення змін до переліку товарів, які мають право придбавати та продавати аптечні заклади та їх структурні підрозділи».
Цей проєкт передбачав виключення з дозволеного аптечного асортименту ДД, які містять в інструкціях до використання заборонену законами України та постановами КМУ інформацію про лікування або профілактику захворювань. Тобто автори цього проєкту вважали, що порушники законів України після затвердження цього документа виправляться і почнуть виконувати вимоги наказу МОЗ. Після отримання численних зауважень МОЗ зняло з розгляду цей проєкт.
Наразі Міністерство економіки спільно з Держпродспоживслужбою також розглядає питання необхідності розробки нового законопроєкту щодо врегулювання обігу ДД.
Фактично, на сьогодні сегменти ринку ДД та КП залишилися без державного нагляду.
Звернення до Держспоживслужби, Держлікслужби та МОЗ фармацевтичних виробників щодо порушень законодавства в цій галузі не призводить до будь-яких позитивних наслідків. Такі звернення або взагалі залишаються без відповіді, або ці регуляторні органи надають відписки, що не дають підстав і повноважень для наведення ладу в сфері торгівлі ДД та КП.
У керівництва цих регуляторних органів на сьогодні не спостерігається політичної волі, лідерства і бажання та відсутні необхідні ресурси, щоб займатися вирішенням цих проблем.
Єдиною державною установою, яка висловила готовність вирішувати цю проблему, був Антимонопольний комітет України.
4. Наслідки слабких регуляторних вимог та відсутності державного контролю ДД та КП
4.1. Ризики для здоров’я та життя пацієнтів
У разі використання ДД та КП з незадекларованими компонентами, у тому числі з високими дозами невідомих АФІ незрозумілої якості споживачі можуть зіткнутися з серйозними загрозами передозування, отруєння та неочікуваних побічних реакцій. У таких випадках лікарі можуть не надати вчасно правильну допомогу постраждалим, оскільки вони не знатимуть, які речовини спричинили погіршення стану споживачів ДД та КП.
Під час використання ДД та КП, які є «клонами» лікарських засобів з аналогічним складом АФІ, у споживачів можуть виникати ризики, пов’язані з відсутністю регуляторних вимог до ефективності, а також значно більш низькими вимогами до безпеки та якості цих продуктів у порівнянні з такими щодо ліків. Для виробництва ДД та КП можуть використовуватися АФІ та допоміжні речовини невідомої якості, невалідовані технологічні процеси, може бути відсутня повноцінна система контролю якості, невідома біодоступність АФІ в цих продуктах, сумнівна стабільність препаратів протягом терміну придатності тощо.
В інформаційних матеріалах, що супроводжують такі ДД та КП, як правило, не вказуються обмеження, протипоказання та передбачені побічні реакції, які зазначені в інструкціях з медичного застосування лікарських засобів. У ситуації, коли законодавством України не передбачені системи фармаконагляду для ДД, це несе додаткові загрози для здоров’я та життя споживачів.
І, нарешті, під час використання з метою лікування замість лікарських засобів неефективних ДД та КП, в тому числі таких, що не містять задекларованих компонентів, пацієнти можуть втратити час і погіршити здоров’я у зв’язку з ускладненнями хвороби та несвоєчасним отриманням адекватної медичної допомоги.
4.2. Зменшення довіри населення до системи охорони здоров’я
Занедбаний стан державної системи регулювання ДД та КП поглиблює недовіру громадян України до системи охорони здоров’я в цілому, оскільки на сьогодні МОЗ і Держлікслужба не реагують адекватно на таку ситуацію і не вживають будь-яких заходів для врегулювання вказаної проблеми.
Поточна ситуація робить практично невідворотними серйозні інциденти з погіршенням здоров’я споживачів ДД та КП, які можуть мати широкий медійний розголос і суспільний резонанс та викликати негативну реакцію суспільства щодо політиків, чиновників МОЗ, Держлікслужби та Держпродспоживслужби.
Сьогоднішня практика продажу ДД та КП, пряме та непряме введення в оману споживачів щодо можливості їх використання замість лікарських засобів завдають величезної шкоди репутації аптек як закладів охорони здоров’я і надійного джерела ефективних, безпечних і якісних продуктів.
Можливо, через кілька років фразеологізм «Як в аптеці!» (тобто «правильно, абсолютно точно») замість позитивного буде мати вкрай негативний сенс…
4.3. Ризики для відповідальних виробників
Крім суттєвих ризиків для споживачів, практика рекламування, просування і продажу ДД та КП замість лікарських засобів створює ризик нечесної конкуренції між виробниками ДД/КП і лікарських засобів, оскільки останні несуть більш високі витрати на розробку, дослідження, реєстрацію, виробництво та забезпечення якості своєї продукції.
У ситуації, що склалася, неконкурентоспроможними також стають відповідальні та законослухняні виробники ДД та КП, які програють на цьому ринку шахраям та авантюристам, які не виконують навіть слабкі поточні регуляторні вимоги до цих продуктів.
5. Деякі пропозиції для виправлення ситуації
Політикам і чиновникам КМУ слід визнати існування проблем з ДД та КП і якнайшвидше запланувати створення національної системи регулювання та державного контролю цих продуктів, взявши за основу підходи ЄС.
На наш погляд, доцільно наділити функціями державного контролю ДД в аптеках Держлікслужбу (КП вона має контролювати вже з 03.08.2022 р. згідно з Постановою КМУ від 20 січня 2021 р. № 65), яка є органом ліцензування аптек. У разі утворення нового регуляторного органу згідно з новою редакцією Закону України «Про лікарські засоби», ці функції можуть бути передані йому.
Найпершим нормативним рішенням має стати затвердження процедури Держлікслужби щодо вилучення з обігу ДД та КП, що несуть ризики для здоров’я і життя споживачів та створення правил і системи контролю за цими продуктами для запобігання вищевказаним проблемам у майбутньому.
Одним з елементів такого контролю може бути затвердження МОЗ позитивного та/або негативного переліків речовин, що, відповідно, можуть або не можуть використовуватися у виробництві ДД та КП.
Важливим кроком для покращення ситуації мають бути публічні заяви МОЗ та Держлікслужби з оцінкою ситуації та попередженням операторів ринку щодо небезпечної практики порушення нормативних вимог у цій галузі.
Важливо підвищити для аптек економічну привабливість продажу лікарських засобів. Наприклад, ввести «аптечний збір», плату за продаж кожної упаковки ліків, незалежно від її вартості, додатково до аптечної торгівельної (роздрібної) надбавки або ввести граничні торгівельні (роздрібні) надбавки до закупівельних (оптових) цін на ДД та КП.
Слід вилучити з визначення лікарського засобу в Законі України «Про лікарські засоби» згадку про «лікарські косметичні засоби та лікарські домішки до харчових продуктів».
Було б також корисним обговорити доцільність введення спеціальних помітних позначень, які б дозволяли легше візуально відрізняти одна від одної різні групи продуктів (ДД, КП та лікарські засоби).
Сергій Сур, доктор фармацевтичних наук, АРТЕРІУМ ЛТД.*


Коментарі