Готовность технологий и сертифицированных производственных мощностей — главные компоненты базовой готовности к эпидемическим угрозам. Клиническая разработка — оперативный компонент ответа при актуализации соответствующих проблем. «Вакцинная дипломатия», экономические соглашения — компоненты передачи иммунопрофилактической продукции конечным пользователям.
Небезопасное производство, известные риски
Одновременная реализация нескольких платформенных технологий ради снижения общего риска и создания вакцин для разных подгрупп населения — основа современной концепции биобезопасности. При этом цельновирионные инактивированные вакцины — наиболее традиционные из всех. Реализация данной технологии не требует разработки рекомбинантных белков, генов или специальных переносчиков. Вирус лишь инактивируют химическим веществом (например бета-пропиолактоном) и смешивают его с адъювантом (простейший — гидроксид алюминия), приводящим иммунную систему в состояние боевой готовности. Теоретически такие вакцины, содержащие полный набор вирусных белков, могут вызывать более обширный и универсальный иммунный ответ. И в отличие от мРНК-вакцин, требующих глубокой заморозки, их можно хранить при температуре обычного холодильника. Две из трех лидирующих по срокам вакцин китайской разработки — инактивированные (табл. 1). Одна из них — Bio-New Crown от «Sinopharm», получила разрешение на использование в Объединенных Арабских Эмиратах (ОАЭ), Бахрейне и (31 декабря, условное) в Китае. Из-за различий в регуляторных стандартах и процедурах эффективность в ОАЭ оценена на уровне 86%, а в Китае — 79,34%. Кроме того, получившая 3 января разрешение на экстренное использование в Индии от Специализированного экспертного комитета (Subject Expert Committee — SEC) Организации по централизованному контролю за соблюдением стандартов лекарственных препаратов (The Central Drug Standards Control Organisation — CDSCO) разработанная компанией «Bharat Biotech» вакцина Covaxin — также инактивированная. Индийская компания 8 января достигла целевого количества участников клинического исследования III фазы своей вакцины. В тот же день, что и Covaxin, разрешение от CDSCO получила вакцина Covishield — разработка Оксфордского университета (Oxford University) и компании «AstraZeneca». Владельцами разрешения на маркетинг данной вакцины в Индии являются заключившие лицензионные соглашения Институтом сывороток Индии (Serum Institute of India — SII) и «Bharat Biotech».
| Название, тип | Разработчики и некоторые партнеры | Регуляторное одобрение | Эффективность и цена за 1 дозу |
| COVID-19 Vaccine «AstraZeneca» (AZD1222, Covishield в Индии), векторная (нереплицирующийся аденовирус 5-го серотипа) | Управление перспективных биомедицинских исследований и разработок США (Biomedical Advanced Research and Development Authority — BARDA), Operation Warp Speed (OWS) | Великобритания, Индия, Аргентина, Доминиканская Республика, Сальвадор, Мексика, Марокко | 62–90%; 1,78 евро (2,16 дол. США) — 3 евро (4,5 дол.; 200 индийских рупий (2,26 евро) за первые 100 млн доз и 1000 рупий (11,2 евро) — за последующие для частного использования |
| Comirnaty (BNT162b2) на основе мРНК | «Pfizer», «BioNTech»; «Fosun Pharma» | Великобритания, Бахрейн, Канада, Мексика, США, Сингапур, Чили, Оман, Саудовская Аравия, Кувейт, ЕС, ВОЗ (подтверждение использования в чрезвычайных ситуациях) | 95%; 12 евро (14,6 дол.) — 23 евро (28 дол.); 1431 индийская рупия (16 евро) |
| Sputnik V (Гам-КОВИД-Вак (хранится до 6 мес при температуре ниже –18 °С) и Гам-КОВИД-Вак-Лио (при температуре 2–8 °С 6 мес), векторная (нереплицирующийся аденовирус 26-го и 5-го серотипов) | Национальный исследовательский центр эпидемиологии и микробиологии имени академика Н.Ф. Гамалеи (НИЦЭМ им. Н.Ф. Гамалеи) | Российская Федерация, ввод в гражданский оборот с августа 2020 до 1 января 2022 г., с декабря 2020 г. — для лиц в возрасте 60 лет и старше. По данным Российского фонда прямых инвестиций, привито более 1,5 млн человек; Беларусь | 92%; 1000 руб. (11 евро; 14 дол. — предельная); 8,24 евро (10 дол.); менее 734 индийских рупий (8 евро) |
| mRNA-1273, на основе мРНК | «Moderna», «BARDA», Национальный институт аллергии и инфекционных заболеваний (National Institute of Allergy and Infectious Diseases, NIAID) | США, Канада, ЕС, Израиль | 94,5%; 14,8 евро (18 дол.) — 30,5 евро (37 дол.); 2348 индийских рупий (27 евро) — 2715 индийских рупий (31 евро) |
| CoronaVac, адсорбированная (инактивированная) | «Sinovac Biotech Ltd»., «Butantan Institute» | Турция, Индонезия, ограниченное использование в Китае (с июля 2020 г.) | 50,35% — общая,78% — от симптоматического COVID-19 (Бразилия); 91 и 65% — Турции и Индонезии соответственно; цена в среднем 25 евро (30 дол.); 504 украинских грн (15 евро) за первые 5 млн доз; 1027 индийских рупий (12 евро); 1800 филиппинских песо (31 евро); 200 000 индонезийских рупий (11,7 евро) |
| Bio-New Crown, инактивированная | «Sinopharm» — дочерняя компания Beijing Institute of Biological Product’s, G42 Healthcare — эксклюзивный дистрибьютор на Ближнем Востоке и в Северной Африке | Китай (условное — 31 декабря; с июня 2020 г. ограниченное в группах высокого риска); введено более 4,5 млн доз); Бахрейн, ОАЭ | 86% — в ОАЭ, 79,34% — Китае. В среднем — 75 евро (65 дол.); менее 5650 индийских рупий (64 евро) |
| ЭпиВакКорона, субъединичная на основе пептидных антигенов (хранится при температуре 2–8 °С 6 мес) | Федеральное бюджетное учреждение науки «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора) | Российская Федерация с 13.10.2020 г. | 1000 руб. (11 евро; 14 дол.) |
Однако постоянная ответственность за риски, связанные с производством высочайшей степени биологической опасности, — та ноша, от которой США и Европа отказываются: в 2014 и 2017 г. живой полиовирус дважды «убегал» с европейских вакцинных производств (Duizer E. et al., 2017; Bandyopadhyay A.S. et al., 2019). «Я действительно не думаю, что инактивированная вакцина — хорошая идея, — отметил Монсеф Слауи (Moncef Slaoui), научный руководитель «Warp Speed» (Cohen J., 2020).., когда в ферментерах объемом 20 000 л содержатся триллионы вирусных частиц, которые затем дезактивируются… Технологии в современном мире позволяют нам не идти на такие риски». Вторая причина заключается в том, что в США в начале 1960-х годов была внедрена вакцина против инактивированного респираторно-синцитиального вируса, которая у некоторых детей приводила к увеличению выраженности симптомов заболевания (Glezen W.P. et al., 1986). Образование большого количества иммунных комплексов на основе неэффективных антител может приводить к тромбоэмболии мелких сосудов, что наблюдали в исследованиях in vivo вакцин против атипичной пневмонии и другого коронавирусного заболевания, ближневосточного респираторного синдрома (Cohen J., 2020).
Все дело — в дозе
В Поднебесной заявляют, что мировое первенство по вступлению в III фазу клинических исследований принадлежит получившей условное разрешение на использование в Китае в канун Нового года инактивированной вакцине Bio-New Crown от поддерживаемого государством фармацевтического гиганта «Sinopharm». Однако первой в стадию клинической разработки вступила не она, а разработанная Академией военных наук Китая и компанией «CanSino Biologics Inc.» вакцина другого типа, на основе аденовирусного вектора (Ad5). Именно эта платформа, по всей вероятности, имела наивысшую степень пандемической готовности, будучи «обкатана» при борьбе с эпидемией вируса Эбола. Соответствующая вакцина от «CanSino Biologics» для создания национальных запасов под управлением Национального управления лекарственных средств (National Medical Products Administration — NMPA) была одобрена в Китае в 2017 г. Это сделало ее первой и до сих пор единственной аденовирусной векторной вакциной, разрешенной для людей, — с небольшой оговоркой, что исследование II фазы не доказало предотвращения заражения вирусом Эбола, а просто продемонстрировало выраженный иммунный ответ с быстрым снижением уровня антител в течение 6 мес после вакцинации (Zhu F.C., 2017). Вообще у аденовирусных векторов — долгая 40-летняя история, включающая неудачи генной терапии, затормозившие ее развитие на 15 лет, и провал вакцины против вируса иммунодефицита человека (ВИЧ) на основе Ad5 компании «Merck&Co.». Программа клинических исследований была остановлена в 2007 г., когда выяснилось, что вакцинация не предупреждает и, возможно, даже повышает риск заражения ВИЧ в подгруппе лиц с уже существующим иммунитетом к Ad5 (Buchbinder S.P. et al., 2008).
Досадная ошибка с дозированием, коммуникационные проблемы с Управлением по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) затормозили одобрение ранее считавшейся лидером вакцинной гонки AZD1222 от «AstraZeneca» и Оксфордского университета (Oxford University). Заявляют о ней как о «некоммерческой» (давно заявлено, что распространять ее будут по себестоимости), призванной обеспечить «глобальное предложение, справедливость и приверженность странам с низким и средним доходом» (Knoll M.D., Wonodi C., 2020). Как пишет «New York Times», партнером для коммерциализации после провалившихся переговоров с «Merck&Co.» стала «AstraZeneca», имеющая большой опыт с препаратами для лечения хронических заболеваний, но не вакцинами. В мае 2020 г. правительство США выделило «AstraZeneca» более 1 млрд дол. на разработку и производство вакцины в обмен на 300 млн доз. На тот момент планировали, что ею будет обеспечено 60% потребности США. Однако начало клинических исследований роковым образом задержалось в этой стране, но было начато в Великобритании и других странах. Тут Оксфорд допустил серьезный просчет, ошибочно расценив выпущенный контрактным производителем продукт как имеющий вдвое более высокую дозу. Истина была установлена только после того, как исследователи обратили внимание на меньшую, чем раньше, частоту и выраженность побочных реакций. Отклонение от запланированного хода исследования потребовало внесения изменений в протокол.
Кроме того, в июле у британского участника II/III фазы исследования развились неврологические симптомы, соответствующие поперечному миелиту, и исследование ненадолго было приостановлено. Впоследствии сообщили, что у пациента выявлен рассеянный склероз. Позднее летом другой участник того же исследования заболел с аналогичными симптомами. Это вызвало беспокойство из-за потенциальной связи с вакциной. В Великобритании, Бразилии, Индии и Южной Африке регуляторные органы разрешили возобновить исследование менее чем через неделю. В Японии пауза составила чуть меньше месяца. Но в США задержка затянулась до 23 октября, и небольшое количество добровольцев, получивших первую прививку в первые дни исследования, не смогли получить ревакцинацию примерно через месяц. Сейчас в исследование включено только 18 000 участников, что чуть больше половины запланированного. Отчасти в задержке виновата компания «AstraZeneca», заявили люди, осведомленные о переговорах FDA: компания не спешила предоставлять регулятору данные, потребовавшиеся для возобновления исследования.
Почему же в половинной дозе вакцина оказалась эффективнее, чем в полной (Voysey M., Clemens S.A.C., Madhi S.A. et al., 2020)? Объяснение поступило не от компании, а от вышеупомянутого М. Слауи (Moncef Slaoui), сообщившего журналистам, что многообещающая вакцина в половинной дозе не тестировалась на лицах в возрасте старше 55 лет. Опубликованный в «The Lancet» промежуточный анализ исследований свидетельствует, что у некоторых участников длительность перерыва между дозами доходила до 3 мес и дольше вместо 1 мес (Knoll M.D., Wonodi C., 2020). В настоящее время «AstraZeneca» планирует новое глобальное исследование, в котором примут участие несколько тысяч участников, чтобы собрать больше данных о схеме, включающей начальную половинную дозу. Намечается также сотрудничество с российским разработчиком, создавшим вакцину с использованием двух типов аденовирусных векторов.
Заявка на будущее
Внедрение вакцин — вопрос во многом политический, связанный также с доминированием в научно-технологической сфере. Правящие в США силы явно остановили свой выбор на продвижении мРНК, предложив возглавить «Warp Speed» М. Слауи — выходцу из компании «Moderna». У разработчиков вакцин на основе мРНК до пандемии не было собственного производства в промышленных масштабах, что потребовало привлечения различных контрактных производителей. Немецкая пресса следующим образом описывает производственную цепочку «BioNТech», сотрудничающей с «Pfizer» (www.faz.net): МРНК-мессенджеры выпускают на головном предприятии в Майнце, а также неподалеку, в Идар-Оберштайне (Германия). Очисткой, то есть удалением побочных продуктов занята компания «Rentschler Biopharma» из Лаупхайма. Компании «Polymun» и «Demapharm» встраивают мРНК веществ-мессенджеров в так называемые липидные наночастицы. Компания Siegfried из Хамельна и, конечно, завод в Пуурсе (Бельгия), в свою очередь, заполняют флаконы готовой вакциной. Распределение обязанностей и состав игроков со временем меняются, но это не отменяет главного — потребности в сети высокотехнологических производств.
Вакцины и страны — лидеры по числу заказанных доз
По подсчетам «Bloomberg», всего в мире заключены разного рода соглашения относительно 8,33 млрд доз вакцин, которых хватило бы для 2-разовой вакцинации большей половины жителей Земли. Так, Индия заказала 2,2 млрд доз, Европейский Союз — 1,4 млрд, США — 1 млрд, COVAX — 700 млн, Великобритания — 367 млн, Китай — 300 млн. Наибольшее количество заказанных доз, по данным, собираемым Дьюковским инновационным центром глобального здоровья (Duke Global Health Innovation Center — DGHIC) при поддержке Фонда Билла и Мелинды Гейтс (Bill & Melinda Gates Foundation), приходится на «AstraZeneca»/Оксфордский университет, «Pfizer»/«BioNTech», «Johnson&Johnson», «Sanofi»/«GSK», Национальный исследовательский центр эпидемиологии и микробиологии имени академика Н.Ф. Гамалеи (НИЦЭМ им. Н.Ф. Гамалеи), «Moderna» и «Novavax» (рисунок).
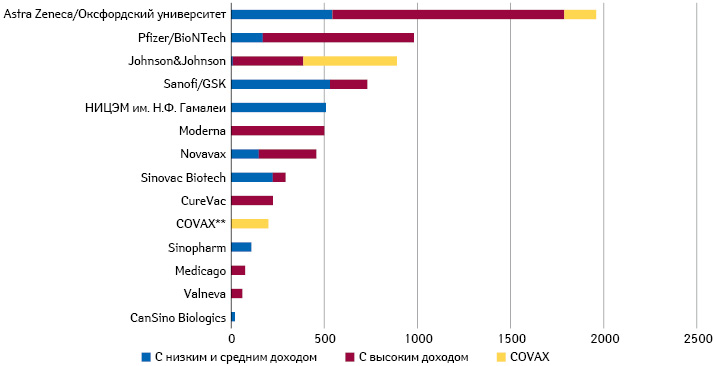
Объемы и сроки поставок, цены, разделение ответственности между производителями и странами — соответствующей информации мало и она отрывочна (табл. 2). Например, единственный контракт с Европейской комиссией, с которым могут ознакомиться лишь депутаты Европарламента и то не в полном объеме, — с компанией «Curevac». Другие, включая «Pfizer»/«BioNTech» и «Moderna», пока не дали необходимых разрешений. Сообщают, к примеру, что разногласия с американскими компаниями возникли относительно компенсации за нежелательные последствия вакцинации.
| AstraZeneca/Оксфордский университет | Pfizer/BioNTech | Johnson&Johnson | Sanofi/GSK | НИЦЭМ им. Н.Ф. Гамалеи | Moderna | Sinovac | Sinopharm | |
| ЕС | 400 | 300 | 200 | 300 | 160 | |||
| США | 500 | 200 | 100 | 100 | 200 | |||
| COVAX | 170 | 500 | 200 | |||||
| Индонезия | 50 | Неизвестно | 125 | 60 | ||||
| Великобритания | 100 | 40 | 30 | 60 | 17 | |||
| Канада | 20 | 20 | 38 | 72 | 40 | |||
| Индия | Неизвестно | 300 | ||||||
| Япония | 120 | 120 | 50 | |||||
| Бразилия | 100 | Неизвестно | 50 | 46 | ||||
| Латинская Америка | 150 | |||||||
| Мексика | 77 | 34 | Неизвестно | 32 | ||||
| Китай | 100 | |||||||
| Чили | 4 | 60 | ||||||
| Турция | 4,5 | 50 | ||||||
| Южная Корея | 20 | 20 | 6 | 20 | ||||
| Египет | 30 | 25 | ||||||
| Аргентина | 22 | Неизвестно | 25 | |||||
| Узбекистан | 35 | |||||||
| Непал | 25 | |||||||
| Перу | Неизвестно | 38 | ||||||
Информация о ценах хоть и не предоставляется официально, становится известной общественности другим способом. В декабре в твиттере бюджетного секретаря Бельгии случайно появился прайс-лист с количеством доз, на которые претендует Бельгия, и согласованными с Европейской комиссией ценами:
- «Oxford»/«AstraZeneca»: 1,78 евро (2,16 дол.);
- «Johnson & Johnson»: 7 евро (8,50 дол.);
- «Sanofi»/«GSK»: 7,56 евро (9,18 дол.);
- «Pfizer»/«BioNTech»: 12 евро (14,6 дол.);
- «CureVac»: 10 евро (12,4 дол.);
- «Moderna»: 14,8 евро (18 дол.).
Сколько приходится платить другим странам за получаемые вакцины — по большей части тоже известно отрывочно. К примеру, израильское «вакцинное чудо» (первое место по количеству прививок на душу населения) — только отчасти из-за всеобщего (исключая разве что Палестинскую автономию) охвата единой службой здравоохранения и фиксации в универсальной базе данных всех сведений медицинского характера. Так, по сообщениям СМИ, «Pfizer» обязалась поставлять 400–700 тыс. доз каждую неделю в обмен на данные граждан (без идентификаторов личности), которые получат 10 млн доз. Во вторую (возможно, и в первую) очередь Израиль согласился щедро платить за вакцину: по 28 дол. за дозу (23 евро).
В то же время газета «Washington Post» 19 декабря сообщала, что США платили «Pfizer»/«BioNTech» по 19,50 дол. за дозу, тогда как блок из 27 стран ЕС — 14,76 дол. Цена вакцины «Moderna» составляет 15 дол. за дозу для США и 18 дол. за дозу для ЕС. Днем ранее BBC сообщила, что компания «Pfizer» отпускает свои вакцины странам по цене от 10,65 до 21 дол. за дозу, а «Moderna» — от 25 до 37 дол. за дозу.
Пекин предложил Филиппинам вакцину от «Sinovac Biotech» по цене около 3600 песо (61,8 евро, 75 дол., 2100 грн) за 2 прививки. В Индонезии, по данным за октябрь 2020 г., согласована гораздо более низкая цена – 200 000 рупий (11,7 евро; 13,57 дол., 399 грн) за дозу.
Другую, первую полученную в Китае вакцину – от «Sinopharm» с дочерней компанией «China National Biotec Group» (CNBG), оценили еще дороже, но пока ее используют, кроме Китая, лишь ОАЭ и Бахрейн (см. табл. 2).
Эффективность, причем в реальных условиях, — то поприще, на котором мир ожидает еще очень много неожиданностей. Во всяком случае, дизайны клинических исследований вакцин существенно отличаются. Для начала упомянем лишь некоторые из них: использование в качестве компаратора лишь плацебо («BioNTech»/«Pfizer», «Moderna») или также менингококковой конъюгированной вакцины («AstraZeneca»/Оксфордский университет); определение нуклеиновых кислот и /или уровня антител к вирусу при включении; разные конечные точки в отношении оценки случая подтвержденного COVID-19. Последнее приводит к совершенно разным заключениям об эффективности, что видно на примере китайской вакцины от «Sinovac».
В общем заявления, сделанные на основе предоставленных в регуляторные органы данных, при всей ответственности с ними связанной напоминает взаимные вызовы боксеров перед поединком. И хотя примеров несоответствия всевозможных моделей реальной ситуации в последнее время предостаточно, все же стоит упомянуть результаты анализа, свидетельствующие, что для предотвращения эпидемии (снижения пика более чем на 99%) эффективность вакцины должна составлять не менее 60%, если уровень охвата вакцинацией достигнет 100% (при базовом R0=2,5–3,5) (Sarah M. et al., 2020). При снижении охвата до 75 и 60% для этого потребуются вакцины с эффективностью не менее 70 и 80% соответственно. Чтобы остановить продолжающуюся эпидемию при том, что 5; 15 и 30% населения уже подверглись воздействию COVID-19, эффективность вакцины должна составлять не менее 80% при охвате 75%, чтобы снизить пик на 85–86; 61–62 и 32% соответственно. Основатель медицинской аналитической компании «Airfinity» Расмус Бек Хансен (Rasmus Bech Hansen) недавно представил на «Bloomberg TV» результаты прогноза, согласно которому 60–70% охвата вакцинацией США достигнут уже в апреле, Великобритания — в июле, а Европейский Союз — в начале сентября. Аналитик Airfinity Мэтт Линли (Matt Linley) подчеркнул, что при этом был учтен скептицизм в отношении вакцины, который станет препятствием для прививок в среднем 35% населения. Особенно поучительно в этом отношении будет сравнение мира «без вакцинации от COVID-19», в котором преимущественно проведет наступивший год наша страна, и близкими в культурном отношении европейскими странами.
Использованная литература
- Bandyopadhyay A.S., Singh H., Fournier-Caruana J. et al. (2019) Facility-Associated Release of Polioviruses into Communities-Risks for the Posteradication Era. Emerg. Infect. Dis.; 25(7): 1363–1369.
- Buchbinder S.P., Mehrotra D.V., Duerr A. et al. (2008) Efficacy assessment of a cell-mediated immunity HIV-1 vaccine (the Step Study): a double-blind, randomised, placebo-controlled, test-of-concept trial. Lancet; 372(9653): 1881–1893. doi: 10.1016/S0140-6736(08)61591-3.
- Cohen J. (2020) Leader of U.S. vaccine push says he‘ll quit if politics trumps science. Science, Sep. 3, at www.sciencemag.org/news/2020/09/leader-us-vaccine-push-says-he-ll-quit-if-politics-trumps-science-approval-process
- Cohen J. (2020) China’s vaccine gambit. Science 11 Dec: Vol. 370, Issue 6522: 1263–1267.
- Duizer E., Ruijs W.L., van der Weijden C.P., Timen A. (2017) Response to a wild poliovirus type 2 (WPV2)-shedding event following accidental exposure to WPV2, the Netherlands, April. Euro Surveill.; 22(21): 30542.
- Glezen W.P. et al. (1986) Am. J. Dis. Child. 140: 543–546; по Mullard A. Vaccine failure explained. Nature. Published online 12 December 2008, at www.nature.com/news/2008/081212/full/news.2008.1302.html
- Knoll M.D., Wonodi C. (2020) Oxford–AstraZeneca COVID-19 vaccine efficacy. The Lancet. December 08. doi.org/10.1016/S0140-6736(20)32623-4.
- Bartsch S.M., O’Shea K.J., Ferguson M.C. et al. (2020) Vaccine Efficacy Needed for a COVID-19 Coronavirus Vaccine to Prevent or Stop an Epidemic as the Sole Intervention. American Journal of Preventive Medicine, Volume 59, Issue 4: 493–503.
- Voysey M., Clemens S.A.C., Madhi S.A. et al. (2020) Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet (published online Dec 8).
- Zhu F.C., Guan X.-H. et al. (2020) Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial. The Lancet; 396(10249): 479–488.

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим