Напряженность вокруг ожидаемых сроков регуляторного одобрения усиливается. По сложившейся традиции США выдаст разрешение на маркетинг раньше ЕС. Одобрить вакцину до выборов американского президента — придать новое звучание «говорящей» фамилии действующего (Trump — англ. козырь, козырный). О потенциальной возможности «сделать это» сообщили на прошлой неделе Роберт Р. Редфилд (Robert R. Redfield), директор Центров по контролю и профилактике заболеваний (Centers for Disease Control and Prevention — CDC), и Стивен М. Хан (Stephen M. Hahn), комиссар Управления по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA), заявивший о готовности дать «зеленый свет» еще до завершения ІІІ клинической фазы. И даже «главный эпидемиолог» Энтони Фаучи (Anthony Fauci), по сообщению «Frankfurter Allgemeine Zeitung», сказал несколько дней тому назад, что если результаты тестов вакцины в компаниях будут «в подавляющем большинстве» положительными, процесс можно ускорить.
Будучи перенесенным в политическую плоскость, вопрос безопасности миллионов (!) людей приобретает особую окраску. И вот, проявляя редкое единодушие, компании-соперники по вакцинной гонке делают совместное заявление о том, что не будут добиваться регуляторного одобрения до тех пор, пока исследуемые продукты не станут безопасными и эффективными. Что означает это заявление? Заботу о «чести мундира» или просто финансово-промышленный капитал тяготеет к сопернику действующего президента на будущих выборах?
Итак, сроки. Продвижение работ по исследованиям и разработке отслеживает целый ряд трекеров — «The Washington Post», «The New York Times», «RAPS», «The Guardian», «BioRender», «The STAT», «National Geographic», «Bloomberg» и др. Действующий расклад таков: 37 вакцин на клинической и 91 — на преклинической стадии разработки (большинство разрабатываемых продуктов участвуют более чем в одном исследовании; рис. 1).

Девять вакцин-кандидатов, вступивших в ІІІ фазу исследований, — передовой отряд, к которому приковано всеобщее внимание. Как ни странно, несмотря на старт примерно в одинаковое время (в основном — лето 2020 г. в США), в запланированных сроках финиша имеются значительные расхождения. Итак, кто может надеяться стать первопроходцем? Самый ранний срок, на который запланировано окончание сбора данных для оценки достижения первичных конечных точек — декабрь 2020 г. (таблица). Но только в одном из них Украина (клинические базы в Киеве, Ивано-Франковске, Полтаве, Ровно, Сумах, Виннице и Житомире) фигурирует в качестве страны-участницы.
| Спонсор/партнер(-ы) | Вакцина (количество и возраст участников) | Ориентировочная (фактическая) дата начала исследования, место | Ориентировочные даты первоначального и окончательного завершения | Кратность введений | Максимальное время наблюдения |
| «AstraZeneca»/«Iqvia Pty Ltd» | AZD1222, нереплицирующаяся ChAdOx1 векторная (30 000, >18 лет) | 17 августа 2020 г., США | 2 декабря 2020 г./5 октября 2022 г. | 2 | 730 дней (2 года) |
| «PT Bio Farma»/«Faculty of Medicine Universitas Padjadjaran» и др. | Инактивированная производства «Sinovac» (1620; 18–59 лет в Индонезии) | 10 августа 2020 г., Индонезия | Январь 2021 г./сентябрь 2021 г. | 2 | 6 мес |
| «China National Biotec Group Company Limited»/«G42 Healthcare» и т.д. | Инактивированная (Vero cell) производства «WIBP» (45 000, >18 лет) | 16 июля 2020 г., Бахрейн, ОАЭ | 16 марта 2021 г. /16 сентября 2021 г. | 2 | 12 мес |
| Национальный исследовательский центр эпидемиологии и микробиологии имени академика Н.Ф. Гамалеи/министерство здравоохранения, правительство г. Москва и др. | Гам-КОВИД-Вак, кобинированная векторная (40 000, >18 лет) | 31 августа, 2020 г., Российская Федерация (г. Москва) | 1 мая 2021 г./1 мая 2021 г. | 2 | 6 мес |
| «BioNTech SE»/«Pfizer» (фазы І/ІІ/ІІІ) | BNT162b1 (РНК-вакцина) (29 481, 18–55 и 65–85 лет) | 29 апреля 2020 г., США, Аргентина, Бразилия, Турция | 19 апреля 2021 г./14 ноября 2022 г. | 2 | 2 года |
| Оксфордский университет (University of Oxford) (ІІ–ІІІ фазы) | Нереплицирующаяся векторная ChAdOx1* (12 330, 5–12; 18–55; 56–69; старше 70 лет) | 28 мая, 2020 г., Великобритания | Август 2021 г./август 2021 г. | 1 и 2 | 6 мес |
| Оксфордский университет (University of Oxford) | Нереплицирующаяся векторная ChAdOx1* (5000 медиков и лиц с повышенным риском заражения; ≥18 лет) | 2 июнь 2020 г., Бразилия | Сентябрь 2021 г./сентябрь 2021 г. | 1 и 2 | 12 мес |
| «Butantan Institute»/«Sinovac Life Sciences Co., Ltd.» | Адсорбированная (инактивированная) производства «Sinovac» (8870, медики 18–59, 60 лет и старше) | 21 июля 2020 г., Бразилия | Сентябрь 2021 г./октябрь 2021 г. | 2 | 12 мес |
| «CanSino Biologics Inc.»/Пекинский институт биотехнологий (Beijing Institute of Biotechnology) | Векторная Ad5-nCoV производства CanSino и Пекинский институт биотехнологий (40 000, >18 лет) | 30 августа 2020 г., Пакистан | 30 декабря 2021 г./30 января 2022 г. | 1 | 12 мес |
| «ModernaTX, Inc.»/Национальный институт аллергии и инфекционных заболеваний (National Institute of Allergy and Infectious Diseases — NIAID) | mRNA-1273 (30 000, >18 лет) | 27 июля 2020 г., США | 7 октября 2022 г./27 октября 2022 г. | 2 | 759 дней (2 года) |
| «Janssen Vaccines & Prevention B.V.» | Векторная Ad26.COV2.S (60 000, ≥18 лет) | 5 сентября 2020 г., США, Бразилия, Чили, Колумбия, Мексика, Перу, Филиппины, Южная Африка, Украина | 10 марта 2023 г./10 марта 2023 г. | 1 | 104 нед (2,5 года |
В R&D-проектах участвуют вакцины разных типов (рис. 2). Среди вступивших в клинические исследования в количественном отношении преобладают векторные вакцины (4 из 9), да и получение первых результатов, согласно утвержденным срокам, также можно ожидать от вакцины на основе аденовирусного вектора — AZD1222 или ChAdOx1, лицензированной компанией «AstraZeneca» у Оксфордского университета (University of Oxford). Из зарегистрированных исследований ІІІ фазы 2 будут «спонсированы» Оксфордом, а 1 — англо-шведской фармацевтической компанией (см. таблицу). Также на основе аденовирусного вектора изготовлены российская Гам-КОВИД-Вак (в двух формах — раствора и лиофилизата), китайская от CanSino и американо-бельгийская от Janssen (в составе корпорации Johnson & Johnson).
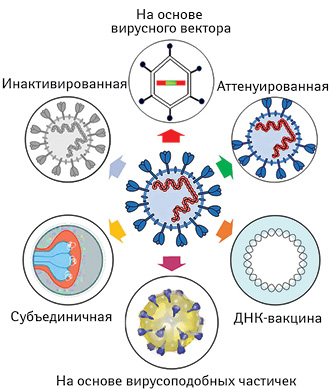
Две из них — разрабатываемая CanSino совместно с Пекинским институтом биотехнологий (Beijing Institute of Biotechnology), и Гам-КОВИД-Вак от Национального исследовательского центра эпидемиологии и микробиологии имени академика Н.Ф. Гамалеи (НИЦЭМ им. Н.Ф. Гамалеи) (а также инактивированная от Sinovac Biotech), разрешены к ограниченному использованию в группах риска повышенного заражения COVID-19. Вышеназванные разработки — CanSino Biologics и (отчасти, см. ниже) НИЦЭМ им. Н.Ф. Гамалеи, основаны на аденовирусе под названием Ad5, который повсеместно заражает людей и вызывает острые респираторные заболевания (ОРЗ). Проблема в том, что с 1980-х годов ни одна разработка на основе вектора Ad5 не увенчалась полным успехом. Аденоассоциированные вирусы — да, они дали миру одни из немногих на сегодня генных препаратов — Luxturna и Zolgensma. Правда, случилось это лет на 15 позже, чем могло бы: «эффектом разорвавшейся бомбы» для данной сферы стала смерть едва достигшего совершеннолетия одного из участников клинических исследований генной терапии с редким наследственным заболеванием на 4-е сутки после введения высокой дозы препарата на основе вирусного вектора Ad5 (Wilson J. M., 2009). С тех пор исследователи стараются работать с заболеваниями, для лечения которых достаточно небольших доз генных препаратов.
По поводу использования данных векторов для вакцинопрофилактики Люк Вандерберг (Luk H. Vandenberghe), доцент Гарвардской медицинской школы (Harvard Medical School), однажды отметил: «Есть мнение, что из неудачной генной терапии можно сделать хорошую вакцину». Тут, как обычно, очень многое зависит от дозы, и выделение воспалительных медиаторов в ответ на аденовирус избавляет от необходимости использовать адъюванты: соответствующий вектор стимулирует иммунный ответ и без него (Mcguire K. A., 2014).
У вакцин на основе данного вектора (Ad5) — своя непростая история. Большое будущее данных продуктов разработчики связывают с их способностью вызывать Т-клеточный иммунный ответ, в то время как традиционные вакцины на основе ослабленных вирусов или вирусных белков стимулируют преимущественно В-клетки. Выработанные антитела воздействуют на вирусы лишь до того момента, пока те проникнут в клетку. Поэтому исследователи «ухватились» за аденовирусные векторы в профилактике туберкулеза, малярии и синдрома приобретенного иммунодефицита человека (СПИДа). Однако крупную неудачу на этом пути потерпела компания «Merck & Co.», разработавшая вакцину против вируса иммунодефицита человека (ВИЧ) на основе Ad5. Программа клинических исследований была остановлена в 2007 г., когда выяснилось, что вакцинация не предупреждает и, возможно, даже повышает риск заражения ВИЧ в подгруппе людей с уже существующим иммунитетом к Ad5 (Buchbinder S.P. et al., 2008). Дальнейшие исследования этой, а также основанной на другом векторе (из семейства поксвирусов) вакцины были остановлены, о чем, в частности, сообщил Национальный институт аллергии и инфекционных заболеваний (National Institute of Allergy and Infectious Diseases — NIAID) США в феврале 2020 г. (nih.gov).
В 2017 г. Китай одобрил вакцину для предупреждения болезни Эбола компании «CanSino Biologics» для создания национальных запасов под управлением Национального управления лекарственных средств (National Medical Products Administration — NMPA). Это сделало ее первой и до сих пор единственной аденовирусной векторной вакциной, одобренной для людей, — с небольшой оговоркой, что исследование II фазы не доказало, что вакцина предотвращает заражение вирусом Эбола, а просто продемонстрировало выраженный иммунный ответ с быстрым снижением уровня антител в течение 6 мес после вакцинации (Zhu F.C., 2017). О длительности иммунного ответа после введения противоковидной вакцины «CanSino Biologics» данные пока не опубликованы — период наблюдения ограничился 28 днями (Zhu F.C. et al., 2020). Сама компания, очевидно, чувствует большой потенциал этого направления, так как сразу после одобрения вакцины против вируса Эбола объявила об открытии огромного — на 65 тыс. км2, завода, сертифицированного в соответствии с требованиями Надлежащей производственной практики (Good Manufacturing Practice — GMP), с производительностью 70 млн доз в год.
Предшествующий иммунитет против вирусного вектора — фактор, который предположительно может быть связан с нестойкостью иммунного ответа (впрочем, заражение COVID-19, как выяснилось, также характеризуется выраженным пиком 1-й фазы и стабилизацией на низком уровне — во 2-й). От этого стремятся уйти разработчики из НИЦЭМ им. Н.Ф. Гамалеи и компаний Janssen/Johnson & Johnson, использовавшие аденоассоциированный вирусный вектор Ad26 (природный иммунитет к которому выявлен у жителей Азии и Африки). Причем первые разработчики — наряду с Ad5, двумя введениями, а вторые — только Ad26 путем однократного введения. Вакцину от американо-бельгийского гиганта в скором времени смогут испытать на себе украинские пациенты (см. таблицу).
Оксфордская группа разработала собственный вектор, названный ChAdOx1, на основе аденовируса, выявленного в фекалиях шимпанзе. Совместная работа ученых из Оксфорда и компании «AstraZeneca» — также одна из лидирующих по срокам, благодаря предшествовавшей работе по предупреждению других коронавирусных заболеваний — тяжелого острого респираторного синдрома (Severe acute respiratory syndrome — SARS) и ближневосточного респираторного синдрома (Middle East respiratory syndrome — MERS).
Трудно пока судить и о перспективах другого нового типа вакцин — генетических, в том числе на основе информационной РНК (мРНК). Так, вакцины от «Moderna», а также от «BioNTech» совместно с «Pfizer» одними из первых вступили в клинические исследования, но пока опубликованы только результаты І фазы. Лидеры гонки среди инактивированных вакцин представлены китайскими разработками, на которые компании также возлагают большие надежды. Так, «Sinovac» подготовила производственные мощности, занявшие площадь 70 тыс. км2, готовясь выпускать 100 млн доз вакцины в год.
Масштаб, в котором страны собираются применять новые вакцины, — главный фактор риска введения вакцин в гражданское обращение. Десятки и сотни миллионов доз, о которых договариваются страны, могут обернуться неожиданными последствиями, способными изменить общественное отношение к мерам массовой профилактики. Очевидно, этот риск разделят прежде всего первопроходцы данной terra incognita — как со стороны разработчиков вакцин, так и стран — участниц вакцинальных кампаний. В этом отношении те, кто приобщится к ним позднее — и авторы проектов, и страны — будут иметь возможность учиться на ошибках других.
Список использованной литературы

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим