Проявляя осторожность и своевременно реагируя на возникающие сигналы безопасности, организаторы кампании таким образом дают понять гражданам: «Мы с вами, для нас важна жизнь каждого из вас». В то же время уверения в сохранении лишь общественно значимого баланса пользы и риска являются слишком общими и не вписываются в индивидуальный контекст. Особенно хорошо это понимают в странах Северной Европы, где органы здравоохранения обеспечили широкое признание случаев нарколепсии в качестве последствия вакцинации против пандемического гриппа в 2009 г. и выплатили сотни компенсаций (в одной только Швеции — более 400).
Слишком много неуверенности
Что больше всего мешает формированию готовности вакцинироваться, так это недомолвки, недосказанность, а то и просто сокрытие информации. Вот некоторые недавние примеры. Наиболее растиражированное объяснение сокращения поставок оксфордской вакцины в Великобританию и другие страны — проблемы с производительностью европейского завода и резервирование продукции Индийского института сывороток (Serum Institute of India — SII) для внутренних нужд страны-экспортера. Но причина, скорее всего, не только в этом, потому как правительство Великобритании объяснило задержку на 4 нед «различными техническими причинами», упомянув, что правительство Индии «не прекратило экспорт». По поводу недоступности европейской «партии из 1,7 млн доз» заявлено о «необходимости повторной проверки стабильности». Еще 30 млн доз вакцины во время инспекционной проверки выявлены на складе завода в Ананьи (Италия). Почему в условиях сокращения планов поставок в Европу вакцину держали на складе? Не потому ли, что при контроле качества возникли вопросы, на которые нельзя дать быстрых ответов? О том, что процесс сложный, свидетельствуют заявления «AstraZeneca» о «более чем 40 различных тестах контроля качества» каждой партии со стороны самой компании, плюс аналогичная проверка уполномоченным органом страны-импортера. При такой сложности технологии это нормально, а вот те, кто, объясняя задержки поставок из Европы и Индии, ничего об этом не говорят, выглядят неубедительно. Также вряд ли можно рассчитывать на доверие, трактуя заявление Европейского агентства по лекарственным средствам (European Medicines Agency — EMA) от 18 марта как свидетельствующее об отсутствии связи между редкими случаями тромбоза и вакцинацией (табл. 1).
| Таблица 1. Примеры сообщений, превалирующих в информационном поле, которые расходятся по смыслу с первоисточниками |
| От официальных лиц разных стран | Из первичных и близких к ним источников |
| Индия задерживает экспорт вакцины, чтобы сперва вакцинировать своих граждан | «Различные технические причины», при этом правительство Индии «не прекратило экспорт» (ВВС) |
| ЕМА утверждает, что «вакцина эффективна и безопасна», «нет связи между фактами вакцинации и риском образования тромбов у вакцинированных» | «Вакцина против COVID-19 от «AstraZeneca»: преимущества по-прежнему перевешивают риски, несмотря на возможную связь с редкими случаями тромбоза и тромбоцитопенией» (ЕМА) |
Результаты дорегистрационных исследований некоторых вакцин не опубликованы в рецензируемых журналах. В случаях, когда и регуляторное разрешение на использование не сопровождается обнародованием данных клинических исследований и заключений экспертов, что остается думать профессиональной общественности (табл. 2)? Что регулятору известно не больше, чем можно прочесть в пресс-релизах компаний? Если нет, то почему бы не опубликовать хотя бы минимальный набор данных вместе со статистическими выкладками? Также очень важно, какие производственные линии задействованы для выпуска продукции для нужд той или иной страны. Те же самые, что были проинспектированы Министерством здравоохранения Канады (Health Canada), а недавно и Агентством по контролю за лекарственными средствами и медицинскими изделиями Великобритании (Medicines and Healthcare products Regulatory Agency — MHRA), в случае с Covishield, к примеру?
| Таблица 2. Степень открытости различных компаний и регуляторных органов в отношении информации о вакцинах |
| Прозрачность | Дефицит прозрачности |
| Результаты исследований III фазы опубликованы в рецензируемых журналах («Pfizer»/«BioNTech», «Moderna», «AstraZeneca», «Janssen», «Novavax») | По результатам исследований III фазы опубликованы лишь пресс-релизы компаний («CanSino», «Sinopharm», «Bharat Biotech») |
| Публикация материалов заседаний экспертных комитетов и видеозаписей их конференций (FDA*, Anvisa*, ЕМА) | Огласке предают лишь выводы регулятора (Китай, Южная Корея, Индия, Украина) |
| Случаи нежелательных явлений представлены в научных статьях и материалах регулятора («AstraZeneca» с Vaxzevria) | Информация о случаях замалчивается и ее связь с вакциной немотивированно отрицается (см. в тексте) |
Технологию — «в хорошие руки»
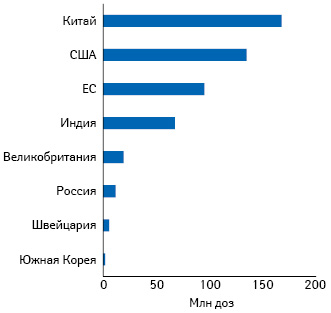
Весна 2021 г. — пик нехватки противоковидных вакцин. В сущности есть курируемые США проекты, позволившие обеспечить 100 млн доз в этой стране, и лишь в небольшой степени удовлетворяющие потребность Европы (рис. 1). Существуют проекты Китая и России, с трудом пробивающие себе дорогу путем «вакцинной дипломатии», и есть пока единственный в своем роде европейский, ставший ее многомесячной «головной болью». «Не ошибается тот, кто ничего не делает». Поэтому трудности, которые переживает компания «AstraZeneca», взявшая на себя груз ответственности за развитие вакцинного проекта Оксфордского университета (Oxford University) и предлагающая свой продукт по себестоимости, не являются предосудительными. Напротив, на сегодня нет другой столь масштабной по выпуску, не сложной в хранении, с благоприятным профилем эффективности и безопасности вакцины. С ней связывают надежды на снижение заболеваемости и смертности от COVID-19, которые уже начинают осуществляться. Однако значительная часть потенциальных рисков, связанных с качеством готового продукта, зависит от участников цепочки производства и распространения. Нужно знать об их слабых сторонах и трезво оценивать перспективы.
«AstraZeneca» выбрала модель децентрализованного производства, со своими достоинствами и недостатками. Только так можно поставить колоссальные объемы по всему миру, рискуя при этом потерять контроль над производственным процессом во время решающей фазы «масштабирования». «В то время как «Pfizer» решила сохранить контроль над производством активного ингредиента, «AstraZeneca» наращивала свои производственные мощности на нескольких континентах, — цитирует «Le Figaro» Прашанта Ядава (Prashant Yadav), аффилированного профессора технологии и управления операциями бизнес-школы «INSEAD». Однако таким образом сложнее контролировать процесс. Передача технологий субподрядчикам особенно проблематична, когда задействовано много объектов. Это означает, что внимание постоянно рассеивается».
Французам об этих особенностях известно особенно много, поскольку «именно Франция в лице министров Аньес Панье-Рунакер (Agnès Pannier-Runacher) и Оливье Верана (Olivier Véran) взяла на себя бразды правления переговорами от имени «двадцати семи» с «AstraZeneca». (Ее босс) Паскаль Сорио (Pascal Soriot) был первым, кто попросил, чтобы мы вели диалог на уровне Евросоюза, в стремлении иметь только одного собеседника, — свидетельствует французский источник. — «Двадцать семь стран, двадцать семь органов власти, — это выглядело очень сложно», — подтвердил производитель вакцины.
20 марта председатель Европейской Комиссии Урсула фон дер Ляйен (Ursula von der Leyen) пригрозила прекратить экспорт вакцины «AstraZeneca» против COVID-19, пока не будут выполнены обязательства перед ЕС. Так, англо-шведский фармацевтический гигант поставил только 30% из 90 млн доз вакцины (первоначально — 120 млн), обещанных на І кв. года. Планы на ІІ кв. также сокращены: 70 вместо 180 млн доз. Таким образом, за всю первую половину года «AstraZeneca» доставит только 100 из 300 млн доз, ожидаемых Брюсселем.
Как же так? Действительно, планы по наращиванию производства были наполеоновскими (оксфордская команда переоценила производительность, имея на руках лишь лабораторную технологическую платформу). Так, отлаженные производства выпускают обычно 100–200 млн доз вакцины в год. Здесь от контрактных производителей потребовалось впервые в большом масштабе индустриализировать технологию аденовирусных векторов, которую пока внедрили лишь при выпуске малых партий вакцины против Эболы от «Johnson & Johnson». Синонимом неудачи стал бельгийский завод компании «Henogen SA» из группы «Novasep» в Сенефе — всего в 40 км от брюссельского Берлемона, где базируется резиденция Европейской Комиссии. Но только ли низкая производительность одного из партнеров (сообщают, что заводы в Нидерландах и Великобритании работают по плану) стала причиной сокращения ожидаемых объемов поставок втрое?
Контроль качества — второй источник трудностей. Так, если раньше считалось, что Лондон, законтрактовавший свою вакцину раньше и по более высокой цене, узурпирует право на продукцию заводов по обе стороны Ла-Манша, то теперь и британские подданные будут страдать из-за сокращения поставок. 18 марта, выступая в Палате общин, министр здравоохранения Мэтт Хэнкок (Matt Hancock) сообщил о задержке «партии из 1,7 млн доз из-за необходимости повторно проверить ее стабильность». «Независимая аналитическая лаборатория, отвечающая за обеспечение контроля качества, необходимого для выпуска партий, не справляется с этим, задерживая доставку уже выпущенных доз», — пояснила «Les Echos» в статье от 12 марта. Согласно условиям договоров с Брюсселем заводы, входящие в европейскую производственную цепочку, проверяют должностные лица органов здравоохранения от имени Европейской Комиссии. «Иногда мы узнаем от субподрядчиков о трудностях еще до того, как об этом сообщили руководству группы, — сообщает источник, цитируемый ведущим французским изданием. — Последний раз проблема возникла при предварительных проверках качества».
Anvisa — новый островок регуляторной экспертизы
После устранения определенных технологических проблем 7 марта была завершена проверка соответствия и стабильности пробной партии вакцины от «AstraZeneca» на бразильском заводе Фонда Освальда Круза (Fundação Oswaldo Cruz — FIOCRUZ). С налаживанием второй производственной линии с апреля на заводе в Рио-де-Жанейро будут выпускать 1 млн доз в сутки, то есть 30 млн доз в месяц. 17–19 марта на нужды Национальной программы иммунизации доставлен первый миллион доз, а 12 марта первая вакцина местного производства зарегистрирована Национальным агентством по санитарному надзору. Одобрению предшествовала инспекция производства активного ингредиента на заводе компании «WuXi Biologics Co., Ltd» (Китай) в декабре 2020 г., завершившаяся выдачей сертификата о соответствии нормам Надлежащей производственной практики (Good Manufacturing Practic — GMP). Во втором полугодии 2022 г. собираются наладить массовый выпуск вакцины, на 100% изготавливаемой в Бразилии. Упомянув Anvisa, нельзя не отметить впечатляющие объем и качество информации, предоставляемой данным регулятором в виде отчетов, презентаций и видеоконференций.
Непрозрачность и «особая» деловая практика
А как же производители из Азии, ведь инициатива COVAX по большей части полагается на их продукцию? К сожалению, прозрачность деятельности и открытое признание недостатков — не их сильная сторона. Так, известна ведущая роль Индийского института сывороток в качестве мирового поставщика иммунобиологической продукции. При этом информации профессионального уровня о «буднях» деятельности предприятия очень мало. Ситуация с задержкой поставок, развивающаяся в эти дни, также освещается очень скупо. Так, поясняя отклонение от графика поставок в Великобританию следующих 5 из запланированных 10 млн доз, Адар Пунавалла (Adar Poonawalla), главный исполнительный директор SII, сослался на «требования государственной программы иммунизации в Индии». В то же время премьер-министр Великобритании объяснил задержку на 4 нед «различными техническими причинами» и пояснил, что правительство Индии «не прекратило экспорт», сообщило «ВВС» 19 марта. Не инспекция ли со стороны Европейского агентства по лекарственным средствам так повлияла на планы по импорту продукции SII? О ее результатах не сообщают ровно ничего, поэтому возникают разные предположения.
Апофеоз закрытости ради сохранения имиджа любой ценой был одной из частей трагедии во время вакцинальной противогриппозной кампании осенью 2020 г. в Южной Корее. Замалчивание, запоздалое признание фактов халатности с последующим малоубедительным отрицанием их связи с летальными исходами — такая картина вырисовывается по материалам из СМИ и официальных источников. Но, в то время как на заключениях о расследовании случаев летальных исходов после вакцинации еще и чернила высохнуть не успели, южно-корейские компании оказались вовлечены в развертывание вакцинного производства для мировых нужд. Так, «SK Biosciences», имеющая государственный контракт на распространение в стране вакцин от «AstraZeneca», «Janssen», «Pfizer», «Novavax» и др., получила в свое распоряжение технологии от «AstraZeneca» и «Novavax». Недавно 40,3 млн дол. США «SK Biosciences» были предоставлены международными фондами на разработку вакцины против вариантов, выявленных в Южной Африке и других странах, — GBP510. Еще одна компания — «Green Cross» — выбрана в качестве местного дистрибьютора вакцины мРНК-1237 от «Moderna». Она также выпустит 500 млн доз неназванной вакцины по контракту с Коалицией по инновациям в эпидемической готовности (Coalition for Epidemic Preparedness Innovations — CEPI), — сообщило издание «Korea Herald» в начале марта. «Green Cross» также намерена выпускать российскую цельновирионную КовиВак, а другие компании («Binex», «Isu Abxis» и «Hankook Korus Pharm») собираются изготавливать Спутник V.
Китай — поставщик не только вакцин, но и субстанций для вакцинных производств (например, в Бразилию). Между тем, местную отрасль критикуют за огромную вовлеченность в коррупционные схемы и всеобъемлющую непрозрачность. К примеру, издание «New York Times» 7 декабря 2020 г. опубликовало статью- расследование о фактах подкупа должностных лиц в Китае местными компаниями — производителями вакцин, а также замалчивании и угрозах при попытках разобраться с фактами вреда здоровью при их использовании. Приходится признать, что максимизация общественной пользы любой ценой и, в еще большей степени, стремление к власти и обогащению — значимые двигатели фармотрасли стран Азии.
Европейская стратегия
Европейский континент заплатил высокую цену за пандемию с 950 тыс. летальных исходов от COVID-19 по состоянию на конец марта 2021 г. (ecdc.europa.eu). Европейская Комиссия заключила соглашения о предварительных закупках с отдельными производителями вакцин от имени государств-членов. В обмен на право приобрести определенное количество доз вакцины в заданные сроки и по заданной цене Комиссия авансом профинансировала часть затрат производителей на общую сумму 2,7 млрд евро. При этом каждое государство-член имеет право на долю в заказанных Европейской комиссией поставках, пропорционально количеству своего населения (рис. 2). Но страны ЕС не обязаны приобретать все дозы, предварительно зарезервированные Европейской комиссией. Невостребованное количество может выкупить другая страна. Вот почему Германия вызвалась приобрести дозы вакцины «BioNTech»/«Pfizer», от которых отказались другие государства-члены, посчитавшие их слишком дорогими и непрактичными с точки зрения логистики.
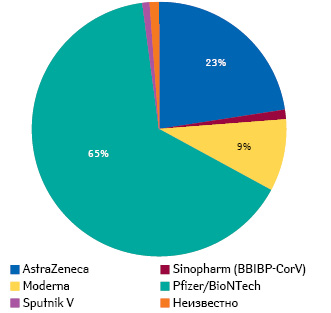
Неудовольствие ЕС вызывает политика США и Великобритании, которые до сих пор практически не экспортировали вакцины. В то же время, по словам комиссара ЕС Урсулы фон дер Ляйен, производители из ЕС с начала февраля отправили 41 млн доз вакцины в 33 страны, что сделало этот регион одним из крупнейших экспортеров вакцин против COVID-19. В то же время, по словам главы директората по безопасности товаров для здоровья и пищевых продуктов (Directorate General Health and Food Safety (SANTE) ЕС Сандры Галлина (Sandra Gallina), только одно из пяти производственных предприятий «Astra Zeneca», указанных в контрактах, в настоящее время поставляет вакцины в ЕС. Со своей стороны, Комиссия приняла механизм, обязывающий компании, производящие вакцины против COVID-19 в ЕС, сообщать о любом экспорте своей продукции в третьи страны. В результате этого 26 февраля Италия впервые заблокировала экспорт 250 000 доз вакцины «AstraZeneca» в Австралию. Чтобы избежать дефицита, Европейская комиссия подписала несколько новых контрактов с «Pfizer»/«BioNTech» и «Moderna» на более чем 600 млн дополнительных доз. 11 марта разрешено использование четвертой, однодозовой, вакцины от «Johnson & Johnson».
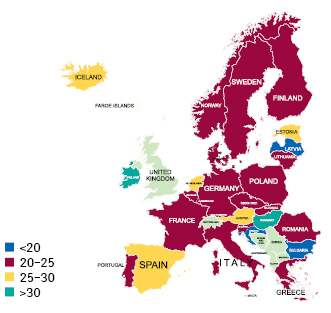
С помощью карты, публикуемой Европейским центром профилактики и контроля заболеваний (European Centre for Disease Prevention and Control — ECDC), можно отслеживать прогресс кампаний вакцинации в каждом государстве-члене (рис. 3). Так, на сегодня только Венгрия (50 доставленных доз на 100 жителей) и Ирландия (31,5 доз на 100 жителей) демонстрируют высокий охват вакцинацией. Успех Венгрии стал возможным благодаря независимой от ЕС политике обеспечения вакцинами. При этом страна дорого заплатила за дополнительные дозы вакцин — дороже, чем они обходятся США (подробный дашборд о ценах размещен по ). По этому пути уже пошли и другие страны-члены. Так, Германия, государство, традиционно выступающее за скоординированный подход на европейском уровне, подписала двусторонние контракты с «Pfizer»/«BioNTech», «Moderna» и «Curevac». Европейский комиссар по вопросам здравоохранения и безопасности пищевых продуктов Стелла Кириакидес (Stella Kyriakides) раскритиковала этот шаг, заявив, что «заключение дополнительных соглашений только подорвет европейский подход, который принес свои плоды». В то же время Дания и Австрия начали проект по производству вакцин второго поколения с Израилем, в то время как Польша обращается к китайской вакцине Sinopharm, а Словакия — к Sputnik V. Появляется все больше двусторонних инициатив, которые свидетельствуют об опасениях государств-членов по поводу медлительности европейской стратегии вакцинации.
kedglobal.com; skbioscience.co.kr; gck.kr; portal.fiocruz.br; www.lefigaro.fr;
www.lesechos.fr; www.gov.br; www.reuters.com; www.faz.net; www.china.org.cn

Коментарі
Коментарі до цього матеріалу відсутні. Прокоментуйте першим